钠尿肽受体A 在食管鳞状细胞癌中的表达及对食管癌细胞迁移和侵袭能力的影响
2021-03-22赵志龙王刚张宏亨
赵志龙,王刚,张宏亨
宝鸡市中心医院肿瘤外科,陕西宝鸡 721000
近年来,中国恶性肿瘤的发病率逐年升高,严重危害着人类的生命与健康,作为八大常见肿瘤之一的食管癌,在所有恶性肿瘤中的病死率居第6位,中国主要的高发地区为山西及河南。食管癌具有起病隐匿、恶性程度高、预后差、生存率低等特点。因此,寻找一种特异性表达于食管鳞状细胞癌的分子标志物,对食管鳞状细胞癌的早期诊断、靶向治疗及预后判断尤为重要。研究发现,钠尿肽受体 A(natriuretic peptide receptor A,NPRA)在多种人类肿瘤细胞株中均高表达,参与前列腺癌、肺癌、黑色素瘤等的发生、发展,发挥着癌基因的作用,但其在食管鳞状细胞癌中的表达情况目前尚不明确。本研究探讨了NPRA在食管鳞状细胞癌组织中的表达情况及其对食管癌细胞迁移和侵袭的影响,现报道如下。
1 资料与方法
1.1 一般资料
选择2011年2月至2015年11月宝鸡市中心医院收治的食管鳞状细胞癌患者。纳入标准:经术后病理检查证实为食管鳞状细胞癌;术前无化疗、放疗及免疫治疗史;临床资料完整。排除标准:合并其他恶性肿瘤。依据纳入和排除标准,本研究共纳入119例食管鳞状细胞癌患者。其中,男85例,女34例;年龄为49~72岁,中位年龄为64岁;TNM分期:I期40例,Ⅱ期47例,Ⅲ期32例;组织学分化程度:G级37例,G级53例,G级29例;有淋巴结转移53例,无淋巴结转移66例。收集患者的食管鳞状细胞癌组织119例和癌旁组织91例。其中,癌旁组织为距食管鳞状细胞癌组织边缘2 cm以上的食管组织,病理证实无肿瘤细胞浸润,无明显炎症,无明显细胞增生等病变,其所呈现的为正常组织表现。
1.2 免疫组织化学染色法检测NPRA的表达及结果判定
取食管鳞状细胞癌组织和癌旁组织标本,采用甲醛固定,常规石蜡包埋,制备4 μm切片,采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin-perosidase,SP)法进行染色,操作步骤严格按照说明书进行。NPRA兔抗人多克隆抗体购自美国Santa公司,NPRA抗体稀释浓度为1∶200。采用磷酸盐缓冲液(phosphate buffered saline,PBS)作为阴性对照。SP试剂盒与二氨基联苯胺(diaminobenzidine,DAB)显色剂均购自北京中杉金桥生物技术有限公司。NPRA阳性表达主要位于细胞质或细胞核中,呈黄色颗粒。随机选取5个高倍视野,阳性细胞百分比评分:0%~24%为1分,25%~49%为2分,50%~74%为3分,≥75%为4分;染色强度评分:无色为0分,棕黄色1分,褐色为2分。阳性细胞百分比评分与染色强度评分相乘,0~3分为低表达,4~8分为高表达。
1.3 细胞培养
食管癌细胞株Eca109、TE-1以及正常食管上皮细胞株Het-1A均由西安交通大学医学院生物医学实验中心提供。将细胞置于含10%胎牛血清 、100 μg/ml链霉素和 100 U/ml青霉素的RPMI1640培养液中进行培养。定期换液,使用2.5 g/L胰蛋白酶[含0.2 g/L乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)]离散细胞并用于传代。
1.4 蛋白质印迹法(Western blot)检测NPRA的表达情况
将接近长满瓶底的单层贴壁细胞用PBS轻缓洗涤2次,加入含苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)的RIPA细胞裂解液,冰浴30 min,将细胞刮下置入EP管中,4℃、12 000 r/min离心15 min,取上清,置于超微量紫外分光光度计中,定量测定总蛋白浓度。取50 μg蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后,半干法转至硝酸纤维素膜上。将转好的蛋白印迹膜在室温下用50 g/L脱脂牛奶封闭1.5 h,应用脱脂牛奶稀释的一抗4℃孵育过夜,PBST洗膜10 min,共4次,应用PBST稀释的二抗室温孵育1.5 h,洗膜10 min,共3次,电化学发光(electrochemiluminescence,ECL)检测,X 光片显影,扫描图像,分析结果。使用Image J软件分析条带灰度值,以β-肌动蛋白(β-actin)为内参,设定3个复孔,NPRA蛋白表达水平为NPRA蛋白条带灰度值/βactin蛋白条带灰度值。
1.5 NPRA 沉默序列的设计
采用短发夹RNA(short hairpin RNA,shRNA)沉默食管癌细胞株Eca109细胞中NPRA基因表达。根据GenBank中提供的NPRA mRNA序列,提交并委托上海吉凯生物有限公司设计并合成针对NPRA基因的沉默序列3条(sh-NPRA21897、sh-NPRA21898、sh-NPRA21899),并附1条NC序列作为阴性对照。分别将其转染至食管癌细胞株Eca109中,作为sh-NPRA21897组、sh-NPRA21898组、sh-NPRA21899组及sh-NPRA-NC组。
1.6 Transwell 小室实验检测食管癌细胞株Eca109的迁移和侵袭能力
在Transwell小室中进行细胞迁移和侵袭试验,sh-NPRA21897组、sh-NPRA21898组、sh-NPRA21899组及sh-NPRA-NC组食管癌细胞株Eca109成功转染后,放入Transwell小室的上室,底部加入血清以诱导细胞进行迁移。然后培养8 h或24 h,细胞迁移到下室后用10%甲醛溶液固定,并采用0.5%结晶紫水合物溶液进行染色计数。
1.7 随访
所有患者出院后均进行5年随访,随访方式为电话或门诊随访,随访截止时间为2020年1月。统计患者的生存情况。
1.8 统计学分析
采用SPSS 18.0软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ
检验或Fisher确切概率法;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P
<0.05为差异有统计学意义。2 结果
2.1 食管鳞状细胞癌组织和癌旁组织中NPRA表达情况的比较
食管鳞状细胞癌组织中,NPRA阳性颗粒呈棕黄色或淡黄色,主要位于细胞质和细胞膜中;癌旁组织中NPRA着色较弱甚至无色,阴性对照中未见棕黄色颗粒(图1)。NPRA在食管鳞状细胞癌组织中的高表达率为69.7%(83/119),明显高于癌旁组织的27.5%(25/91),差异有统计学意义(χ
=36.894,P
<0.01)。
图1 NPRA 在食管鳞状细胞癌组织、癌旁组织及阴性对照中的表达情况
2.2 不同临床特征食管鳞状细胞癌患者食管鳞状细胞癌组织中NPRA 表达情况的比较
不同年龄、性别、淋巴结转移情况、肿瘤部位的食管鳞状细胞癌患者食管鳞状细胞癌组织中NPRA的高表达率比较,差异均无统计学意义(P
>0.05)。分化程度为G~G级、TNM分期为Ⅱ~Ⅲ期的食管鳞状细胞癌患者食管鳞状细胞癌组织中NPRA的高表达率分别明显高于分化程度为G级、TNM分期为I期的患者,差异均有统计学意义(P
<0.01)。(表1)
表1 不同临床特征食管鳞状细胞癌患者食管鳞状细胞癌组织中NPRA表达情况的比较(n=119)
2.3 生存情况的比较
NPRA低表达患者的5年生存情况优于NPRA高表达患者,差异有统计学意义(χ
=5.032,P
=0.025)。(图 2)
图2 NPRA高表达(n=83)和NPRA低表达(n=36)食管鳞状细胞癌患者的生存曲线
2.4 食管癌细胞株Eca109、TE-1以及正常食管上皮细胞株Het-1A中NPRA表达情况的比较
Western blot检测结果显示,NPRA在食管癌细胞株Eca109、TE-1中的表达水平分别为(0.68±0.03)和(0.57±0.02),均高于正常食管上皮细胞株Het-1A的(0.05±0.02),差异均有统计学意义(t
=15.365、13.893,P
<0.05);而食管癌细胞株Eca109、TE-1中NPRA的表达水平比较,差异无统计学意义(P
>0.05)。(图3)
图3 Western blot 检测食管癌细胞株Eca109、TE-1以及正常食管上皮细胞株Het-1A中NPRA的表达情况
2.5 不同组别食管癌细胞株Eca109中NPRA表达情况的比较
Western blot检测结果显示,sh-NPRA21897组、sh-NPRA21898组、sh-NPRA21899组中NPRA的表达水平分别为(0.08±0.03)、(0.06±0.02)、(0.09±0.03),均低于sh-NPRA-NC组的(0.78±0.02),差异均有统计学意义(t
=32.135、35.362、28.733,P
<0.05)。(图4)
图4 Western blot 检测不同组别食管癌细胞株Eca109中NPRA的表达情况
2.6 NPRA 对食管癌细胞株Eca109细胞迁移和侵袭的影响
使用未加基质胶的Transwell小室测定细胞的迁移能力,加基质胶的Transwell小室测定细胞的侵袭能力。结果显示,sh-NPRA21897组、sh-NPRA21898组、sh-NPRA21899组细胞的迁移数目和侵袭数目均明显低于sh-NPRA-NC组,差异均有统计学意义(P
<0.01)。(表2、图5)
表2 不同组别食管癌-细胞株Eca109中细胞迁移和侵袭数目的比较(个,x±s)
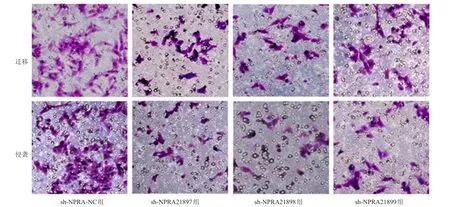
图5 Transwell 实验检测不同组别食管癌细胞株Eca109的迁移和侵袭情况(结晶紫染色,×200)
3 讨论
NPRA是钠尿肽受体家族中的一员,主要通过与心房钠尿肽(atrial natriuretic peptide,ANP)和脑钠尿肽(brain natriuretic peptide,BNP)结合来发挥其病理生理作用。文献检索后发现,NPRA在心血管系统中的研究较多,作用较为明确,其对舒张血管、抑制心肌纤维化、维持心血管稳定具有显著作用。随着对NPRA研究的不断深入,发现NPRA亦参与了机体的免疫和炎症反应,在肺癌、前列腺癌等多种恶性实体肿瘤组织与细胞中均显著高表达,参与了肿瘤的发生与发展过程,但其具体作用机制尚不明确。对其信号通路的研究发现,通过产生第二信使环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)和活化型依赖cGMP的蛋白激酶(cGMP-dependent protein kinase,PKG),活化的PKG反过来激活离子转运蛋白和转录因子,共同影响细胞的增殖和凋亡过程。NPRA在肿瘤中的特异性表达有望成为肿瘤诊断与预后预测的分子标志或治疗靶点。
NPRA在人类多种恶性肿瘤组织或细胞中高表达,其表达水平与肿瘤的恶性程度有关。本研究结果显示,食管鳞状细胞癌组织中,NPRA阳性颗粒呈棕黄色或淡黄色,主要位于细胞质和细胞膜中。NPRA在食管鳞状细胞癌组织中的高表达率为69.7%,明显高于癌旁组织的27.5%,差异有统计学意义(P
<0.01)。该结果与Wang等在前列腺癌中的研究结果一致,NPRA在前列腺癌组织和高级上皮内瘤变组织中的表达水平明显高于正常前列腺组织和良性前列腺增生组织;NPRA在前列腺癌中主要定位在细胞质,但在多数良性前列腺增生和轻度上皮内瘤变的细胞质中NPRA染色却非常少,而主要表达在这类细胞的细胞核中,提示NPRA
在肿瘤的发生发展中具有促癌作用,发挥着癌基因的功能。前列腺癌中NPRA高表达可能与炎症因子白细胞介素(interleukin,IL)-6、巨噬细胞抑制因子(macrophage inhibition factor,MIF)有关,Wang等也通过基因敲除技术证明了这点,并推测NPRA可能是MIF的上游调控因子,其可能通过MIF调控IL-6的表达,从而发挥促癌作用,但其具体的作用机制仍需进一步研究。本研究对患者的临床特征及生存情况进行分析,结果显示,分化程度为G~G级、TNM分期为Ⅱ~Ⅲ期的食管鳞状细胞癌患者食管鳞状细胞癌组织中NPRA的高表达率分别明显高于分化程度为G级、TNM分期为I期的患者,差异均有统计学意义(P<0.01)。NPRA低表达患者的5年生存情况优于NPRA高表达患者。Zhang等在胃癌细胞和组织中研究NPRA的表达时发现,沉默NPRA的表达后,电压门控钾离子通道蛋白KCNQ1的表达明显降低,同时在一定程度上抑制了肿瘤细胞的增殖和转移,而对其预后生存的研究发现NPRA蛋白高表达提示着更差的预后。
Kong等在研究NPRA基因敲除小鼠的生物学性状时发现,与正常小鼠相比,NPRA基因敲除小鼠支气管灌洗液中 IL-4、IL-5、IL-6 等促炎因子水平明显降低,具有更严重的气道阻塞症状和杯状细胞化生等;核因子κB(nuclear factor of kappa B,NF-κB)已被证实在肿瘤的发生发展中具有重要作用,可能在肿瘤晚期阶段通过诱导细胞凋亡而发挥作用,如在肝癌、乳腺癌等多种肿瘤细胞系中均发现了NF-κB处于活化状态。在NPRA基因敲除小鼠中,可以观察到NF-κB活性降低,促炎因子减少,提示NPRA的表达与炎症反应密切相关,其可能是通过抑制肿瘤相关炎症反应而间接对肿瘤生长产生抑制作用。研究提示,在敲除NPRA基因的小鼠心肌纤维中,基质金属蛋白酶(matrix metalloproteinase,MMP)2与MMP9的表达量明显增加了3~5倍,同时NF-κb的信号也增强了4倍。本研究结果显示,NPRA基因敲除后可以明显降低食管癌细胞的迁移和侵袭能力,之后将对其下游分子进一步研究,分析NPRA是否与肿瘤侵袭与转移相关因子MMP2和MMP9相关。
基因治疗是目前肿瘤治疗的一个热点,寻找有助于肿瘤早期诊断、靶向治疗、预后判断的分子标志物显得尤为重要。本研究通过细胞及组织学层面推测NPRA在食管鳞状细胞癌中发挥着癌基因的作用,且其高表达与肿瘤的TNM分期、分化程度以及预后密切相关,并可促进食管癌细胞的侵袭与迁移,至于哪些基因在食管鳞状细胞癌中被NPRA调控,还有待后续对其上下游调控因子进一步研究。
