维A酸对糖尿病肾病大鼠肾脏保护作用及分子机制分析
2021-03-22刘建林胡春艳王慧超吕心瑞
刘建林 李 惠 胡春艳 王慧超 吕心瑞
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)所致的慢性肾脏疾病,属DM慢性微血管并发症。尤其是近年来,随着DM患病基数的不断增长,DN患病人数也逐年上升,已成为终末期肾脏疾病(end stage of renal disease,ESRD)的主要病因之一,DN早期防治也已成为亟待解决的重要公共卫生课题。临床试验及动物实验均证实肾小球纤维样病变是DN肾脏病变进一步恶化的典型病理表现。抑制转化生长因子β1(transforming growth factors-β,TGF-β1)过量表达是防治肾小球纤维化的关键。维A酸(retinoic acid,RA)是维生素A的中间代谢产物,研究已证实,组织RA在调节上皮细胞分化、胚胎生长、肿瘤发生中扮演重要角色,并能调节细胞凋亡、增殖及分化,但既往针对RA的临床研究也多侧重于肿瘤疾病、皮肤病等,在DN中的临床报道相对鲜见。基于此,本研究拟通过动物实验分析RA对DN大鼠肾脏保护作用,并通过对TGF-β1通路及相关下游调控蛋白表达水平的测定探究其分子机制,旨在为DN的临床防治提供方向,具体报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级健康雄性大鼠及大鼠饲料均购自上海斯莱克动物实验公司,质量200~250 g;动物饲养温度23℃、湿度44%,自由摄食饮水,适应性喂养1周后开始实验;高脂饲料为基础饲料84.5%、蛋黄粉7%、猪油8%、胆酸钠0.5%,由本实验室自行配置。
1.1.2 试剂 放射免疫沉淀法裂解缓冲液(radio immunoprecipitation assay lysis buffer,RIPA裂解液)由实验室自行配置[10%磷酸酶抑制剂∶1%苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)];山羊抗兔IgG/HRP聚合物、DAB显色试剂盒、磷酸盐缓冲液(phosphate buffer saline,PBS)、基质金属蛋白酶-9(matrix metallo proteinase 9,MMP-9)试剂盒均购自北京中杉金桥有限公司;RA、链脲佐菌素(streptozotocin,STZ)、格列本脲购自美国Sigma化学公司;伊红及苏木素均购自BASO生物科技有限公司;尿素氮(blood urea nitrogen, BUN)、血肌酐(serum creatinine, Scr)试剂盒均购自南京建成生物工程研究所;Nephrin、Podocin、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)、磷酸化p38MAPK(phosphorylated p38,p-p38MAPK)、TGF-β1、Caspase -3、Smad家族蛋白2/3(Smad2/3)、磷酸化Smad 2/3(p-Smad2/3)抗体购自英国Abcom公司。
1.1.3 仪器与设备 载玻片、盖玻片均购自江苏世泰实验器材有限公司;石蜡切片机为Lecia RM 2135;脱水机为Leica TP1020;烤片机为安徽电子科学研究所QP-B;光学显微镜为日本OLYMPUS;蛋白电泳仪、电压稳压仪、蛋白转印槽均购自美国Bio-Rad公司;7600 型全自动生化分析仪购自日本日立公司;染色玻璃缸购自上海鼎杰生物科技有限公司;血糖仪/试纸购自美国强生;酶标仪购自美国Bio Tek公司。
1.2 方法
1.2.1 动物分组 60只SPF级大鼠随机分为正常对照组、模型组、格列本脲组、RA高剂量组、RA中剂量组、RA低剂量组,每组10只;其中正常对照组、模型组给予5 mg/kg生理盐水;格列本脲组按5 mg/kg给予格列本脲,RA高剂量组、RA中剂量组、RA低剂量组分别按15 mg/kg、10 mg/kg、5 mg/kg给予RA;给药方式为连续灌胃;按1次/天频率持续给药6周;6组大鼠均规律喂养普通饲料,自由饮水。每组大鼠数量不足10只则按随机抽样原则补齐动物并造模。
1.2.2 DN大鼠模型建立 SPD级大鼠适应性喂养一周后随机分出10只作为正常组,余下大鼠参照文献制作DN模型。造模大鼠禁食12 h,采用左肾切除术联合高脂饲料喂养:0.1 mmol/L无菌枸橼酸钠缓冲液将STZ配置成2%溶液。4周后按60 mg/kg剂量经腹腔注射STZ,对照组则注射等剂量无菌枸橼酸钠缓冲液,给药后72小时采集大鼠尾静脉血,血糖仪测定血糖,连续3次随机血糖(random blood glucose,RBG)≥16.7 mmol/L则提示DM大鼠造模成功(2只血糖未达标,弃用);6周后24 h尿蛋白(urine protein,UP)>30 mg则提示DN大鼠造模成功(3只 24 h UP未表达,弃用)。
1.3 观察指标
1.3.1 大鼠体质量及肾脏指数 实验期间,按2周/次频率给大鼠称重,并测定空腹血糖(fasting blood glucose,FBG);待尿液采集、腹主动脉采血及称重结束后处死大鼠,迅速取出肾脏,生理盐水洗涤后吸干水分,去除包膜后称肾质量,并计算肾脏指数(肾脏质量/体质量×1 000‰),并将左肾浸泡于4%中性甲醛用于病理组织检查;右肾则置于-80℃液氮后用于蛋白表达测定;记录各组干预前、干预后第6周的体质量及干预后第6周的肾脏指数。
1.3.2 大鼠24 h尿蛋白含量、尿排泄量比较 于6周时在末次给药结束前1 d用金属代谢笼采集大鼠24 h尿液,记录各组大鼠24 h总尿量、24 h尿蛋白含量、尿排泄量。
1.3.3 大鼠BUN、Scr、FBG 各组大鼠称重后腹腔注射乌拉坦麻醉,腹主动脉采血并离心取血清,置于-20℃保存,全自动生化分析仪检测血BUN、Scr、空腹血糖(fasting blood glucose,FBG)水平。
1.3.4 大鼠肾脏病理变化 取左肾,切成小块后4%中性甲醛固定,蒸馏水洗涤组织后70%乙醇过夜,脱水、透明、石蜡包埋,切片、封片后HE染色,200倍镜下观察各组大鼠肾组织病理形态学变化,肾小球系膜有无增生、肾小管有无萎缩、肾间质有无炎症细胞浸润等。
1.3.5 大鼠肾组织TGF-β1 通路及相关下游调控蛋白表达水平 采用免疫印迹法(Western blotting法)测定Nephrin、Podocin、p38MAPK、p -p38MAPK、TGF -β1、Caspase -3、Smad2/3及p-Smad2/3 蛋白表达情况。取各组大鼠右肾组织,RIPA裂解液均浆后冰上孵育,4℃、12 000 r/min条件下离心20 min,BCA法对上清液进行蛋白定量,加上样缓冲液制备样本,取40 μg蛋白,12%SDS-PAGE凝胶电泳,而后转至PVDF膜上,含5%BSA的TBST室温封闭3~5 h,分别加入兔抗鼠抗体Nephrin、Podocin、p38MAPK、p -p38MAPK、TGF -β1、Caspase -3、Smad2/3及p-Smad2/3,比例分别为1∶1 000、1∶500、1∶1 000、1∶1 000、1∶200、1∶500、1∶1 000、1∶1 000,以β-actin(1∶2 000)为参照,4℃过夜;次日用含5%BSA的TBST洗膜5次,每次5 min,辣根过氧化物酶标记的II抗(1∶10 000)室温孵育60 min后 TBST洗膜5次,每次5 min,ECL化学发光显影;Image J软件进行图像分析,以光密度比值代表Nephrin、Podocin、p38MAPK、p-p38MAPK、TGF-β1、Caspase -3、Smad2/3、p-Smad2/3表达。
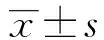
2 结果
2.1 各组大鼠体质量及肾脏指数比较 模型组大鼠体质量下降(P
<0.05),其余各组大鼠体质量较入组时均上升(P
<0.05);与正常对照组比较,模型组大鼠体质量下降,而肾脏指数上升(P
<0.05);而与模型组比较,RA高剂量组、RA中剂量组、RA低剂量组、格列本脲组大鼠体质量均上升(P
<0.05),肾脏指数下降(P
<0.05);RA高剂量组体质量高于RA中剂量组、RA低剂量组(P
<0.05),肾脏指数低于RA中剂量组、RA低剂量组(P
<0.05)。各组体质量变化差值也有统计学意义(P
<0.05),与正常对照组比较,模型组体质量变化差值更低(P
<0.05);与模型组比较,格列本脲组、RA低剂量组、RA中剂量组、RA高剂量组体质量变化差值上升(P
<0.05)。见表1。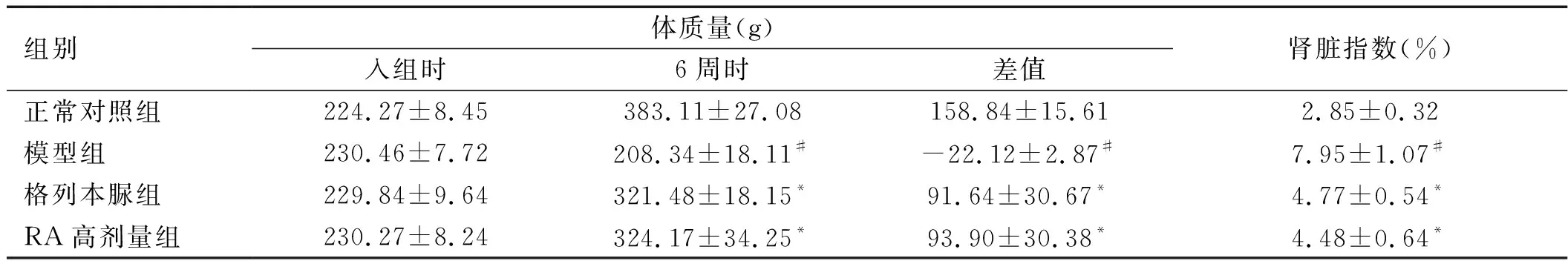
表1 各组大鼠体质量及肾脏指数比较(n=10)

续表1
2.2 各组大鼠24 h尿蛋白含量、尿排泄量比较 与正常对照组比较,模型组大鼠24 h蛋白尿含量、尿排泄量均上升(P
<0.05);与模型组比较,RA高剂量组、RA中剂量组、RA低剂量组、格列本脲组24 h蛋白尿含量、尿排泄量均下降(P
<0.05)。见表2。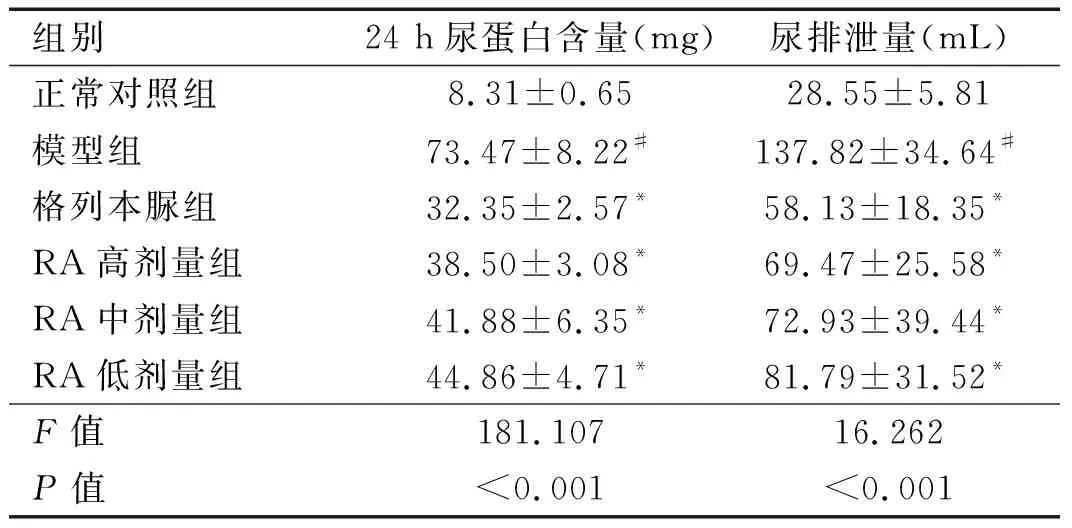
表2 各组大鼠24 h尿蛋白含量、尿排泄量比较(n=10)
2.3 各组大鼠BUN、Scr、FBG水平比较 与正常对照组比较,模型组大鼠BUN、Scr、FBG均上升(P
<0.05);而与模型组比较,RA高剂量组、RA中剂量组、RA低剂量组、格列本脲组BUN、Scr、FBG均下降(P
<0.05)。见表3。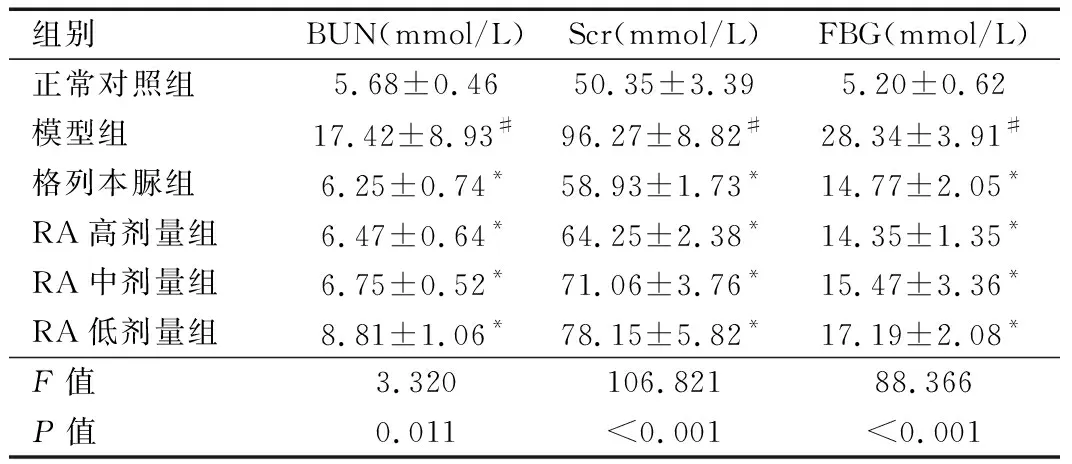
表3 各组大鼠BUN、Scr、FBG水平比较(n=10)
2.4 各组大鼠肾脏病理变化情况 HE染色可见正常对照组大鼠肾小球系膜未见增生现象,肾小管亦未见萎缩,肾间质无炎性细胞浸润(见图1A);模型组大鼠则明显可见肾小球系膜基质增多,部分肾小管有萎缩且存在管腔扩张,近端小管上皮细胞有糖原空泡,且肾间质可见灶状慢性炎性细胞浸润(见图1B);但格列本脲组和RA高、中、低剂量组大鼠肾小球基质均未见明显增生,萎缩肾小管明显减少(见图1C-F)。
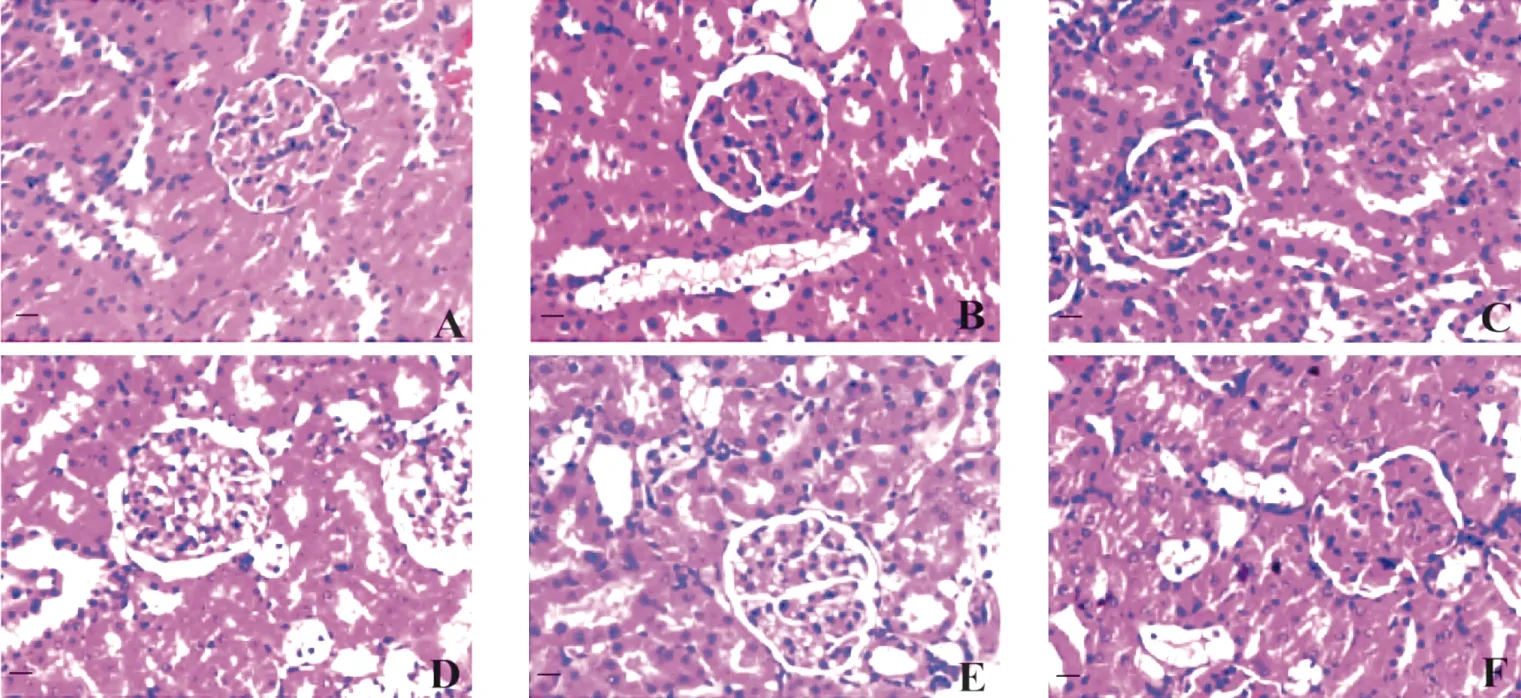
图1 各组大鼠肾脏病理变化情况
2.5 各组大鼠肾组织TGF-β1 通路及相关下游调控蛋白表达水平比较 各组大鼠p38MAPK、Smad2/3表达水平比较,差异无统计学意义(P
>0.05);与正常组比较,模型组大鼠Nephrin、Podocin下降,p-p38MAPK、TGF-β1、Caspase-3、p-Smad2/3均上升;与模型组比较,RA高剂量组、RA中剂量组、RA低剂量组的Nephrin、Podocin上升,p-p38MAPK、TGF-β1、Caspase-3、p-Smad2/3则下降,差异均有统计学意义(P
<0.05);其中RA高剂量组Nephrin、Podocin高于RA中剂量组、RA低剂量组(P
<0.05),p-p38MAPK、TGF-β1、Caspase-3、p-Smad2/3则低于RA中剂量组、RA低剂量组,差异有统计学意义(P
<0.05)。见表5、图2。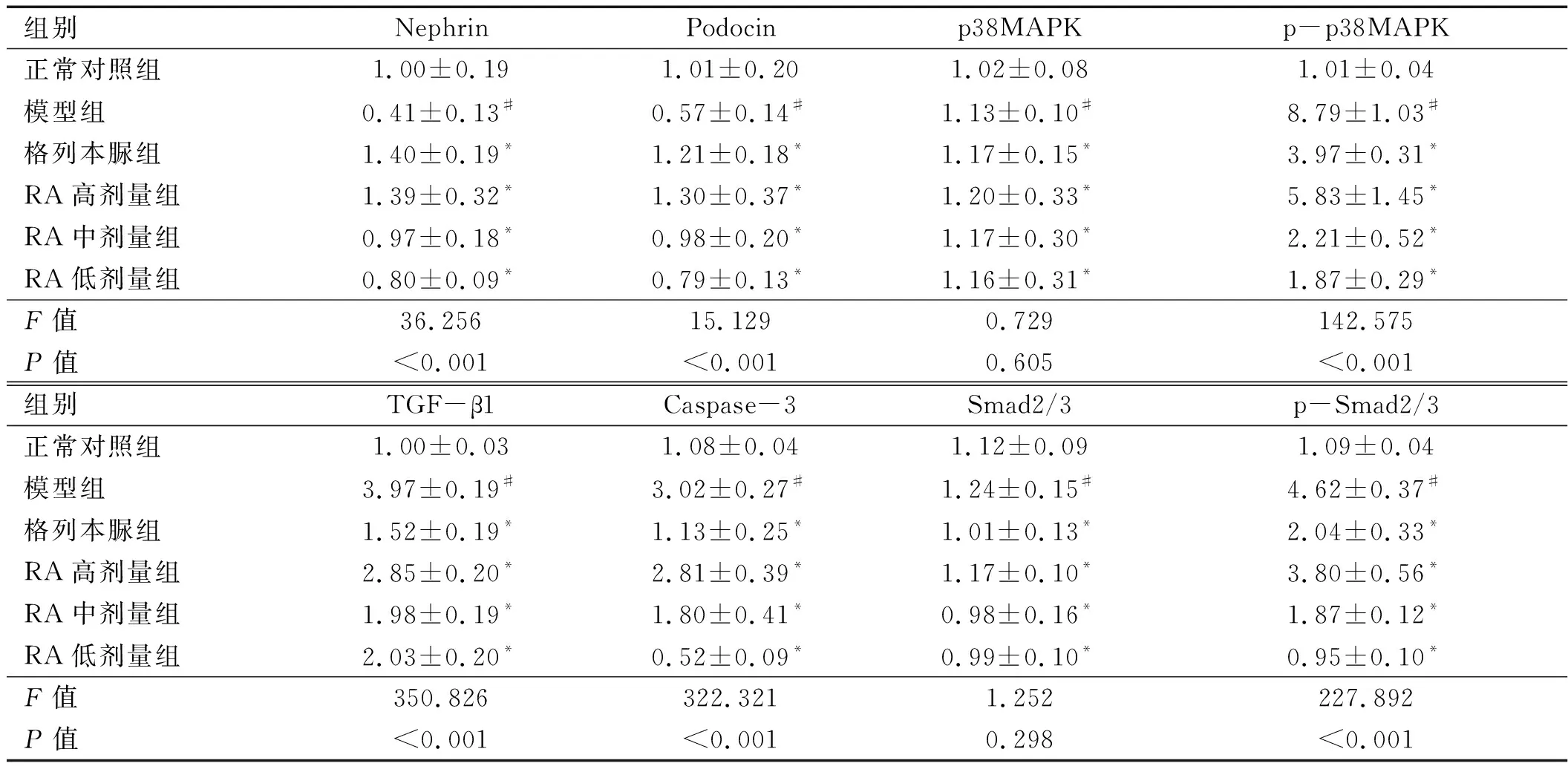
表5 各组大鼠肾组织TGF-β1 通路及相关下游调控蛋白表达水平比较(n=10)
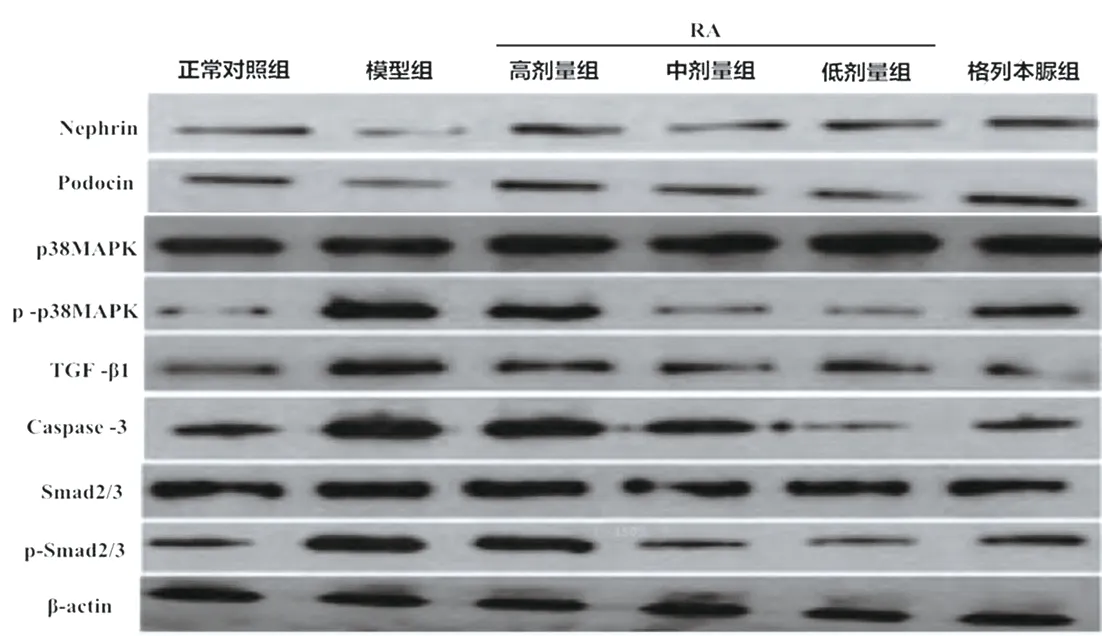
图2 各组大鼠肾组织TGF-β1 通路及相关下游调控蛋白表达水平(Western blotting实验)
3 讨论
DN的发病机制繁杂,当前研究指出,DN是长期高血糖与多种致病因素共同参与所致,以持续增加的尿蛋白排泄为典型临床表现,并伴肾功能进行性下降,这在本次动物实验中也有体现。本研究中,与正常对照组比较,模型组大鼠体质量显著下降,而肾脏指数、24 h蛋白尿含量、尿排泄量、BUN、Scr、FBG则显著上升;提示STZ可诱导肾脏肿胀、尿蛋白排泄增加及肾功能损伤,这与钟艳花等的报道结论相似。但与模型组比较,本研究中RA高剂量组、RA中剂量组、RA低剂量组、格列本脲组大鼠体质量均显著上升(P
<0.05),肾脏指数、24 h蛋白尿含量、尿排泄量、BUN、Scr、FBG显著下降(P
<0.05)。提示RA可改善STZ诱导的肾脏肿胀,并降低DN大鼠尿排泄量及尿蛋白,下调FBG,改善STZ诱导的肾功能损伤。同时,DN的典型病理表现为肾小球基底膜增厚、系膜区大量基质增生。本研究中,HE染色同样可见正常对照组大鼠肾小球系膜未见增生现象,肾小管亦未见萎缩,肾间质无炎症细胞浸润;而模型组大鼠则明显可见肾小球系膜基质增多,部分肾小管有萎缩且存在管腔扩张,近端小管上皮细胞有糖原空泡,且肾间质可见灶状慢性炎性细胞浸润;这与既往报道结论相符。但格列本脲组及RA高、中、低剂量组大鼠肾小球基质均未见明显增生,萎缩肾小管明显减少,这也在进一步印证RA可对DN大鼠发挥一定肾保护作用,并呈一定剂量依赖性。Nephrin、Podocin均是敏感的足细胞特异性标志蛋白,其表达是维持足细胞结构、功能的关键蛋白。Wu等实验也证实,DN存在Nephrin、Podocin异常表达,并促进蛋白尿发生、发展及肾小球硬化。同时,临床研究还指出,TGF-β通过TGF-β1型受体进行信号转导后,激活Smad2、Smad3并磷酸化,与Smad4形成异源三聚体复合物易位入核,将信号从细胞表面传导至细胞核,调节靶基因功能;在激活Smad通路的同时,也激活p38MAPK通路,进一步活化Caspase -3引起足细胞凋亡。且TGF -β1、Caspase -3所介导肾脏氧化应激反应也可进一步促进足细胞凋亡[18]。因此,抑制TGF -β1/Smads/p38MAPK信号转导通路于DN防治至关重要。为探究RA的肾保护机制,本研究比较各组肾组织TGF-β1 通路及相关下游调控蛋白表达水平。结果显示,各组大鼠p38MAPK、Smad2/3表达差异无统计学意义;与正常组比较,模型组大鼠Nephrin、Podocin显著下降,p -p38MAPK、TGF -β1、 Caspase -3、 Smad2/3均显著上升;但与模型组比较,RA高剂量组、RA中剂量组、RA低剂量组的Nephrin、Podocin显著上升,p -p38MAPK、TGF -β1、 Caspase -3、 Smad2/3则显著下降。提示RA可有效提升DN大鼠肾组织足细胞蛋白Nephrin、Podocin表达,降低TGF -β1、Caspase -3蛋白表达,并抑制p38MAPK磷酸化及Smad2/3活性,从而抑制足细胞凋亡、改善肾小球硬化,最终改善DN大鼠肾功能及肾组织病理变化,发挥肾保护作用。
综上所述,RA可通过抑制TGF -β1/Smads/p38MAPK信号转导通路改善DN大鼠肾脏肿胀,降低其排尿量及尿蛋白,改善肾功能,发挥肾保护作用,并呈一定剂量依赖性。但本研究也存在一定局限性,着重探究了RA对DN大鼠肾功能的影响及机制,其对DN大鼠血糖的改善机制尚不明确,拟作为下阶段研究目标,持续补充及完善。
