β-咔啉类杂环胺模型体系反应产物相关性质的研究
2021-03-20赵天培马宇翔张晨霞汪学德
赵天培,马宇翔,张晨霞,席 俊,汪学德
河南工业大学 粮油食品学院,河南 郑州 450001
图1 Norharman和Harman的分子结构式
热处理(如蒸煮、烧烤、油炸、烘焙等)是食品加工中最为普遍的方式,这些加工方式伴随着美拉德反应,让人们享受到食品色、香、味的同时又会生成一系列危害物,如丙烯酰胺、羟甲基糠醛、晚期糖基化终末产物等[1-3]。近年来,高温加工肉制品中产生的有害物质杂环胺(heterocyclic aromatic amines, HCAs)成为国内外相关科研工作者关注的热点。杂环胺是蛋白质含量高的食品经高温处理后产生的一类致癌、致突变的化合物,迄今有超过25种杂环胺被分离鉴定出来[4],其中β-咔啉类杂环胺Norharman(9H-吡啶并[3,4-b]吲哚,分子量168.2,非极性)和Harman(1-甲基-9H-吡啶并[3,4-b]吲哚,分子量182.3,非极性)在食品加工中非常容易产生,分子结构式见图1。这两种物质自身不具有致突变性,但当与苯胺、甲苯或者其他杂环胺共存时会产生强烈的致癌性,属于辅助致突物和潜在诱变剂[5-6],动物试验也表明,Norharman和Harman会影响动物的生理行为,主要是因为它们会与小鼠肝脏和大脑的某些位点结合[7]。
通过研究,人们对高蛋白食品在热加工处理过程中产生杂环胺的机理有了初步的认识,美拉德反应在杂环胺的形成方面发挥重要作用。美拉德反应是由还原糖和含游离氨基的化合物在加热时所发生的一系列复杂的化学反应,是热加工食品中风味和色泽产生的重要途径之一[8]。研究发现,不同的氨基酸和糖在美拉德反应进程中生成不同的中间产物,进一步与肌酐反应最终形成不同种类的杂环胺。色氨酸是β-咔啉类杂环胺形成的前体物质,同时,葡萄糖在复杂的反应过程中促进了β-咔啉的形成[9-11]。
采用葡萄糖与色氨酸以及肌酐在高温条件下反应构建肉制品美拉德反应模型体系,研究不同反应温度和时间体系中β-咔啉类杂环胺生成规律及体系产物的相关性质,包括pH值、中间产物和最终产物类黑精生成量、体系DPPH自由基清除能力和铁离子还原力以及各体系挥发性物质种类和含量的变化规律,并进一步分析杂环胺生成量与各理化指标之间的相关性,能够加深对美拉德反应产物的认识,有助于深入了解美拉德反应与其伴生危害物杂环胺之间的关系,对生产实践具有重要的指导意义。
1 材料与方法
1.1 材料
Harman和Norharman标准品(纯度>98%):上海源叶生物科技有限公司;葡萄糖、色氨酸、肌酐(纯度均大于98%)、2,4,6-三吡啶基三嗪(2,4,6-Tris(2-pyridyl)-s-triazine,TPTZ)、二甘醇:上海麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryhydrazyl,DPPH)、乙腈、甲醇(色谱纯):美国Sigma公司;氨水、浓盐酸(分析纯):天津科密欧试剂有限公司;试验用水均为超纯水。
1.2 仪器与设备
Waters Acquity UPLC CLASS超高效液相色谱仪、Waters Xevo TQD三重四极杆质谱仪(配电喷雾离子源):美国Waters公司;XPE26DR电子天平(感量0.01 mg):瑞士Mettler Toledo公司;Eppendorf Multipette E3x电动移液器:德国Eppendorf公司;P160002厚壁耐压瓶:北京欣维尔玻璃仪器有限公司;MTN-2800 W氮吹浓缩仪:天津奥特赛恩斯仪器有限公司;Visiprep DL真空固相萃取装置:美国Supelco公司;UV-6000PC紫外可见分光光度计:上海元析仪器有限公司;PHS-25型数显pH计:上海雷磁仪器厂;DK-S24型电热恒温油浴锅:上海精宏实验设备有限公司;7890B型气相色谱仪:美国Agilent公司;ISQ型气相色谱质谱联用仪:Thermo Fisher Scientific公司;摩尔细胞型超纯水器:重庆Molecular水处理设备有限公司。
1.3 方法
1.3.1 模型体系的建立
称取0.4 mmoL色氨酸、0.4 mmoL肌酐、0.2 mmoL葡萄糖于耐压瓶中,用移液管准确移取10 mL水分含量为14%的二甘醇水溶液,涡旋振荡混匀,置于油浴锅中在160、180、200 ℃条件下分别反应10、30、60、90、120 min,获得反应程度不同的反应液,储存于-4 ℃冰箱备用。
1.3.2 UPLC-MS测定杂环胺含量
样品前处理:根据前期预试验吸取200 μL反应液稀释适当倍数,取一定量稀释后的模型体系反应液上样于PCX固相萃取柱(3 mL甲醇,3 mL超纯水预先活化),再用3 mL 0.1 mol/L的盐酸和3 mL甲醇淋洗,最后使用3 mL甲醇-氨水溶液(体积比为95∶5)洗脱,收集全部洗脱液于45 ℃下氮吹至近干,用1 mL甲醇复溶,过0.22 μm有机滤膜后进行UPLC-MS测定。
色谱分析条件:色谱柱为Waters Acquity UPLC BEH C18柱(50 mm×2.1 mm×1.7 μm),柱温35 ℃;色谱流动相为10 mmol/L甲酸铵溶液(pH 6.80)(A)、乙腈(B),流速0.3 mL/min。梯度洗脱程序:0 min,10% B;0.2 min,10% B;1.0 min,30% B;3.0 min,60% B;3.5 min,90% B,平衡至初始状态;进样量1 μL。
质谱分析条件:质谱电离源采用电喷雾电离源(ESI),ESI+,多反应监测模式(MRM模式);源温120 ℃;毛细管电压0.5 kV;脱溶剂气体流速1 000 L/h;脱溶剂温度650 ℃;锥孔气体流速50 L/h;碰撞气体流速0.3 mL/min。杂环胺质谱参数见表1。
以杂环胺质量浓度为横坐标、峰面积为纵坐标,建立杂环胺的标准曲线,回归方程:YNorharman=1 140.3X+1 688.5,R2=0.999 4;YHarman=952.05X+865,R2=0.999 5。峰面积与杂环胺质量浓度在0.609~276.0 ng/mL之间有良好的线性关系。Norharman和Harman的检出限和定量限分别为0.14、0.05 μg/kg和0.24、0.16 μg/kg,回收率为84.51%~113.8%,精密度小于6%。

表1 β-咔啉类杂环胺的MRM质谱参数
1.3.3 pH值的测定
采用PHS-25型pH计检测模型体系反应液的pH值。
1.3.4 中间产物和褐变程度的测定
取一定反应液稀释适当倍数,用紫外可见分光光度计在420 nm和294 nm波长处测定吸光度,分别用来表征模型体系反应液的最终褐色产物类黑精和中间产物的量[12-13]。
1.3.5 模型体系反应产物抗氧化性的测定
DPPH自由基清除能力测定:将样品采用甲醇稀释相同倍数后参考文献[14]的方法进行测定;FRAP还原力的测定:样品稀释后参考文献[15]的方法进行测定。
1.3.6 模型体系反应产物挥发性物质的测定
称取模型体系反应液4 g左右于20 mL顶空进样瓶中,加入4-壬醇作内标密封待测。水浴50 ℃吸附平衡20 min,采用SPME进样器进行顶空吸附萃取30 min,GC-MS手动进样,样品解析时间3 min。
气相色谱条件:色谱柱为HP-5MS(30 m×0.25 mm×0.25 μm),载气为氦气,流速1 mL/min;升温程序:起始温度40 ℃,在40 ℃条件下保持3.5 min,以4 ℃/min升温到230 ℃,维持8 min;进样方式:不分流。质谱条件:电离方式EI;电子能量70 eV;离子源温度230 ℃;接口温度250 ℃;扫描质量范围(m/z)33~65。数据处理:未知物经计算机检索并与NIST 11.L谱库对比分析,仅选用匹配度大于80的鉴定结果,通过对比待测挥发物与内标峰面积之比进行定量。
1.4 数据分析
每个试验重复3次,结果以平均值±标准差表示。采用EXCEL 2010、SPSS 23.0及Masslynx 4.1软件进行数据处理与统计分析,用Origin 2017软件作图。数据间多重对比采用Duncan检验分析显著性,P<0.05表示存在显著性差异。
2 结果与分析
2.1 模型体系中杂环胺含量的变化
图2为杂环胺标准溶液UPLC-MS色谱图。模型体系中β-咔啉类杂环胺总生成量的变化如图3所示。由图3可知,随反应时间延长和温度升高,杂环胺生成量基本呈现上升趋势。160 ℃条件下,β-咔啉杂环胺的总生成量由3.84 μg/mL(反应10 min)升高至31.03 μg/mL(反应120 min);180 ℃条件下,β-咔啉杂环胺的总生成量有所提高,由7.99 μg/mL上升至62.23 μg/mL;相比于前两个温度条件,200 ℃时β-咔啉杂环胺的总生成量上升趋势更加显著,由9.07 μg/mL升高至106.05 μg/mL。
图2 杂环胺标准溶液UPLC-MS色谱图
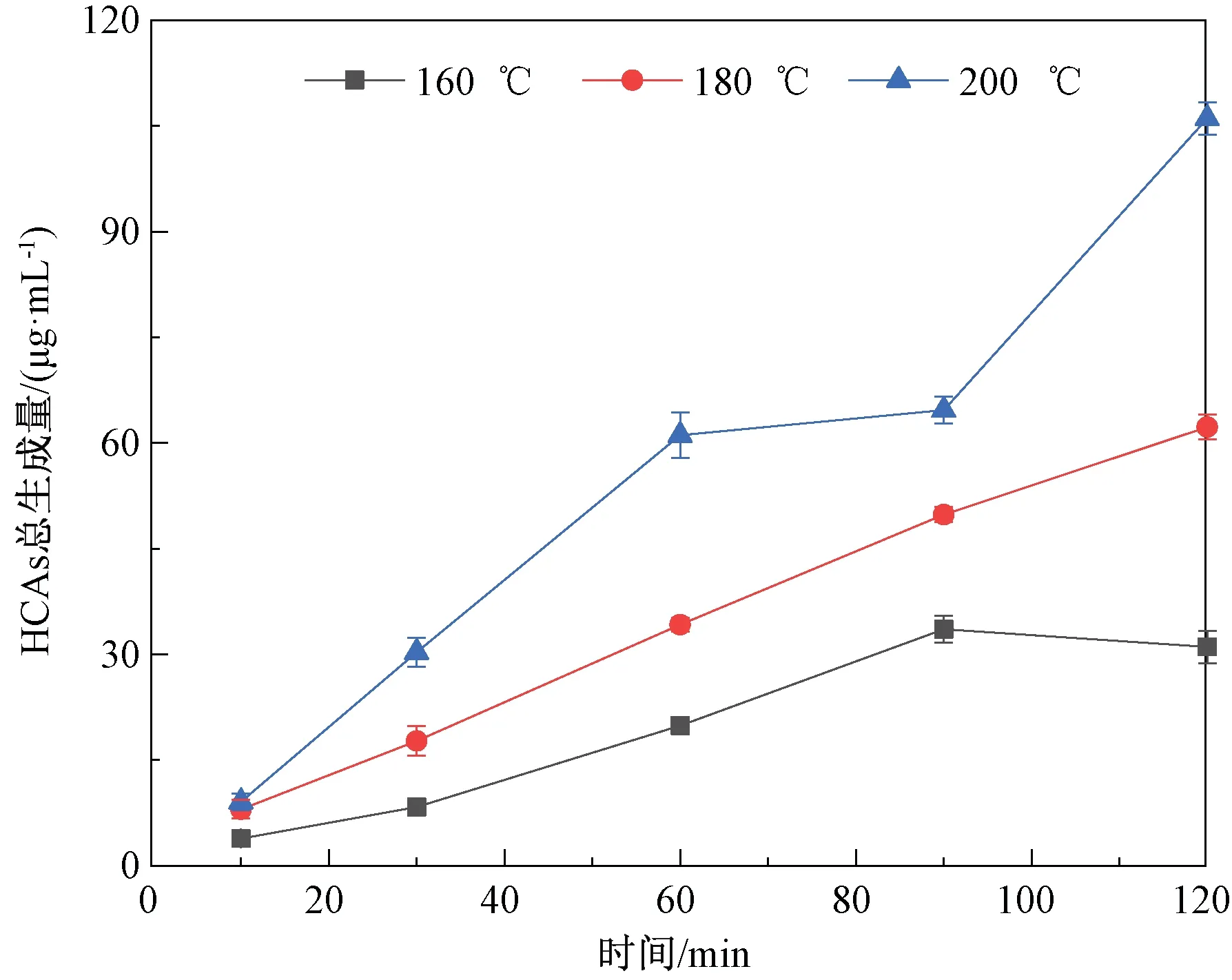
图3 不同温度下模型体系中β-咔啉类杂环胺总生成量随时间的变化
表2是Harman和Norharman在各个体系中的生成量,两种杂环胺随反应时间延长和温度升高,生成量逐渐增加,其中Norharman的生成量显著高于Harman的生成量。在160 ℃条件下,随反应时间延长,Harman的生成量由0.92 μg/mL上升至5.14 μg/mL,Norharman的生成量由2.92 μg/mL上升至25.89 μg/mL;180 ℃条件下,Harman和Norharman的生成量分别由1.71、6.28 μg/mL上升至10.94、51.29 μg/mL;200 ℃条件下,Harman和Norharman的生成量分别由2.27、6.80 μg/mL上升至20.06、85.99 μg/mL,可以看出Norharman比Harman更容易生成且含量远远高于Harman。本研究与Herraiz等[16]研究结果一致,温度和时间显著促进β-咔啉类杂环胺的形成。β-咔啉类杂环胺生成量普遍较高,可能是由于前体物含量和反应温度较高所致,近年来研究发现,低于100 ℃的温度也能生成β-咔啉类杂环胺[10,17]。
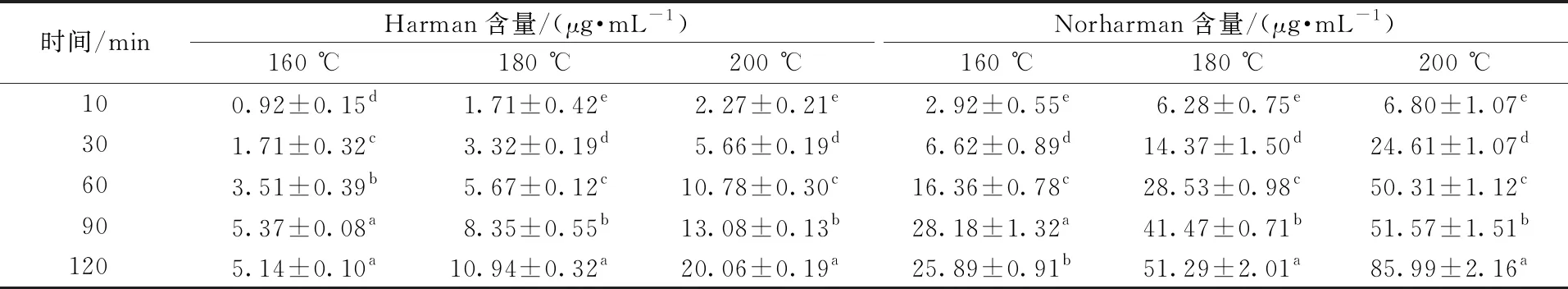
表2 不同温度下模型体系中Norharman 和 Harman含量随时间的变化
2.2 模型体系中pH值的变化
温度和时间对反应体系pH值的影响如图4所示。随着反应时间延长和反应温度升高,反应体系产物pH值逐渐升高,由低温短时间加热呈现弱碱性到高温长时间加热后反应液变为碱性,这与模型体系中大量生成β-咔啉类杂环胺有密切关系,杂环胺类物质属于碱性化合物,体系生成量越高,碱性越强。
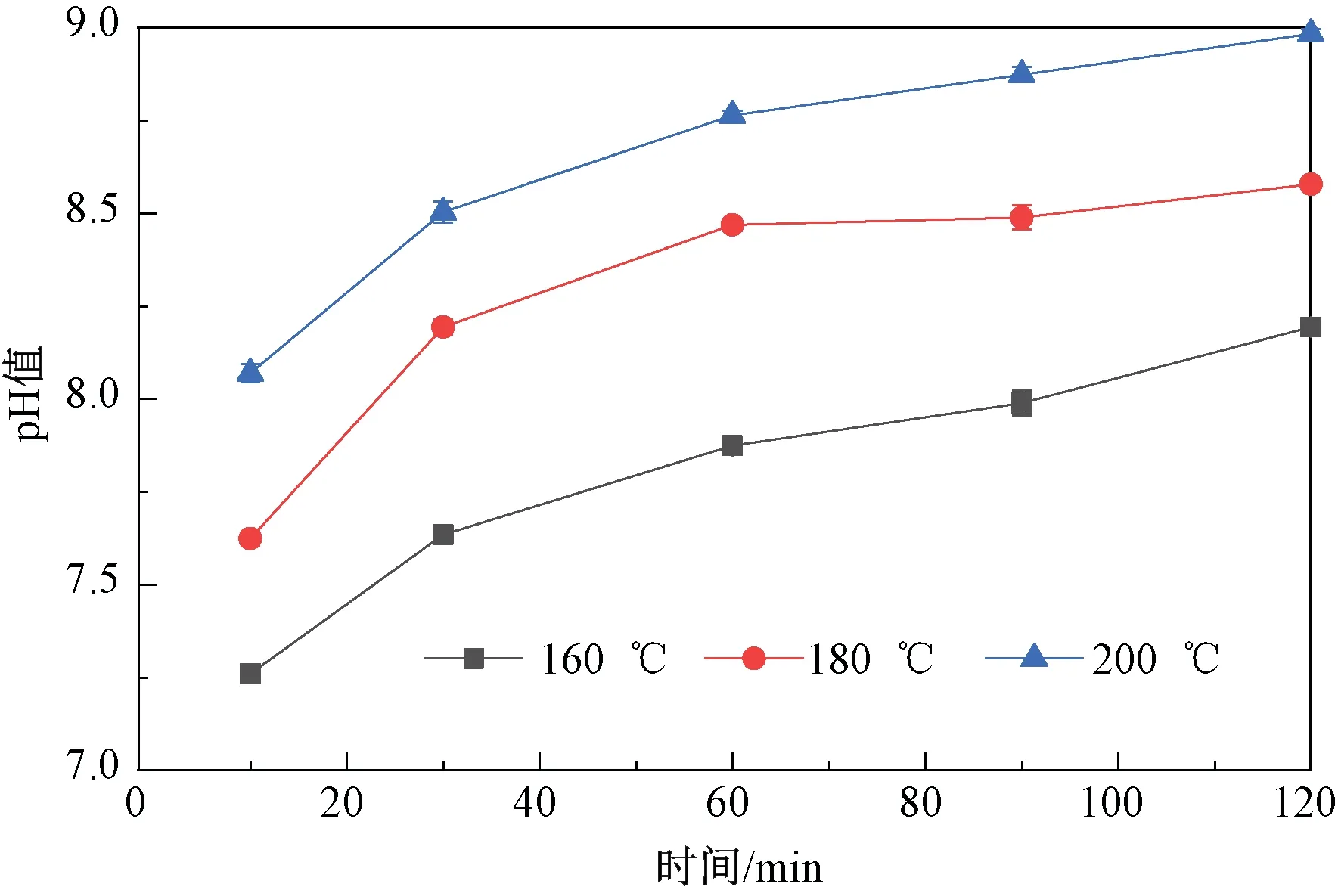
图4 不同温度下模型体系中反应液pH值随时间的变化
2.3 模型体系中中间产物和褐变程度的变化
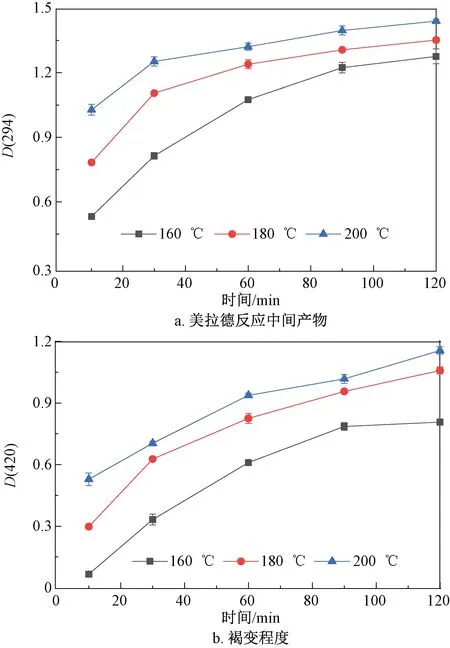
图5 不同温度下模型体系中生成的美拉德反应中间产物和褐变程度随时间的变化
反应产物在294 nm波长处的吸光度可以表示美拉德反应过程中形成的无色、无荧光中间产物(如糖、醛和二羰基化合物等)的积累量,这些产物是美拉德反应过程中生成最终产物的前体物。由图5a可知,随着反应进行,β-咔啉类杂环胺模型体系在294 nm波长处的吸光度呈上升趋势,中间产物生成量增加,在前30 min,中间产物的生成速率较快,后逐渐趋于平缓,其变化规律与pH值的变化规律类似。420 nm处的吸光度用来表征反应体系中美拉德反应产物类黑精的积累量。由图5b可知,随着反应时间延长和温度升高,420 nm波长处的吸光度逐渐增加,表明模型体系褐变程度增强,形成大量褐色物质,色泽加深,同时反应进行得更加彻底,反应终产物类黑精的积累量增多。
2.4 模型体系中产物抗氧化性的变化
表3为模型体系抗氧化活性的结果,不同温度下模型体系反应产物DPPH自由基清除能力和铁离子还原力随时间变化并没有规律。DPPH自由基清除率在160 ℃时,基本随加热时间延长而增加,由51.92%上升至90.94%,但随着加热温度升高,体系DPPH自由基清除率随加热时间延长总体上有所下降。铁离子还原力在160 ℃条件下,随加热时间的延长而增强,但在180 ℃和200 ℃条件下,还原力没有呈现一致的变化规律,180 ℃反应时,随加热时间延长体系还原力先增加后降低,200 ℃反应时,体系还原力呈波动性变化,原因可能是高温长时间加热反应生成具有螯合Fe3+能力的大分子化合物,造成体系还原力降低。
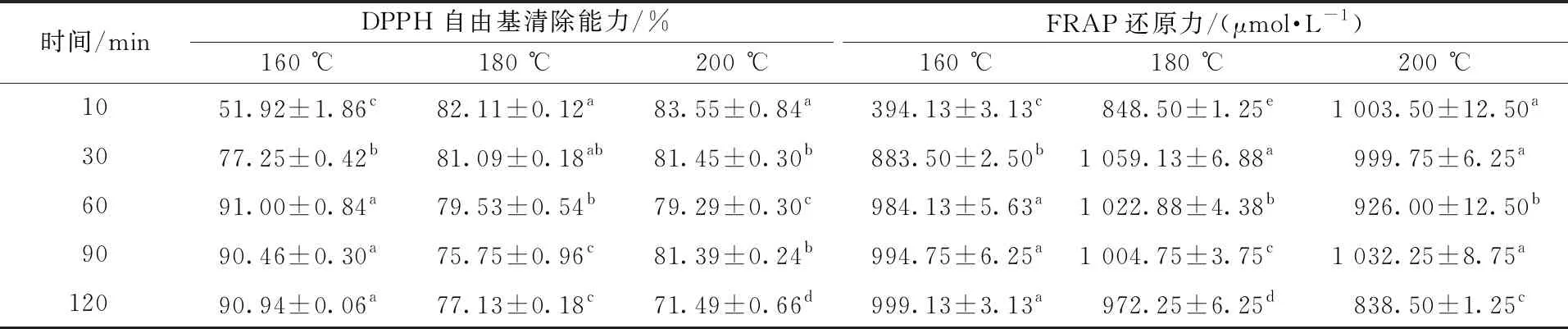
表3 不同温度下各模型体系反应产物DPPH自由基清除能力和FRAP还原力随时间的变化
模型体系DPPH自由基清除率和铁离子还原力变化趋势复杂,这可能与美拉德反应产物的复杂性有关,美拉德反应产物中既含有抗氧化物质又含有促氧化物质[18],致使抗氧化活性时而降低时而升高,同时,随反应时间延长和温度升高,不同活性的物质发挥的作用不一样,造成体系抗氧化性变化没有规律。
2.5 模型体系中各理化指标的相关性分析
对模型体系中反应产物、β-咔啉类杂环胺总生成量、体系pH值、中间产物、褐变程度、DPPH自由基清除能力、铁离子还原力进行相关性分析,结果如表4所示。Harman、Norharman含量及β-咔啉类杂环胺总生成量都与体系pH值、D(294)和D(420)呈极显著正相关,与体系DPPH自由基清除能力和还原力无相关性;体系pH值与D(294)和D(420)呈极显著正相关,与体系还原力呈显著相关,与体系DPPH自由基清除能力无相关性;D(294)与体系还原力呈极显著正相关,D(420)与体系还原力呈显著正相关,二者与体系DPPH自由基清除能力无相关性;体系DPPH自由基清除能力与还原力呈极显著正相关。相关性分析结果表明,β-咔啉类杂环胺模型体系中各理化指标之间相互影响,主要由于高温湿热条件下,碱性环境有助于美拉德反应,反应速率加快造成褐变程度增强,同时反应产生更多中间产物,杂环胺生成量增加,进一步造成体系pH值上升。相关性分析发现,D(420)即表示体系褐变程度与体系抗氧化能力FRAP显著相关,这与先前的报道一致[19],近年来也有研究发现抗氧化能力并不完全依赖褐变程度即类黑精的生成量[20]。章银良等[1]报道在生成丙烯酰胺的美拉德模型体系中,丙烯酰胺生成量和美拉德反应产物的抗氧化性存在正向关系,本研究得出杂环胺的生成量与体系的DPPH自由基清除能力和铁离子还原力没有明确的关系。
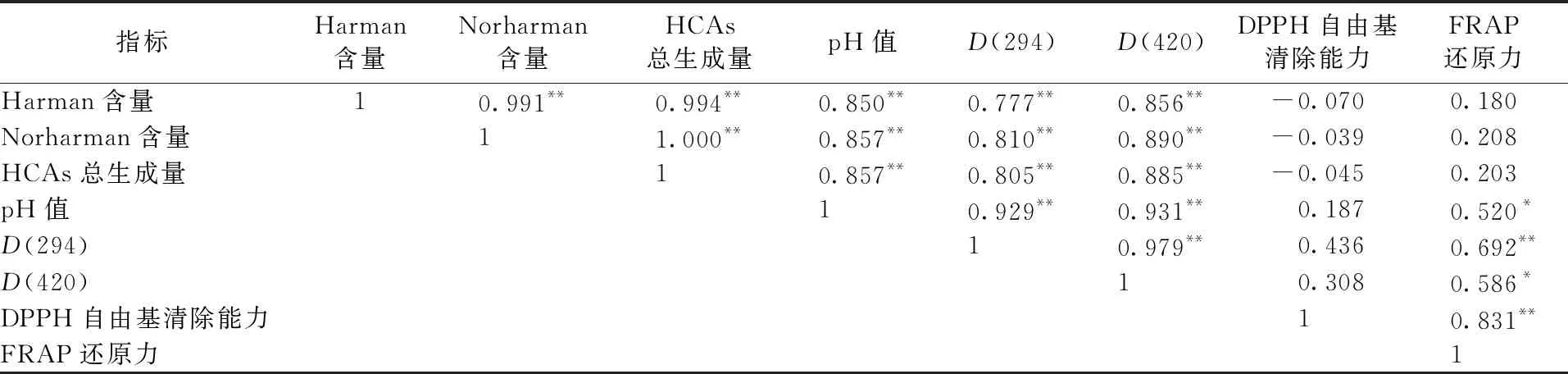
表4 β-咔啉类杂环胺模型体系各理化指标间的相关性分析
2.6 模型体系中挥发性物质含量的变化
采用SPME-GC-MS对9个不同反应时间和温度的β-咔啉类杂环胺模型体系的挥发性物质进行分析,结果如表5所示,共鉴定出17种化合物,吡嗪类物质所占比值最高,原因可能是pH值影响美拉德反应,美拉德反应的中间产物二羰基化合物在碱性环境中与游离氨基发生反应生成α-氨基酮,其经过缩合就会生成不同种类的吡嗪化合物,尤其在pH值大于9时吡嗪类物质大量产生[21-22]。从表5可看出,随着反应时间延长和温度升高,模型体系挥发性物质种类增多,含量也基本呈现上升趋势,其中2-甲基吡嗪含量最高,200 ℃反应120 min时含量已增至16.39 μg/g,其次为2,6-二甲基吡嗪、吡嗪、2-乙基吡嗪、2,5-二甲基吡嗪,含量分别为6.04、5.04、4.96、3.95 μg/g,这些物质也是美拉德反应常见生成产物,通常被认为具有烤香风味[23]。
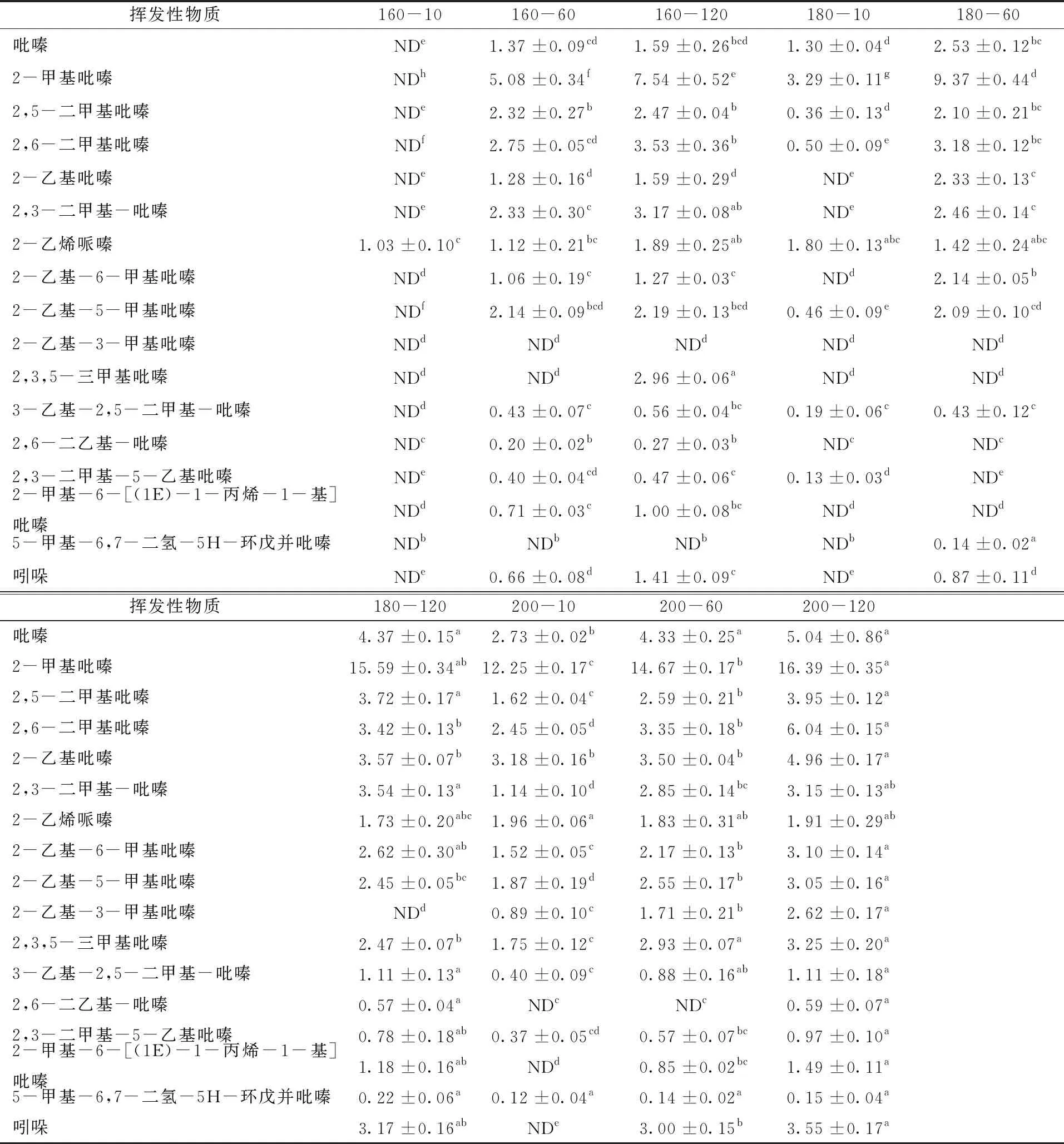
表5 模型体系反应液挥发性成分GC-MS分析结果
此外,色氨酸是吲哚的衍生物,随着体系加热温度升高和加热时间延长,色氨酸大量降解,体系中吲哚物质含量逐渐增加,最终生成量仅次于几种吡嗪类物质,由最初未检测出到最终生成量为3.55 μg/g。吲哚是一种亚胺,具有弱碱性,这也是导致体系pH值升高的原因。另外,吲哚乙胺等可通过环化反应形成四氢化-β-咔啉,而Herraiz[24]认为四氢化-β-咔啉是热加工过程中β-咔啉类杂环胺Norharman和Harman形成的前体物质,当体系中产生大量的吲哚类物质,β-咔啉类杂环胺的含量就会相应升高,进一步解释了吲哚和两种β-咔啉类杂环胺生成量变化规律相似的原因。
3 结论
通过对色氨酸-葡萄糖-肌酐的食品美拉德模型体系研究发现,反应温度和时间对β-咔啉类杂环胺的生成量和反应体系产物理化性质有很大的影响,即随着反应温度的升高和时间的延长,β-咔啉类杂环胺的生成量相应增加、体系pH值升高、中间产物和最终产物类黑精生成量增加、挥发性物质种类及含量增多,以吡嗪类化合物居多,而反应产物的DPPH自由基清除率和铁离子还原力没有规律性变化。相关性研究表明,体系中杂环胺生成量与pH值、中间产物生成量和最终产物类黑精生成量之间呈极显著正相关,与体系抗氧化活性没有相关性。
美拉德反应机理复杂,产物众多,可在食品工业中对其反应产物加以利用,如在抗氧化活性方面的应用,同时也应该重视反应中产生的有害物质如杂环胺。此外,本研究为调节食品美拉德体系色泽、抗氧化活性、风味及有害物质提供理论研究的思路,为热加工肉制品减少杂环胺形成和提高食用品质提供技术基础。
