首诊误诊为鼻窦炎的肉芽肿性血管炎患者1例报告
2021-03-19谭钰思樊建刚
谭钰思,樊建刚,2△
(1.遵义医科大学,贵州 遵义 563000;2.四川省医学科学院·四川省人民医院耳鼻咽喉头颈外科,四川 成都 610072)
患者,男,70 岁,因“反复右侧鼻阻伴流脓涕1月余”于 2020 年6月23日来我院就诊。1月余前,患者无明显诱因出现右侧鼻阻伴流脓涕,伴右侧颜面部肿胀,无鼻出血呼吸不畅等不适。既往史、个人史及家族史无特殊。入院查体:T:36.2 ℃,P:106次/分,R:20次/分,BP:136/77 mmHg,外鼻无畸形,右侧颜面部肿胀,鼻腔黏膜充血水肿,右侧鼻腔可见大量脓性分泌物,右侧鼻腔狭窄,鼻中隔向右侧明显偏曲,左侧钩突肥厚。实验室检查:血常规:白细胞计数 9.91×109/L,中性粒细胞数7.581×109/L,超敏C反应蛋白 58.19 mg/L,PCT:4.24 ng/ml,肌酐:106.2 μmol/L,尿常规:潜血(++),蛋白(+),副鼻窦CT:①鼻中隔居中、双侧下鼻甲肥大;②右侧鼻道、右侧上颌窦、右侧筛窦窦腔内见软组织影填塞,鼻咽右侧壁增厚,右侧上颌窦窦口扩大,部分骨质吸收,右侧上颌窦其余各壁骨质增厚,考虑感染性病变;③双侧蝶窦被膜增厚,见图1。胸部CT:①双肺轻度小叶中心型肺气肿;②右肺下叶片状影、条索影;考虑慢性炎症,右侧肋胸膜后下份增厚;③右肺上叶尖段、左肺下叶背段、左肺上叶前段各见一磨玻璃影;④冠状动脉钙化,见图2a。初步诊断①真菌性鼻窦炎?②慢性鼻窦炎急性发作。入院后给予头孢硫咪2 g q12 h静脉滴注及鼻腔冲洗。患者于入院后第3日出现发热,最高体温达40.5 ℃,更换为盐酸莫西沙星 400 mg qd静脉滴注,体温恢复正常,并于6月30日行全麻鼻内镜下右侧筛窦、上颌窦功能性开放+右侧中鼻甲部分切除+右侧下鼻甲部分切除+右侧鼻腔坏死组织清创+右侧上颌窦内容物清除术。术中见:右侧鼻腔见大量脓性分泌物,右侧中鼻甲黏膜、筛窦黏膜、上颌窦窦口黏膜、上颌窦窦内黏膜及右鼻底黏膜苍白广泛糜烂,上颌窦内可见大量脓性分泌物填充,上颌窦内骨质增生,右侧下鼻甲、鼻底骨质可见侵袭破坏。术后病检提示:“右侧中鼻甲”:送检黏膜间质多量淋巴细胞、浆细胞浸润。“右侧上颌窦内容物”:送检均为坏死组织。“右侧筛窦黏膜”送检黏膜为坏死组织,急慢性炎细胞浸润’“上颌窦黏膜”:送检大部分为坏死组织及少许纤维组织,急慢性炎细胞浸润。术后继续给予抗感染治疗。术后第三日,患者再次出现高热至39 ℃,更换抗生素为头孢唑肟钠 0.5 g q8 h。结合术中所见、病理检查结果及实验室结果,不排除自身免疫系统疾病,进一步完善检查,结果示:抗中性粒细胞胞浆抗体(ANCA)阳性;红细胞沉降率(ESR) 120 mm/h,修正诊断为:肉芽肿性血管炎(granulomatosis with polyangiitis,GPA)。后转入风湿内科治疗,给予甲泼尼龙琥珀酸钠 40 mg qd静脉滴注,并于 7月 21 日始行化疗,化疗方案为:环磷酰胺0.4 g qd静脉滴注,化疗顺利,不良反应轻微,病情明显缓解后出院。患者于9月病情逐渐恶化,原有症状逐渐加重,且出现气紧、心累、胸闷、发热等肺部症状,查体示双肺呼吸音减弱,双肺闻及散在湿啰音。胸部CT示:双肺多叶段散在磨玻璃影、絮状物,部分胸膜粘连,见图2b。血细胞分析:WBC 10.1×109/L;余无特殊。对症治疗后效果不佳,之后病情进一步加重,于 2020 年 9月27日因肺部感染不能控制,呼吸衰竭抢救无效去世。
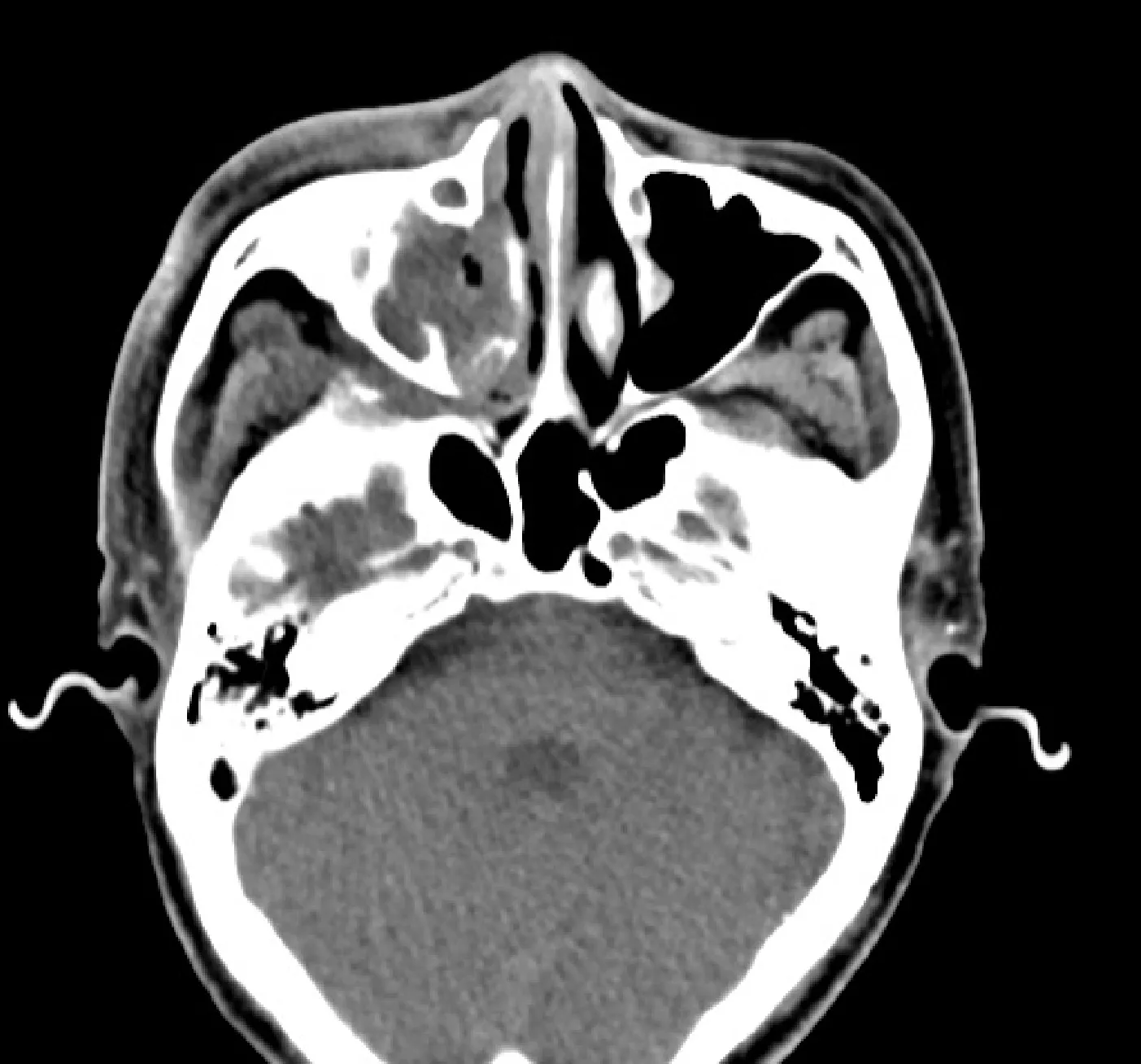
图1 副鼻窦CT

图2 胸部CT a:首次入院时;b:病情恶化
讨论GPA既往被称为韦格纳肉芽肿( Wegener’s granulomatosis,WG)。2011年,基于其临床及病理生理学特征,美国风湿病学会、美国肾脏病学会及欧洲风湿病学会联合提出将WG改称为GPA 。GPA 是一种与ANCA密切相关的影响中、小血管的自身免疫性疾病[1],其病理特点为非干酪性肉芽肿,急/慢性炎症、坏死以及小血管炎。主要以侵犯上呼吸道、肺及肾脏为其经典特征[2],也可累及眼、耳、神经系统、心脏、皮肤等几乎全身任何器官。GPA的具体病因虽尚不明确,但普遍认为是遗传免疫背景下由环境感染等因素引发的[3]。
GPA好发于40~50岁,男性发病率略高于女性。高达85%的GPA患者有鼻部症状,近1/3的患者仅表现为鼻窦炎[4],主要临床表现为鼻塞、鼻腔分泌物、鼻腔结痂、嗅觉下降、溢泪等。当鼻中隔受侵糜烂而导致穿孔时会伴有口哨症状,甚至进一步发展会导致外鼻畸形[5]。暂还没有证据表明GPA患者有特征的鼻窦CT表现,一项回顾性研究表明超过90%的患者鼻部CT有病理改变,主要为粘膜增厚(87.7%)、骨质破坏(59.9%)和新骨形成(56.1%)。约59.4%的GPA患者可以看到鼻中隔穿孔,鼻窦的完全骨性闭塞则很少见,仅18.1%的患者可以观察到,这是GPA后期的经典表现[4]。早期GPA患者的鼻窦CT与普通鼻窦炎很难鉴别,通常均表现为鼻腔黏膜增厚、副鼻窦内软组织影或积液填充,但结节状增厚可能提示GPA[5]。中晚期患者可见鼻窦骨质破坏、新骨形成、骨性鼻中隔及鼻甲破坏消失。上颌窦最易受侵,其次是筛窦和蝶窦,额窦最少见[4]。影像学上GPA需与淋巴瘤、结节病相鉴别,淋巴瘤通常表现为大的软组织肿块以及硬腭缺损,而结节病与GPA很难区分,值得注意的是GPA更倾向对鼻中隔和鼻甲的腐蚀[1]。经典GPA患者的肺部影像学表现两侧肺内多发、多形、多变的结节灶和/或肿块,可伴有空洞形成[6]。
GPA在我国很少见,且可累及全身多个器官,临床表现复杂,早期确诊难度很大,很容易导致漏诊、误诊。根据美国风湿病学会(ACR)在1990年制定的GPA诊断标准,下列4项标准中有2项以上符合即可诊断:①鼻或口腔受侵犯;②胸部X射线显示肺部结节、固定肺浸润或空洞;③镜下血尿>5个红细胞/HP或红细胞管型;④病理提示动脉内或动脉血管周围区的肉芽肿性炎症[5]。同时,ANCA阳性对GPA的诊断具有重要意义,在90%~95%的GPA中晚期患者中可检测出ANCA的升高,但值得注意的是,当GPA尚处于疾病局限期时,可能不能检出ANCA[5]。此外,对受侵组织进行病理活检有助于诊断。然而,仅有16% GPA患者的鼻腔组织病检呈经典的肉芽肿、血管炎和局灶性坏死[7]。
目前对于GPA尚无治愈的方法,对于尚未累及重要器官者一般使用糖皮质激素和甲氨蝶呤,对于侵犯肾脏及呼吸道甚至威胁生命的GPA患者,糖皮质激素和环磷酰胺的联合治疗为目前主要治疗手段[7]。最近,肿瘤坏死因子-α、B细胞抗体(利妥昔单抗)等也被运用在难治性复发性GPA的治疗中[8]。鼻腔局部生理盐水冲洗也可作为辅助的治疗手段,以便于鼻腔分泌物的清洗[5]。未及时治疗的GPA患者2年内死亡率可高达90%,死因主要是肾衰竭和/或呼吸衰竭[3]。预后不仅取决于病变本身,还包括治疗对其他器官的损害。因此早发现、早诊断、早治疗对预后及患者生存期具有重要意义。
本病临床少见,症状多样无特异性。本例患者以鼻阻伴流脓涕首诊于耳鼻咽喉头颈外科入院,但反复出现高热且抗感染效果差、病检提示大量坏死组织及肾脏受损,最终确诊GPA。这提示临床工作者需了解GPA的临床表现、影像学和病理特点,当疾病侵犯多个系统,抗生素治疗无效时需要警惕本病的可能。
