脱细胞真皮基质膜联合骨修复材料在整复下颌骨缺损中的作用
2021-03-19沈阳,郭骏,费伟,
沈 阳,郭 骏,费 伟,
(1.西南医科大学,四川 泸州 646000;2.四川省医学科学院·四川省人民医院,四川 成都 610000)
下颌骨位于面下部,其外观、结构以及功能都非常复杂,同时也是颌面部唯一能活动的骨骼。肿瘤、囊肿、感染、放射性骨坏死、牙周病等疾病会导致下颌骨缺损,从而使患者外观遭到不同程度的损害,严重时还可影响呼吸、咀嚼和语言等多种重要功能[1]。引导骨再生技术(guided bone regeneration,GBR)不仅能够处理由牙周疾病、放射性骨坏死、外伤感染以及肿瘤等因素导致的下颌骨缺损,对于因种植体区域骨量不足、周围软组织炎症引发的骨吸收问题等方面上也是一个重要的技术手段。由于Bio-Gide膜生物相容性好,且存在特殊的细胞黏附位点,成为引导骨再生效果较好的可吸收胶原膜,但该膜吸湿后质地绵软,易发生塌陷和移位,且价格昂贵;而ADM膜(acellular dermal matrix,ADM)作为一种较易获取的可吸收膜,其成本低廉且生物相容性好[2~5]。本研究比较ADM膜和Bio-Gide膜在引导骨组织再生中的作用,为ADM膜在临床运用提供更多实验依据。
1 材料与方法
1.1 实验动物于2019年9月至2020年1月健康成年比格犬9只,购自成都达硕生物科技有限公司,12月龄左右,雌雄不限,体重15 kg左右,分笼喂养。利用SPSS 22.0生成随机数对9只比格犬进行随机编号1~9,每只比格犬建立4个下颌骨箱状缺损,共计36个。将36个骨缺损模型完全随机分为A、B、C、D四组,每组各9个。
1.2 方法肌肉注射陆眠宁(0.12 ml/kg)麻醉,常规消毒,铺巾。于双侧下颌骨下缘作横行切口,钝性分离骨膜,暴露双侧下颌骨体部,在0.9%的生理盐水冷却下,在左右下颌骨体部各建立两个箱状骨缺损,尺寸为:长10 mm,宽10 mm,深5 mm,缺损与缺损间距为5 mm。操作过程注意不破坏颊侧骨板的完整性[3]。将ADM膜和Bio-Gide膜修剪成11 mm×11 mm大小。A组使用ADM膜(30 mm×40 mm)(烟台正海生物技术有限公司)+颗粒状骨修复材料(0.25~1 mm)(烟台正海生物技术有限公司),B组使用Bio-Gide膜(25 mm×25 mm)(瑞士盖氏制药有限公司)+骨修复材料、C组使用骨修复材料、D组为空白对照。严密缝合术区,术后肌注青霉素80万单位/d、复方氯己定漱口液冲洗口腔7d,流食饲养,加强营养护理及监护管理。在术后4、8、12 w各随机处死3只比格犬取材。
1.3 观察指标①大体观察:观察比格犬的术后情况,包括进食情况、创口有无出血、感染、肿胀等。②组织学观察:切取实验区组织块,用40 g/L的多聚甲醛进行固定,EDTA脱钙、脱水、浸蜡、包埋,制取切片进行HE染色。③新骨生成情况:对各实验阶段的比格犬进行螺旋CT(美国Picker公司)扫描,检测骨缺损区内植入材料部位CT值及观察新骨生成情况。④ Micro-CT观察对各实验阶段的比格犬进行Micro-CT扫描(Bruker micro-CT,比利时Kontich),获得实验区骨密度(bone mineralized density,BMD)以及骨体积分数(new bone Percentage,BV/TV)。⑤生物力学测定切取实验区组织块,测定弹性模量。
1.4 统计学方法使用SPSS 22.0软件,计量资料以均数±标准差表示,组间比较采用单因素方差分析,三组之间采用LSD和SNK进行两两分析。P<0.05为差异有统计学意义。
2 结果
2.1 大体观察所有实验犬饮食较好,切口愈合良好,术区未见红肿及渗出,A、B、C三组在4、8、12 w时缺损区域部分或完全被新骨充填,骨缺损区可预见性地形成新骨,随着骨修复材料植入时间的增加,缺损区骨生成量相应增加,D组骨缺损区域凹陷较大。
2.2 组织学观察4 w时:A、B两组底部骨修复材料部分吸收,骨小梁开始形成;C、D两组原始骨小梁间隔较宽,可见被覆结缔组织伸入新骨形成区域。8 w时:A、B两组底部骨小梁有板层骨形成,骨小梁增粗,有互相融合趋势,A、B两组相似;C组见底部骨小梁有板层骨形成,顶部原始骨小梁继续形成生长,小梁较纤细;D组新生骨生成迟缓,大部分仍为原始骨小梁。12 w时:A组骨小梁形成并大部分融合,可见粘合线,A、B两组相似;D组大部分为编织骨,底部少部分为板层骨,融合少,小梁间隙大;C组骨小梁形成并部分融合,可见骨修复材料吸收。见图1。
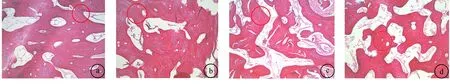
图1 4组12周时粘合线形成情况比较 a:A组;b:B组;c:C组;d:D组(HE染色,×100)
2.3 螺旋CT观察4 w时,A、B、C三组成骨效果明显比D组更好(P<0.05);8 w时,骨缺损区略有透射,骨密度增加,其中A、B两组成骨量明显增多,骨小梁排列紧密,均优于C、D两组(P<0.05);12 w时大部分标本骨密度逐渐增加,A、B两组成骨量均优于C、D两组(P<0.05),且A组与B组成骨效果无明显差异(P>0.05)。见表2。
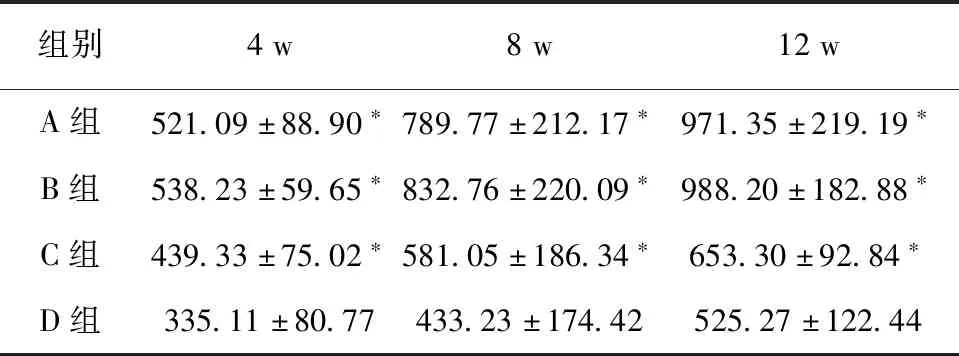
表2 各时期实验区平均CT值 (Hu)
2.4 Micro-CT观察在各时期,A、B两组BMD和BV/TV差异均无统计学意义(P>0.05);A、B两组BMD和BV/TV均显著高于C、D两组(P<0.05)。见表3、表4。
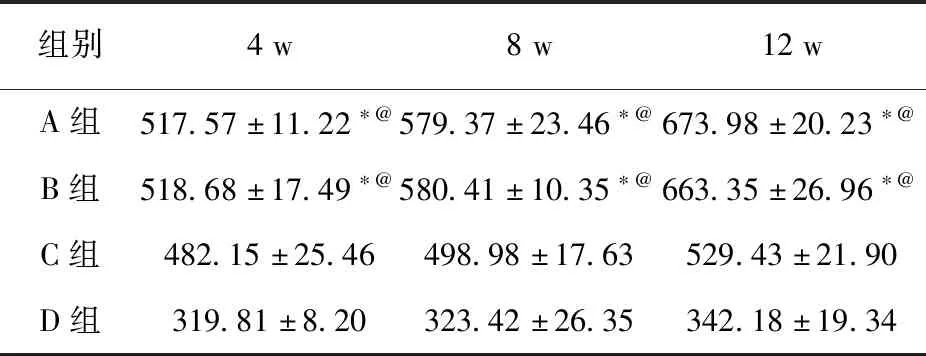
表3 各时期实验区平均BMD值 (mg/cm3)
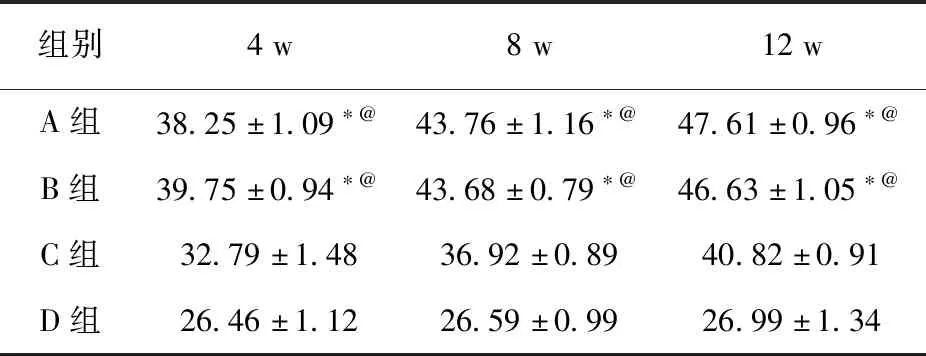
表4 各时期实验区平均BV/TV (%)
2.5 生物力学各时期A、B两组之间弹性模量比较,差异无统计学意义(P>0.05);A、B两组与C、D两组弹性模量比较,差异有统计学意义(P<0.05),见表5。
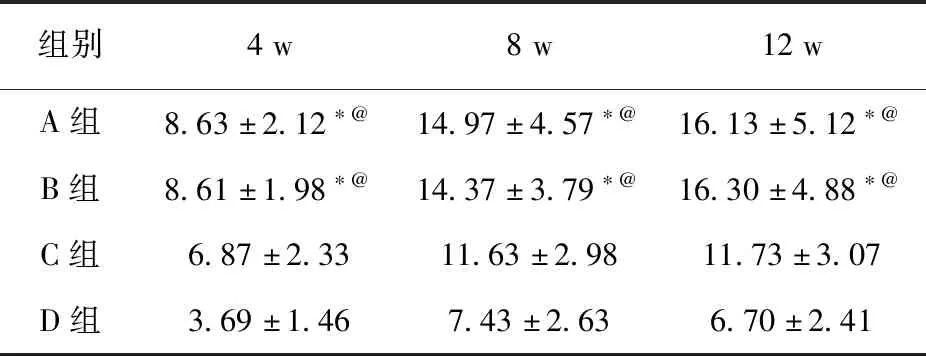
表5 各时期实验区弹性模量值 (GPa)
3 讨论
下颌骨在人体颅面部骨骼中是最大的可活动骨骼,可因感染、发育异常、肿瘤切除术等造成缺损。下颌骨缺损在临床上较常见,不仅能影响牙齿功能及面部美观,还会诱发其他疾病[4]。GBR技术是一种在临床上应用时间较久的骨缺损修复方法[6]。
GBR技术是利用生物屏障膜将牙周软组织与骨缺损分隔开,防止上皮细胞及成纤维细胞在缺损区占优势,从而让前体成骨细胞优先进入缺损区,以实现缺损区完全的骨修复[7,8]。通过GBR技术修复颌骨缺损,不仅能解决骨量不足的问题,还能使种植修复的远期成功率得到极大的提高并获得理想的美学效果[8],且成功再生的骨在功能性负荷过程中也表现得像天然骨[2]。目前GBR技术已被成功用于治疗多种类型的缺损,如:种植体相关的骨缺损,治疗牙槽嵴畸形、预防拔牙后的牙槽嵴畸形等[4,9,10]。
屏障膜的使用是GBR技术成功的要点。屏障膜可以有选择性的阻止上皮细胞和成纤维细胞在缺损区占优势,还可以提供物理保护,并为缺损区域提供相对稳定的空间来实现骨修复,且不妨碍缺损区自然愈合的膜状生物相容性材料[11]。目前,GBR技术中使用的生物膜分为可吸收(生物降解)与不可吸收(生物不降解)两大类,第一代屏障膜是不可吸收的,如膨胀聚四氟乙烯(ePTFE膜);随后,引入第二代可再吸收屏障膜,例如胶原膜、聚乳酸合膜等。两者各有优缺点:不可吸收膜虽然机械性能好,但组织相容性差,需要二次手术取出,增加患者的痛苦和费用,且在临床应用中存在较多并发症,如黏膜裂开、膜暴露、感染等,导致成骨失败[6,8]。Bio-Gide膜是可吸收膜的代表,该膜有更好的生物相容性,具有凝血作用且易操作,降解时间为4~6个月,具有良好的引导组织再生能力且不需要手术取出,其缺点主要是机械强度差,对于空间的维持能力较不可吸收膜差,且降解速率难以控制[6,11]。
ADM膜是另外一种可吸收膜,具有良好的组织相容性、易于获取、价格低廉等优点[12]。ADM膜是一种生物相容的人结缔组织基质,该制造过程通过去除来自表皮和真皮所有细胞,从人体供体皮肤中去除可能导致排斥反应的成分[13]。有研究表明:GBR术后骨形成不充分的原因主要是屏障膜暴露、污染和周围组织感染,在感染或膜暴露后,骨高度降低51%~79%[14]。此外,牙周致病原的定居或可吸收膜的过度降解可能导致骨再生量减少约5倍[15]。因此,理想的屏障应由不易受暴露影响、且暴露于口腔时不易被牙周病致病细菌轻易定植的材料制成[4]。而多项研究表明,ADM膜除了具有屏障作用、增加牙龈角化功能,还具有很强的抗感染能力,不会被牙周病原菌大量定居。在牙槽突裂植骨术中使用ADM膜可以防止术后骨移植物暴露,降低感染风险,且ADM膜可完全被宿主组织替代,无明显副作用。研究发现,在牙槽骨移植中使用ADM膜可以防止术后移植物暴露,且不会增加黏膜破坏的风险及完全愈合的时间[10,12,13]。此外,一些临床研究表明ADM膜在皮下植入后能保持长达2个月的结构完整性,在放置4~6个月后才完全降解,远远超过了骨细胞完成迁移所需要的3~4周,能有效使软组织和骨组织成为一个整体[9,15]。当ADM膜作为细胞膜支架,还可以促进细胞粘附和生长,提供有利于伤口愈合的基质,在牙槽突裂骨移植中使用ADM膜也能增加骨移植物的成骨效果[12]。
在本实验中:材料植入犬下颌骨缺损区,在血供足够的条件下,材料内部逐步再血管化,间充质细胞分化为成骨细胞,产生大量胶原包裹骨修复材料。同时,增加的破骨细胞逐渐吞噬骨修复材料,紧贴骨修复材料边缘逐渐有新骨生成,随着植入时间增加,新骨增多,逐步替代骨修复材料组织,改建为成熟骨组织。在实验的各个时间点,通过大体观察和组织学观察,可看出骨缺损区植入骨修复材料后,有可预见性的骨增量,新骨生成并改建,并可在镜下见粘合线和骨单位形成。螺旋CT检查发现,随着骨修复材料材料植入时间的增加,骨密度逐渐增加,说明新骨逐渐生成,且A、B两组成骨效果相近,均优于其余两组。Micro-CT数值以及生物力学检测显示:A、B两组成骨增多,明显优于C、D两组。新骨生成的同时骨修复材料逐渐降解,随后骨改建完成,骨缺损内新骨的弹性模量逐渐增加,有利于骨移植后种植体的稳定。本研究的结果表明,ADM膜在GBR技术中作为一种屏障膜是有效的,与Bio-Gide膜没有统计学上的显著差异,其影像学和组织学形态结果相似[4,9]。此外,在一项具有临界下颌骨缺损的犬类研究中,在GBR中使用ADM膜作为屏障的16 w后,与使用传统胶原膜相比,两组之间未发现统计学上的显著差异[6]。
ADM膜和Bio-Gide膜作为可吸收胶原膜,在GBR技术中可有效的屏蔽成纤维细胞及上皮细胞长入,无需二次手术。在此实验中,大体观察、组织学观察、螺旋CT扫描、Micro-CT数值以及生物力学检测结果都显示,两种膜在引导骨组织再生中作用相当,具有同等优良的性能,且ADM膜成本明显较低。
