温和灸预处理对幼鼠心肌缺血再灌注损伤的影响
2021-03-18葛瑜
葛瑜
(长江大学附属仙桃市第一人民医院,仙桃 433000)
先天性心脏病(congenital heart disease, CHD)是胎儿期心脏及大血管发育异常或形成障碍或出生后本应关闭的通道未能闭合而引起的解剖结构异常,是最常见的先天畸形[1]。我国每年约有15万先天性心脏病患者出生,发生率居我国主要先天畸形的第3位,仅次于神经管缺陷和唇腭裂,在婴儿死亡原因中已占到第2-4位[2-3]。先天性心脏病患者大多心肌细胞发育不良,心肌细胞线粒体对氧的摄取和利用障碍,对心肌缺血再灌注损伤(myocardial ischemia/reperfusion injury, MIRI)尤其敏感,MIRI已成为影响先天性心脏病患者临床疗效的重要问题[4]。心肌缺血再灌注时期,心肌细胞会出现氧自由基增多、线粒体损伤、钙超载、炎症反应、细胞自噬和凋亡等病理性修复,导致心肌超微结构进一步改变和不可逆性损伤,这一过程称心肌缺血/再灌注损伤[5-7]。细胞自噬是真核生物细胞通过双层膜结构的自噬体将胞质内含物转运到溶酶体,降解长寿蛋白及过量或有缺陷的细胞器的过程。细胞自噬具有双面性[8-9],急性心肌缺血期细胞自噬可促进ATP产生,维持心肌能量供应和心肌活力,而再灌注期心肌细胞过度自噬可引起自噬性凋亡导致心功能障碍。研究[10-11]表明,中医疗法具有促进血管新生、抗氧化等作用,有效保护心肌,降低MIRI程度。艾灸疗法虽然在冠心病、心绞痛、急性心肌梗死、动脉硬化等成人心脑血管疾病方面的疗效值得肯定[12-14],但在幼儿心脏疾病方面的研究较少。本实验通过生化指标检测和缺血区心肌组织形态及超微结构变化,探讨温和灸预处理对MIRI幼鼠心肌的影响及作用机制。
1 材料与方法
1.1 实验动物及分组
40只3~4 周龄健康SD大鼠(湖北省医学科学研究院实验动物中心,实验动物设施使用证编号为No.00133292),雌雄不限,体质量50~70 g,动物喂养于标准动物房。按照随机数字表法将幼鼠分为假手术组、模型组、缺血预适应组、温和灸预处理组,每组10只。本实验严格按照科技部[2006]398号《关于善待实验动物的指导性意见》文件要求进行实验。本实验经湖北省医学科学研究院实验动物中心伦理审查委员会审查批准(批准号No.SXDX2019050A)。
1.2 主要仪器及试剂
ALC-V8S小动物呼吸机(上海奥尔科特生物科技有限公司),ECG-1106G六道自动分析心电图机(深圳凯沃尔电子仪器有限公司)、蕲艾艾灸条(4 mm×120 mm,蕲春李时珍地道中药材有限公司)、超声细胞粉碎机(宁波新芝生物)、台式高速冷冻离心机(Heal Force)、全自动研磨仪(武汉赛维尔生物)、酶标检测仪(BioTeK)、全自动生化分析仪(深圳雷杜生命科技)、病理切片机(上海徕卡仪器有限公司)、正置光学显微镜(日本尼康)、透射电子显微镜(FEI)、812包埋剂(SPI)、电镜固定液(武汉谷歌生物)。
1.3 实验方法
1.3.1 预处理方法
模型组、假手术组、缺血预适应组取材前连续捆绑7 d,每日1次,每次20 min;温和灸预处理组幼鼠仰卧固定于鼠板上,自制艾灸器距皮肤2~3 cm,温和灸内关、足三里、关元,参照《大鼠穴位图谱的研制》[15],每日1次,每次20 min,连续治疗7 d,每次治疗时左、右足三里穴和内关穴任选一侧,交替进行。
1.3.2 模型制备[16-17]
各组幼鼠预处理结束后第8天造模。
模型组:10%水合氯醛(0.25 ml/100 g)腹腔注射麻醉,起效后仰卧位捆绑于(37±3)℃的鼠台上,接心电监护仪,标准Ⅱ导联监测心电图,颈胸部去毛,切开颈部皮肤,于气管软骨环处行气管切开术,接入呼吸机。沿胸骨正中线左侧第3、4肋间隙处横向切开皮肤,钝性分离各肌层及胸膜,挑开心包膜,暴露心脏,用2×6带线无创缝合针在左心耳根部下方进针,深度为2~3 mm,绕过冠状动脉左前降支在肺动脉圆锥旁出针,丝线上方垫一空心硅胶管,结扎冠状动脉30 min后采用推管法再灌注120 min。
假手术组:麻醉、气管插管、开胸、穿线方法同上,穿线后不结扎,150 min后取材。
缺血预适应组:麻醉、气管插管、开胸、穿线方法同上,打活结结扎冠状动脉缺血5 min,松解扎线再灌注5 min,重复3次,后续缺血/再灌注操作同模型组。
温和灸预处理组:造模方法模型组。
造模成功评价标准[18],①结扎左冠状动脉前降支后,左心室前壁变青紫或苍白,左心前室壁向外膨胀,搏动减弱。心电图表现为ST段抬高(≥0.25 mV),R波增宽,即为心肌缺血标志。②再灌注成功后,左心室前壁缺血区颜色恢复正常,同时出现反应性充血水肿,抬高的ST段至少下降1/2左右。具体为心电图显示,结扎前幼鼠心电图稳定,缺血30 min及再灌注120 min过程中,Ⅱ导联ST段均显著抬高,表现为明显的缺血状态,与缺血时段相比,再灌注过程中幼鼠Ⅱ导联ST段回落且大于1/2,说明MIRI模型成功。
1.4 指标检测
1.4.1 标本采集
造模结束后取材,心脏取血2 mL,3000 r/min离心10 min,分离血清,﹣20℃保存。模型组、缺血预适应组、温和灸预处理组幼鼠均取结扎下段缺血区心肌组织,假手术组取穿线下段组织,0.9%氯化钠清洗,再将各组组织修剪成3份1 mm3的组织块,1份投入电镜固定液中4℃固定2~4 h;1份投入4%多聚甲醛中固定24 h以上;1份装入EP管后冻存于﹣80℃冰箱。
1.4.2 生化指标检测
紫外分光光度法检测血清CK-MB、cTnT,上样后全自动生化分析仪器自动检测,考马斯亮蓝法测定ATP、SOD,严格按试剂盒说明书操作测出CK-MB、cTnT、ATP含量及SOD活性。
1.4.3 石蜡切片HE染色实验
将组织从固定液中取出,梯度乙醇脱水后浸蜡组织包埋。冻台冷却,凝固后修整蜡块,片厚4 μm。组织展平后捞起,放进60℃烘箱内将蜡烤化备用。依次将切片放入二甲苯Ⅰ 20 min-二甲苯Ⅱ 20 min-无水乙醇Ⅰ 10 min-无水乙醇Ⅱ 10 min-95%乙醇5 min-90%乙醇5 min-80%乙醇5 min-70%乙醇5 min-蒸馏水洗。切片入Harris苏木素染3~8 min,自来水冲洗,1%的盐酸乙醇分化数秒,冲洗,0.6%氨水返蓝,冲洗。切片入伊红染液中染色1~3 min。依次放入95%乙醇Ⅰ 5 min-95%乙醇Ⅱ 5 min-无水乙醇Ⅰ 5 min-无水乙醇Ⅱ 5 min-二甲苯Ⅰ 5 min-二甲苯Ⅱ 5 min中脱水透明,稍晾干,中性树胶封片。显微镜镜检,图像采集分析。
1.4.4 透射电镜观察
细胞离心后弃去培养液,加入电镜固定液4℃固定2 h。0.1 M磷酸缓冲液PBS(pH7.4)漂洗3次,每次15 min。组织依次入50%-70%-80%-90%-95%-100%乙醇脱水,每次15 min。丙酮:812包埋剂=1:1混合液渗透过夜,纯812包埋剂渗透过夜。60℃聚合48 h。切片。铀铅双染色,切片室温干燥过夜。透射电子显微镜下观察,采集图像分析。
1.5 统计学方法
采用IBM-SPSS22.0软件进行实验数据分析。符合正态分布的计量资料以均数±标准差表示,多组间比较采用ANOVA分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组血清CK-MB、cTnT、ATP浓度及SOD活性比较
由表1可见,与假手术组相比,模型组大鼠血清CKMB、cTnT浓度均显著上升(P<0.05),ATP浓度和SOD活性均显著下降(P<0.05);与模型组比较,缺血预适应组和温和灸预处理组大鼠血清CK-MB、cTnT浓度均显著降低(P<0.05),ATP浓度和SOD活性均显著增加(P<0.05),其中,温和灸预处理组和缺血预适应组相比,差异无统计学意义(P>0.05)。
表1 各组血清CK-MB、cTnT、ATP浓度及SOD活性比较 (±s)

表1 各组血清CK-MB、cTnT、ATP浓度及SOD活性比较 (±s)
注:与假手术组比较1)P<0.05;与模型组比较2)P<0.05
组别 n CK-MB(U/mL) cTnT(μg/L) ATP(μmoL/Kg) SOD(U/mg pro)假手术组 10 1.10±0.47 1.32±0.29 5.91±0.36 146.00±9.80模型组 10 2.31±0.491) 8.80±2.431) 2.01±0.341) 70.10±8.501)缺血预适应组 10 1.40±0.401)2) 5.20±1.831)2) 4.16±0.571)2) 99.10±6.101)2)温和灸预处理组 10 1.38±0.421)2) 5.19±1.911)2) 3.99±0.511)2) 101.25±5.301)2)
2.2 HE染色实验观察各组幼鼠心肌细胞病理变化
由图1可见,假手术组幼鼠心肌纤维排列基本规则,未见明显溶解断裂及坏死,细胞间隙正常;模型组心肌纤维排列紊乱,可见明显溶解断裂甚至坏死,组织水肿,间隙增大,部分细胞核及线粒体固缩,部分线粒体形态结构不完整;缺血预适应组和温和灸预处理组心肌纤维排列紊乱程度、心肌细胞水肿程度及间质水肿程度较模型组均有所改善,坏死灶减轻,心肌纤维间隙轻度增宽,细胞核及线粒体形态结构基本正常,其中温和灸预处理组改善较明显。
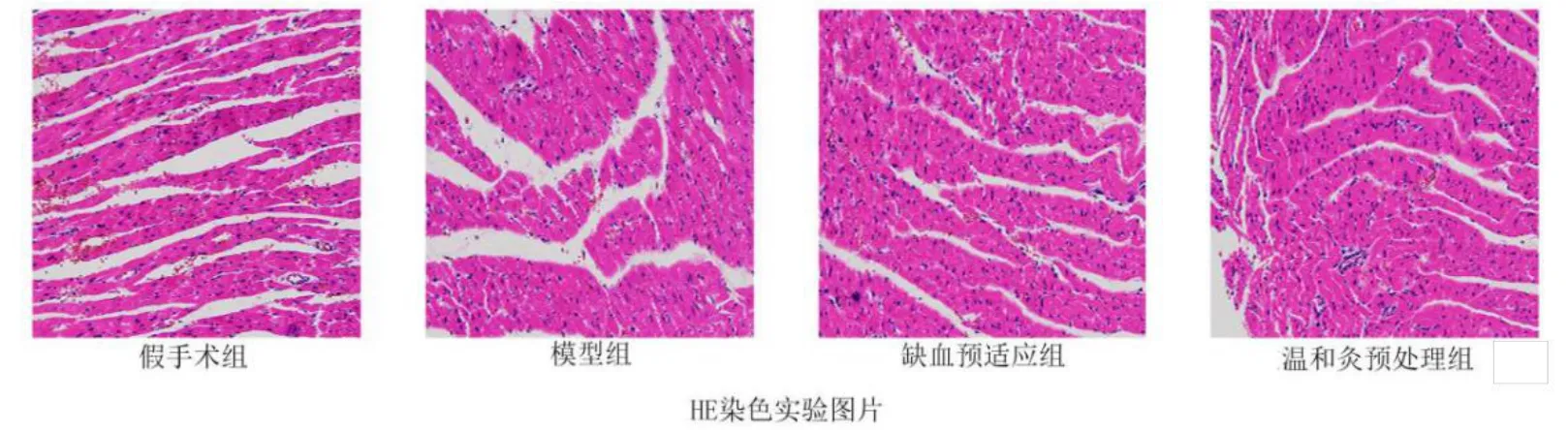
图1 心肌组织HE染色切片的病理学检查(×200)
2.3 透射电镜观察各组幼鼠心肌细胞超微结构变化
由图2可见,假手术组幼鼠心肌细胞排列基本规则,结构完整,横纹清晰,胞质充实;线粒体数量正常,结构清晰完整,可见少量自噬空泡。模型组心肌细胞结构模糊,肌纤维溶解断裂甚至坏死,横纹模糊不清,间隙增大;线粒体肿胀明显甚至破裂,线粒体嵴断裂、缺失;可见多个自噬空泡、自噬溶酶体。与模型组相比,缺血预适应组和温和灸预处理组心肌纤维较清晰,细胞排列稍紊乱,间隙轻度增宽;线粒体结构基本完整,线粒体嵴未见明显断裂、缺失;细胞内自噬空泡和自噬溶酶体较少,其中,温和灸预处理组较缺血预适应组改善更明显。
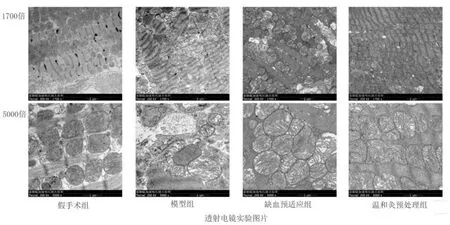
图2 透射电镜观察心肌细胞的超微结构变化
4 讨论
先天性心脏病患者心肌细胞线粒体对氧的摄取和利用障碍,对心肌缺血再灌注损伤尤其敏感,在进行外科手术和介入治疗过程中心肌处于缺血缺氧状态,MIRI严重影响先心病患者临床疗效[19]。婴幼儿心肌细胞尚未成熟,结构、功能、缺血、缺氧等方面与成人心肌存在明显差异,因此成人心脏手术中心肌保护技术并不适用于婴幼儿[20-21]。大量研究[22-24]证实,内关、足三里、关元在治疗急慢性心肌缺血、冠心病、血管粥样硬化等心血管疾病方面疗效显著,能够提高机体免疫力、提高线粒体抗氧化能力,降低心肌酶活性,减轻MIRI。
细胞自噬是细胞的一种自我保护机制,细胞利用自噬溶酶体降解受损、变性或衰老的大分子物质及细胞器,平衡自身代谢,在调节细胞生存和死亡的过程中起着重要的作用[25]。正常心脏中维持心肌功能的自噬活性水平较低,在心肌梗死、MIRI等心脏应激期间自噬较活跃[26]。目前研究普遍认为,自噬是MIRI的重要机制之一,在心肌缺血/再灌注过程中起着双重作用,缺血期通过缓解能量危机和降解受损细胞器保护心肌,再灌注期过度的自噬激活会引起细胞自噬性凋亡,因此许多学者认为通过调控细胞自噬可减轻MIRI[27-28]。自由基介导的氧化应激反应是导致MIRI的又一重要致病机制,氧自由基的主要清除酶是超氧化物歧化酶(SOD),早期抗氧化治疗能明显减轻MIRI[29]。“缺血预适应”是Murry CE等[30]提出的一种内源性心脏保护机制,是指在梗死性缺血发生之前反复实施数次规律、短暂的非损伤性缺血/再灌注的过程,后期实验证明,心肌缺血预适应可以调控自噬,增强心肌细胞自噬活性,使心肌处于应激状态,增强心脏对后期严重缺血缺氧的抵抗力与耐受力,减少最终心肌梗死范围,从而达到保护心肌的作用[31-32]。本实验中,温和灸预处理能明显提高SOD活性,降低心肌ATP消耗速度,与模型组相比,温和灸预处理组和缺血预适应组自噬空泡和自噬溶酶体较少,初步说明温和灸预处理能维持心肌能量供应,增强心肌抗氧化能力,能产生与缺血预适应相似的调控细胞自噬,减轻细胞过度自噬造成的损伤,保护心脏。总的来说,本实验结果表明,温和灸预处理能增强心肌抗氧化能力,维持心肌细胞能量供应,减轻MIRI对心肌超微结构造成的伤害,其作用机制可能与调控细胞自噬相关。此外,与心肌缺血预适应干预相比,艾灸预处理操作方便,避免了剖开胸腔时造成的损伤,具有较大的临床应用价值。但由于本次实验样本量较小,缺少对自噬相关基因的研究,因此仍需后期大样本、全方位、分子生物学方面的实验进一步证实。
