针灸对克罗恩病患者结肠黏膜基因表达谱的影响
2021-03-18翁志军汪迪郑寒丹施茵刘雅楠包春辉陆嫄吴焕淦刘慧荣马晓芃吴璐一黄艳
翁志军,汪迪,郑寒丹,施茵,刘雅楠,包春辉,陆嫄,吴焕淦,刘慧荣,马晓芃,吴璐一,黄艳
(1.上海市针灸经络研究所,上海 200030;2.上海中医药大学附属岳阳中西医结合医院,上海 200437;3.上海中医药大学针灸免疫效应重点研究室,上海 200030)
克罗恩病(Crohn’s Disease, CD)是一种涉及胃肠道全层的慢性非特异性肉芽肿性炎症性肠病。目前,该病病因尚不明确,与遗传易感性、免疫、肠道菌群失调、环境、精神等多方面因素有关[1]。欧美地区发病率较高,亚洲发病率较低。有研究显示,CD在英国发病率为 10.1/105人~11.1/105人,患病率为 55/105人~140/105人,每年大约有13 300例新发病例[2]。我国CD总体发病率及患病率分别为 0.848/105人和 2.29/105人[3],虽总体低于欧美国家,但呈上升趋势,已成为消化系统常见的难治性疾病之一。临床常用5-氨基水杨酸、激素、免疫抑制剂、生物制剂等为主进行治疗,可较好地控制急性症状,诱导缓解;但撤药时疾病容易反复发作或药物的不良反应使临床应用受限[4]。
针灸在治疗炎症性肠病上有不同程度的疗效[5-6]。本课题组前期研究也发现,隔药灸治疗 CD疗效确切,不仅可以改善轻度、中度CD患者的临床症状(近期有效率为72.5%),还能降低活动期CD患者的克罗恩病疾病活动指数(CDAI),改善结肠组织炎症,提高患者的生活质量[7-8]。相关机制研究发现针灸能通过上调 CD患者结肠上皮紧密连接蛋白的表达,修复肠上皮屏障病变,减轻肠道炎症反应[9]。但针灸治疗 CD的作用机制尚未阐明。
基因表达谱的改变和功能异常在免疫功能调节和自身免疫性疾病(包括CD)的进展中起着关键作用[10]。单细胞测序(single-cell RNA-seq)技术的成熟开展,能从外周血、结肠中分离的稀有细胞的层面研究 CD的发病机制,目前单细胞测序研究较多的是转录组学[11-12]。LncRNA/miRNA-mRNA调控网络介导的分子机制成为 CD发病机制研究的热点[13-14],而 messenger RNA(mRNA)作为蛋白翻译调控的重要 RNA,实现了遗传信息在蛋白质上的表达,能直接影响蛋白质合成和细胞表型。已有研究证实CD患者结肠炎症部位的黏膜组织中有多种与CD相关的mRNA表达的异常[15],本课题组前期研究也发现艾灸能调控 CD大鼠结肠黏膜免疫和自噬相关基因的表达异常[16]。因此,本研究进一步采用基因芯片技术对CD进行全面的mRNA表达谱的研究,筛选出针灸治疗CD患者结肠黏膜的差异表达的基因,再对差异表达的基因进行GO分析和Pathway生物信息学分析,探索针灸治疗 CD的相关信号通路,以期为针灸治疗CD效应机制研究提供新的研究方向,现报道如下。
1 临床资料
1.1 一般资料
本研究的3名CD受试者来源于本课题组上海市针灸经络研究所的 1项克罗恩病的临床试验;并在复旦大学附属中山医院内镜中心招募健康受试者3名作为对照。该试验已通过上海中医药大学附属岳阳中西医结合医院伦理委员会审核。
1.2 纳入标准
①符合CD的诊断标准[17];②经确诊的轻度、中度CD患者(CDAI为151~450分);③前3个月未服用与本病治疗相关的药物;④同意参加本试验并签署知情同意书。
1.3 排除标准
1.3.1 CD排除标准
①重度CD患者或缓解期患者(CDAI>450分或<150分);②妊娠或哺乳期患者;③伴有心、脑、肝、肾及造血系统严重疾病的患者;④精神病或其他严重疾病患者。
1.3.2 健康受试者排除标准
肠镜下肉眼观察有结肠炎症、肿瘤者。
1.4 剔除脱落标准
①误诊、误纳的患者;②依从性差或有严重不良反应者;③治疗期间病情恶化必须实施紧急措施者;④主动退出或失访者;⑤未能完成全部治疗及随访者。
2 治疗方法
CD患者采用隔药灸配合针刺治疗。
2.1 隔药灸治疗
取穴分2组,①天枢(双)、气海、水分穴;②双侧肾俞、大肠俞穴,两组穴位交替使用。穴位定位参照《经穴部位(GB1234690)》标准。将附子、肉桂、丹参、红花等中药研末成粉,用黄酒调和药粉成厚糊状,并用模具制成直径2.3 cm、厚约0.5 cm的药饼。常规消毒后,将药饼放在相关穴位皮肤上,再将高1.7 cm、重约1.8 g的艾炷(河南南阳卧龙汉医艾绒有限责任公司)置于药饼上,点燃艾炷后施灸,治疗30 min。每日1次,每周6次,12次为1个疗程,疗程间休息3 d,共治疗6个疗程。
2.2 针刺治疗
取穴分两组,①足三里、上巨虚、曲池、合谷穴;②T6-L1夹脊穴,两组穴位交替使用。局部常规消毒后,采用 0.30 mm×40 mm毫针直刺20~40 mm,得气后行平补平泻法,留针30 min。隔日1次,每周3次,两周为1个疗程,疗程间休息3 d,共治疗6个疗程。
3 治疗效果
3.1 观察指标
3.1.1 结肠黏膜组织
所有健康志愿者及 CD患者在治疗前后分别进行结肠镜检并采集结肠黏膜,通过结肠镜检查确定无任何胃肠道疾病,取距结肠息肉旁5 cm处取肉眼正常的结肠黏膜。标本离体后分装于10%甲醛固定和冻存管,冻存管立即内置于液氮中,随后保存于﹣80℃冰箱。
3.1.2 组织病理学观察
将 10%甲醛溶液固定的结肠黏膜组织脱水包埋,每片切成 4 μm厚制成玻片,先脱蜡,再脱水。采用苏木素-伊红(HE)染色,观察结肠黏膜组织病理学改变。
3.1.3 mRNA芯片检测及数据分析
采用Trizol方法提取总RNA,参照厂家提供的实验方法(Invitrogen, Carlsbad, CA, USA),采用1%的琼脂糖凝胶电泳进行 RNA质检,Nanodrop(ND-1000,Nanodrop Technologies, Wilmington, DE, USA)检测其质量和定量;采用 1%的琼脂糖凝胶电泳观察总 RNA完整性,安捷伦 2100(Agilent Technologies)进行样本的质控,RNA integrity number(RIN)值>7的 RNA样本用于芯片分析。RNA样本保存在﹣80℃冰箱备用。芯片微阵列于Affymetrix fluidics station 450中洗涤后,先用链霉亲和素/藻红蛋白染色。对每个样本,用生物素化的山羊抗链霉亲和素孵育后,再用链霉亲和素/藻红蛋白进行二次孵育以进一步增强信号强度,然后测量第二轮强度。使用由Affymetrix Microarray Suite软件控制的Affymetrix扫描仪扫描微阵列。
基因芯片检测后,使用GenePix 4000B芯片扫描芯片的荧光强度,并将实验结果转换成数字型数据保存,对Raw data和Clean data进行深度评估,mapping到基因组上,mapping reads数超过总reads数的90%,对基因表达水平进行标准化,得到基因的表达量。设定基因表达上调或下调为其相对表达量 Log2fold change(FC)≥|±1|,对差异基因进行筛选、聚类分析、基因本体(Gene Ontology, GO)和信号转导通路(Pathway)富集分析研究。
3.2 结果
3.2.1 CD患者治疗后结肠黏膜组织病理学比较(见表1)

表1 CD患者治疗后结肠黏膜组织病理学比较
3.2.2 针灸治疗CD结肠黏膜差异表达基因及聚类分析
运用基因芯片检测健康志愿者及 CD患者治疗前后结肠黏膜组织的基因表达谱。芯片结果用Limma进行统计(Linear Models and Empirical Bayes Methods for Assessing Differential Expression in Microarray Experiments),在36333个探针(NimbleGen HG 18.0)中,健康志愿者和CD患者治疗前共有3449个基因存在显著性差异,其中CD患者治疗前较健康志愿者上调2250个,下调1199个;CD患者治疗后与治疗前有显著性差异的基因有1926个,其中治疗后较治疗前上调536个,下调1390个(P<0.05,FDR<0.05)。
为了进一步研究各组基因表达的不同,本研究采用Venn Diagrams分析差异基因的交集。将CD患者治疗前与健康志愿者差异表达的3449个mRNA和CD患者治疗后与治疗前差异表达的1926个mRNA取交集,发现共有388个交集基因。其中,治疗后下调的差异基因与治疗前相对于健康志愿者上调的表达基因共有326个;而治疗后上调的差异表达基因与治疗前相对于健康人下调的共表达基因有62个(见图1A-B)。说明针灸更趋于抑制过高表达的基因。
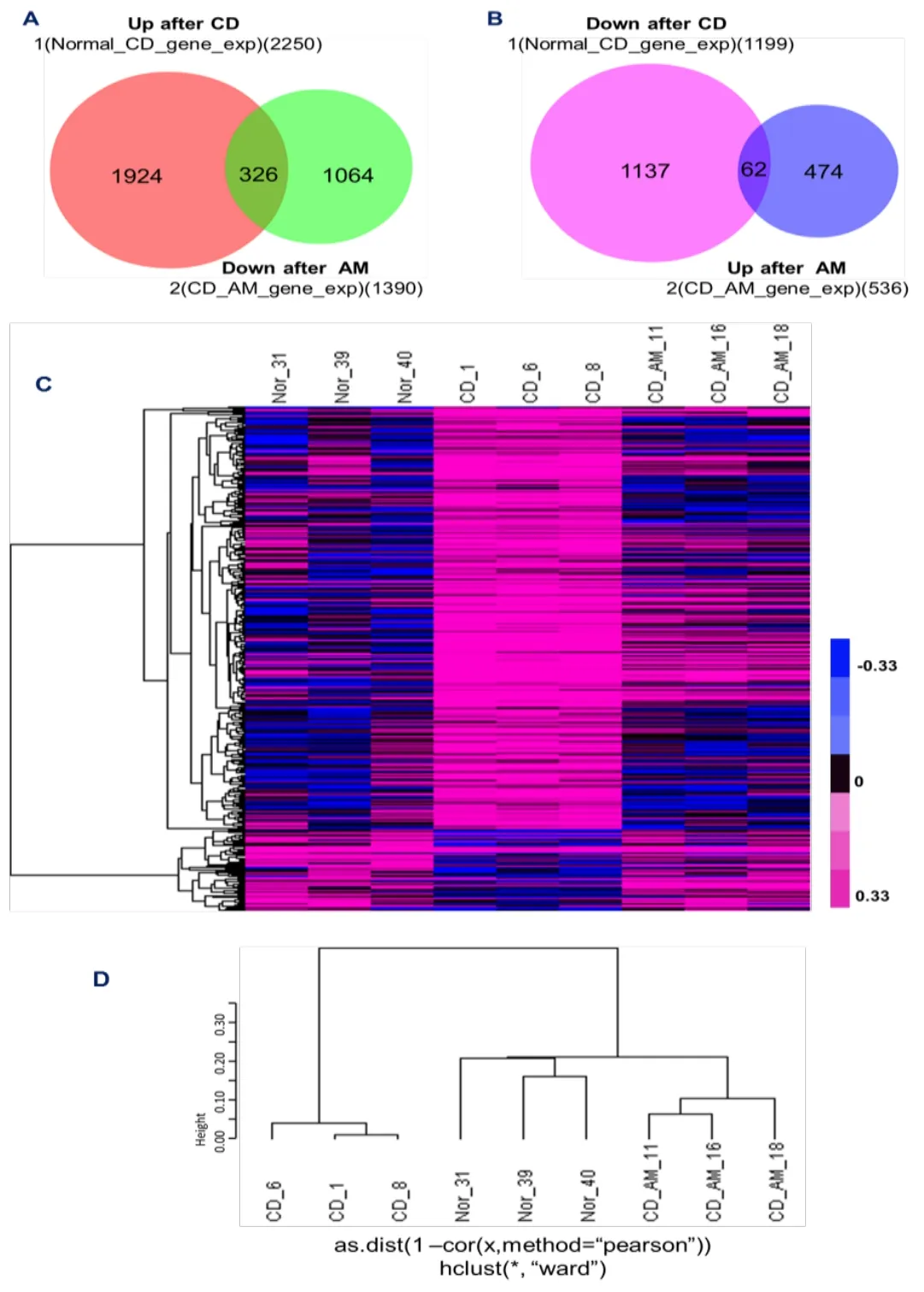
图1 组间差异表达基因的Venn diagrams及热图和聚类分析
采用Cluster 3.0和Treeview软件对基因芯片数据进行聚类分析。将3组交集的388个基因的表达量均取10为底的对数处理,热图体现了CD病理状态下上调和下调的基因在各个样本中的表达,同时体现了针灸后这些病理改变的差异表达基因可以被逆转(见图1C)。聚类图体现健康志愿者与CD患者治疗后基因表达类似,而与CD患者治疗前基因表达不同(见图1D)。
3.2.3 差异表达基因筛选
由于针灸治疗可调控的 CD患者治疗前较健康志愿者的差异表达基因较多,本研究分别将针灸后逆转CD病理性基因中上调的62个基因和下调的326个基因,按照 log2(FC)大小排列,前 30个差异表达基因列表见表2。其中,在 CD患者治疗前表达上调,且在 CD患者治疗后下调的倍数均>3的基因有4个,即CPS1、SCIN、C12orf27和GJB1。而在CD患者治疗前表达下调2倍以上,能被针灸逆转的基因倍数>2的基因只有CKB。详见表2、表3。

表2 针灸逆转的CD中前30个上调差异表达基因
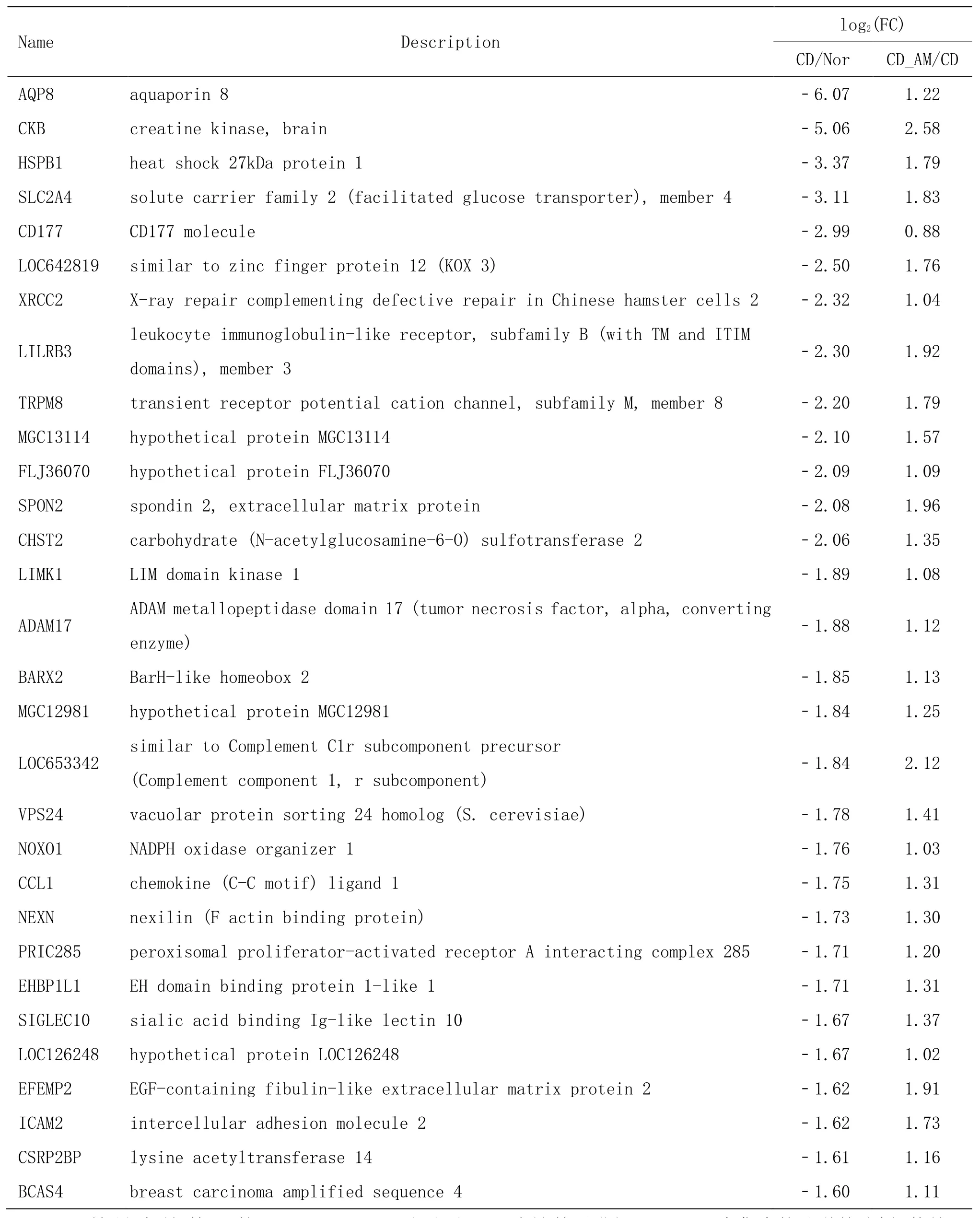
表3 针灸逆转的CD中前30个下调差异表达基因
3.2.4 差异表达基因的 Gene Ontology(GO)和Pathway功能分析
本研究对针灸后相对于 CD患者的结肠差异基因进行显著性GO和Pathway分析。按照生物途径,分子功能和细胞定位对基因进行注释和分类,通过对差异表达基因进行GO terms富集度统计学的分析,其前30个GO功能富集主要体现了针灸对CD患者免疫系统、神经信号转导、基因的转录调控3个方面的调节,主要包括转录因子STAT磷酸化、ATP酶活性、B细胞介导的免疫、自然杀伤细胞相关免疫等(见图2)。通过将差异表达基因进行KEGG Pathway富集分析,寻找显著性差异变化的生物学调控通路,其富集较多的前30个通路主要体现在针灸对CD患者免疫系统、基因的转录调控两方面信号通路的调节,主要包括 Toll-like受体信号通路、自噬调节系统、自然杀伤细胞介导的细胞毒作用(见图3)。
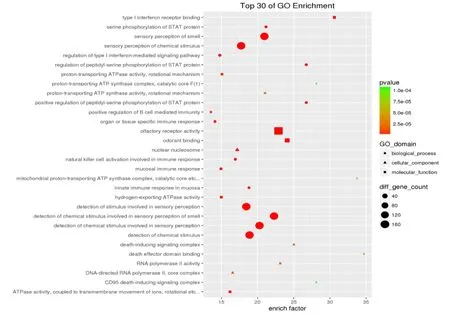
图2 CD患者治疗后差异表达基因前30个GO分析
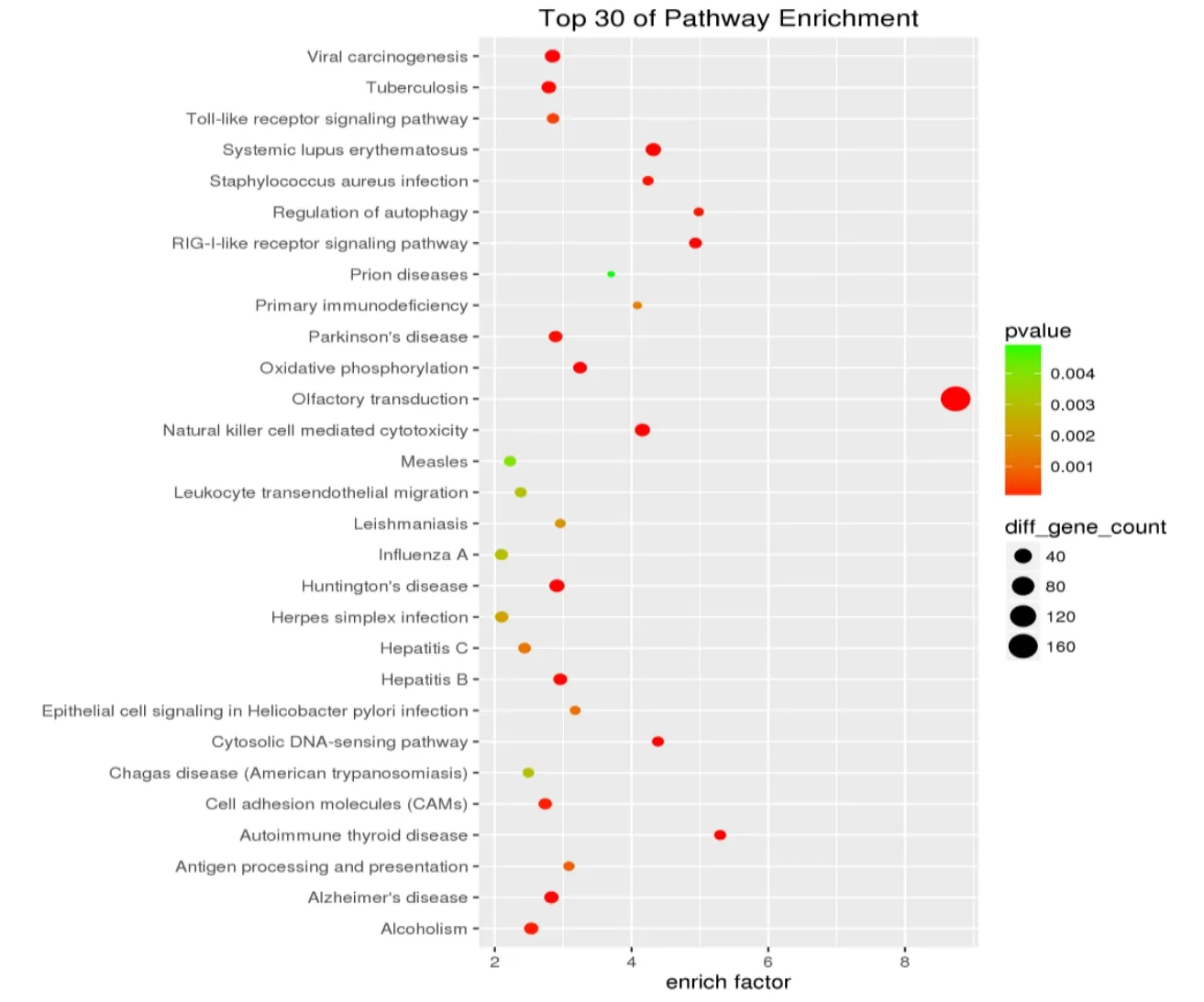
图3 CD患者治疗后差异表达基因前30个Pathway功能分析
4 讨论
克罗恩病是一种自身免疫性炎症性肠病,其关键作用因素尚未完全明确。基于数据库的基因表达谱研究和蛋白-蛋白相互作用网络已部分揭示了与CD发病机制密切相关的基因和信号转导途径[18]。目前,全基因组关联性研究已经确定了170多个与CD相关的基因位点,对CD相关基因的整合和网络分析将有助于充分明确疾病的预测基因以及了解CD的发病机制[19-20]。研究表明 CD患者结肠中有多种与炎症相关基因的表达失调,如 C4BPB、IL1RN、CXCL1、CXCL11、MMP7、SOD2等[21]。因此,检测和比较健康志愿者及CD患者针灸治疗前后结肠中的基因差异,也有利于发现针灸可调控基因的潜在功能,从而更好地阐释针灸的免疫效应机制。本研究运用基因芯片技术,发现CD患者治疗前与健康志愿者结肠黏膜有上千个差异表达的 mRNAs,而针灸可调控CD中388个mRNA的表达。有研究通过数据库分析鉴定出927个与CD相关的差异表达基因,其中PPAR信号通路中的LDLR、TLR2、FOXM1、NPY、LPL被认为是参与CD发病机制的重要基因[18]。Hong SN等[22]运用 RNA-seq研究了正常黏膜,非炎症和炎症部位的CD黏膜之间的全基因组转录组差异,在950个差异表达基因中,CD炎症部位黏膜组织中 ANGPT2、CHN1、CPXM1、CPZ、CXCL1、FCN3、GJC1、HSD11B1、LZTS1、MEOX1、MMP12、PLA1A、SERPINE1、SGIP1和TRPC4等16个基因显著上调,而 FAM189、PDE6A、SLC38A4和HMGCS2基因显著下调。多重基因检测发现CD患者结肠炎症部位的黏膜组织中炎症因子 IL17A、IL17F、IL23R、CCR6及IFN-γ的基因,编码抗菌肽的DEFB4和HAMP基因以及REG1A、LCN2、NOS2、CXCL1-2和S100A9基因等均明显上调[23-24]。还有研究通过定量基因表达分析了与CD相关的氧化应激和细胞凋亡相关基因,在CD病情恶化时,STAT1和PSKH1的特定表达上调,ABCB1和FASL表达下调,而在活动期患者中, FASR和NFKB1基因表达上调明显[25]。经对比发现,本研究所得到的CD差异表达基因与以往的研究有很大不同,这可能是与检测分析方法、样本量的多少等因素有关。本研究可能获得了许多新的与CD相关的基因靶点,这将为CD的机制研究提供新的思路。
针灸在治疗CD上具有明显的优势[8-9],以往研究证实针灸能通过上调A20表达水平,抑制TNF-α介导的细胞凋亡途径,缓解 CD肠上皮细胞凋亡的增加[26],并能调节 TNF-α-NF-κB-MLCK通路的异常激活,修复 CD肠上皮黏膜屏障[27]。本研究发现针灸可以逆转CD患者结肠中多种差异表达的基因,笔者重点关注了上下调较显著的前30个基因。目前这些基因与CD关系的研究较少,也尚未有针灸调控CD中这些基因表达的报道。但是,其中的 GSTA1是一种谷胱甘肽-S-转移酶-α,大肠杆菌脂多糖刺激可以通过GSTA1加重CD结肠黏膜炎症[28],而 TCN2基因多态性也被证实是 CD的易感基因[29]。笔者的基因芯片的结果显示针灸可以下调 CD中GSTA1和TCN2基因的高表达。因此,针灸可能通过调控GSTA1和TCN2的表达起到缓解CD结肠黏膜炎症的作用。但是GSTA1和TCN2具体的作用以及其他显著差异表达基因是否在针灸治疗 CD中发挥了作用还有待深入研究和证实。
研究证实多种免疫炎症因子和免疫信号通路参与CD的发生发展,如Treg/Th17相关因子、IL-12/IL-23通路、JAK-STAT信号通路、TLR4-NF-κB信号等[30-34],自噬相关基因对CD的生理病理也有很大的影响[35]。CD结肠黏膜中的差异表达基因在通路水平的分析显示,CD中的病毒感染和自身免疫通路明显上调[36]。笔者也分析了针灸调控的差异显著的前 30个上调和下调mRNA涉及的通路,发现主要有转录因子STAT磷酸化、ATP酶活性、B细胞介导的免疫、自然杀伤细胞相关免疫等与免疫调节相关的生物功能,并参与了 Tolllike受体信号通路、自噬调节系统、自然杀伤细胞介导的细胞毒作用等与免疫炎症相关的信号通路,这与以往研究中与 CD发生发展相关的信号通路具有一致性。因此,针灸可能通过调控关键mRNA的表达,影响其生物功能和与疾病相关的多种因子和免疫信号通路,从而起到改善和缓解CD肠道免疫炎症的作用。
综上所述,CD患者结肠黏膜组织存在基因表达谱的改变,针灸治疗可以调节部分疾病状态下差异表达的基因,其参与和涉及了多种与免疫炎症相关的生物功能和信号通路,提示针灸能有效治疗CD的机制与影响了结肠黏膜中的基因表达谱相关,主要参与细胞周期、免疫炎症反应、细胞自噬和组织重建等生物学过程,相关的通路主要有Toll-like受体信号通路、自噬调节系统、自然杀伤细胞介导的细胞毒作用。该研究结果为后期研究提供了方向,如细胞自噬的作用、免疫调节的Toll-like受体信号通路、自然杀伤细胞介导的细胞毒作用等。后期可结合多组学的系统生物学研究,将转录组学与DNA甲基化、非编码RNA介导的mRNA沉默、肠道菌群、组蛋白修饰、宏基因组学、代谢组学和蛋白组学等高通量测序结果结合分析,有助于探索新的作用机制。
