小麦矮秆突变体的鉴定及其突变性状的关联分析
2021-03-18贺军与尹顺琼陈云琼熊静蕾王卫斌周鸿斌王梦玥陈升位
贺军与 尹顺琼 陈云琼 熊静蕾 王卫斌 周鸿斌 陈 梅 王梦玥 陈升位
云南农业大学农学与生物技术学院, 云南昆明 650201
自“绿色革命”以来, 全球种植的小麦品种中有 90%含有矮秆和半矮秆基因[1-5]。迄今为止, 已报道的矮秆和半矮秆基因超过 25个, 但可用于小麦育种的矮秆基因局限于Rht-B1b、Rht-D1b、Rht8和Rht9[6-7]。矮秆基因Rht-B1b、Rht-D1b和Rht8在降低小麦株高时对其他性状无显著不良影响, 且Rht-D1b、Rht8和Rht9可显著增加穗粒数[8-12]。李杏普等[13]发现Rht10和Rht12的降秆作用大于Rht8, 但其株系的地上部分生物量低于Rht8株系。王清海等[14]研究发现Rht14、Rht16和Rht18的降秆效应分别为47.3%、39.9%和36.0%。携带Rht14、Rht16和Rht18的矮秆株系的小穗小花数变化不大, 但穗长变长。Rht5在降低小麦株高的同时会减少每穗小穗数和穗粒数[15]。前人研究表明, 大多数小麦推广品种携带的矮秆基因为Rht-B1b、Rht-D1b和Rht8[3-6,16-17], 可有效利用的矮秆亲本不足, 育成品种遗传背景狭窄。创制新突变体是解决该问题的有效策略。本文采用甲基磺酸乙酯(Ethyl methyl sulfonate, EMS)诱变‘云麦 53’ (国审品种)成熟种子, 通过诱变植株的连续3年套袋自交成功获得了一批株高、小穗密度和小花数等性状不同的候选突变体。基于连续2年的田间观察和常见矮秆基因的12个特异性分子标记检测鉴定了26株矮秆突变株, 分析了26个突变体的株高差异及其与穗长、小穗数和小穗密度等农艺性状的遗传关联性,评估了矮秆突变体的育种价值。
1 材料与方法
1.1 试验材料
诱变亲本‘云麦 53’由云南省农业科学研究院粮食作物研究所提供, 突变体由课题组创制。所有材料由课题组繁育并保存。
1.2 试验材料的种植及取样
1.2.1 材料诱变和繁育 将 15,000粒‘云麦 53’种子置于三角瓶中, 用pH 8.0的0.05 mol L-1磷酸缓冲液(PBS)震荡浸泡4 h, 再用0.6% EMS室温震荡浸泡16 h, 然后用自来水冲洗4 h。诱变种子及其后代均播种于云南农业大学昆明市盘龙区试验教学农场。分别套袋自交M1、M2和M3候选突变材料, 按单株收获种子。
1.2.2 农艺性状调查 按随机排列种植试验材料, 每个材料种植1行, 5行后种植1行诱变亲本。行距20cm, 株距5 cm, 3次重复。其他田间管理措施与常规大田管理一致。于2018—2019年度和2019—2020年度分别在开花期调查穗长、小穗数和小花数, 待种子成熟后调查株高、平均节间长和节间数。M2代调查单株性状, M3株系随机调查5株, 以5株均值代表株系性状的表型值。按下列公式计算小穗密度、平均节间长。
小穗密度=单株小穗数/单株穗长
平均节间长=单株节间长/单株节间数
1.2.3 矮秆基因的分子标记检测 于拔节期剪取M2单株及其诱变亲本的幼嫩叶片, 置于-80℃保存备用。采用CTAB法提取基因组 DNA。采用 Ellis等[18-19]报道的BF-WR1、BF-MR1、BF-WR2、BF-MR2、WMC317、BARC102、BARC151、WMC410和 WMS577, 以及XBARC3[20]、Xgwm261[20]和 WMC503[21]特异性标记检测突变体携带的矮秆基因(表1), 其中BF-WR1和BF2-WR2为野生型(株高正常)基因标记, 其余标记为突变型(矮秆)基因标记。由上海生工生物技术有限公司合成所有引物。参照前人报道的PCR扩增条件扩增各标记, 采用8%聚丙烯酰胺凝胶电泳检测 PCR扩增产物。上述标记均重复检测3次, 3次检测结果一致。
1.2.4 农艺性状的关联分析 基于SPSS 25.0软件的t测验、聚类、方差、多重比较和相关分析模块默认参数, 分析突变体株高差异及其与穗长、小穗数和小穗密度等性状的遗传关联性。显著和极显著水平分别为5%和1%。

表1 矮秆基因及其特异性标记的引物序列和片段长度Table 1 Specific molecular markers of dwarf genes and the fragment length and primers sequence of the markers
2 结果与分析
2.1 候选矮秆突变体的农艺性状差异分析
本研究采用t测验检测了‘云麦53’与33个候选材料的株高(M2单株表型值, M3株系均值)差异(表2)。结果表明,mutant 2、mutant 4、mutant 5等 26个材料与‘云麦 53’的株高存在显著或极显著差异, 为矮秆突变体。在26个矮秆突变体中mutant 16、mutant 23、mutant 25和mutant 26的株高值低于20 cm, mutant 18、mutant 19和mutant 20的株高值大于40 cm, 其余19个突变体的株高值介于20~40 cm之间(图1)。与‘云麦 53’相比, mutant 4、mutant 5 和 mutant 7等18个突变体的穗长显著或极显著缩短; mutant 4、mutant 5和 mutant 7等 11个突变体的小穗密度显著或极显著增加;mutant 18的小花数显著减少; mutant 5、mutant 11、mutant 14等13个突变体的平均节间长显著或极显著缩短; mutant 5、mutant 10和mutant 14等6个突变体的节间数显著或极显著减少(表2 和图2)。mutant 7、mutant 12、mutant 24、mutant 28和mutant 29的节间数在M2和M3代中未发生分离, 均低于‘云麦53’的节间数, 但因方差为0、未做t测验。26个矮秆突变体携带株高、穗长和小穗密度等多个突变性状。
2.2 候选矮秆突变体的分子标记检测
为了进一步验证 26个矮秆材料, 本文采用前人报道的矮秆基因的12个特异性标记检测了33个候选材料及其诱变亲本。结果表明, 在‘云麦53’中未检测到BF-MR1 (Rht-B1b)、BF2-WR2 (Rht-D1a)、BARC102 (Rht5)和 WMS577 (Rht13)标记, 但检测到其他9个标记。与‘云麦53’相比, mutant 1等32个候选突变体的BARC151 (Rht9)标记, mutant 2等5个候选突变体的Xgwm261 (Rht8)、WMC503 (Rht8)标记均具有差异, 表明其Rht9和Rht8基因发生了突变。在33个候选突变体中, mutant 3与‘云麦53’的共有扩增标记较多(7个), mutant 11与‘云麦 53’仅有 2个共同扩增标记(表3和图3),mutant 1、mutant 2、mutant 3、mutant 27 和 mutant 28 的Xgwm261 (Rht8)、WMC503 (Rht8)和 BARC151 (Rht9)均发生变异, 其中BARC151 (Rht9)标记位点的突变频率最高(表3)。
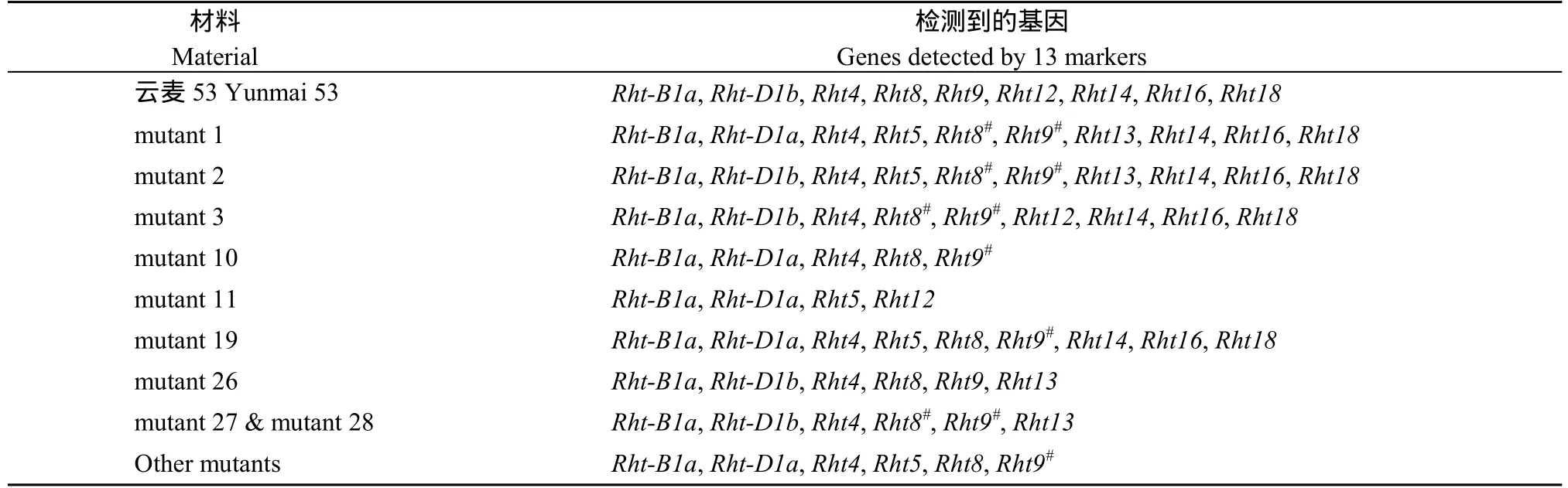
表3 ‘云麦53’和候选突变体中检测到的矮秆基因Table 3 Dwarf genes detected in the genome of ‘Yunmai 53’ and candidate mutants
2.3 基于7个性状的矮秆突变体聚类分析
基于株高、穗长和小穗密度等7个性状的聚类分析结果表明, 所有材料可聚为2个大类, 第1大类包括诱变亲本,第2大类包括所有突变体(图4)。第2大类可分为5个亚类,其中mutant 18和mutant 16分别聚为第1、2亚类, mutant 5、mutant 10和mutant 23等5个突变体为第3亚类, mutant 2、mutant 4和 mutant 6等 7个突变体为第 4亚类, 其余 12个突变体为第5亚类(图4)。与‘云麦 53’相比, 5个亚类的突变体均表现植株矮化、穗长和平均节间长缩短,但其余4个性状出现了分化。其中第1亚类突变体的小穗数和小花数极显著减少, 但小穗密度和节间数没有差异;第2~4亚类突变体的小穗密度极显著增加, 小花数和节间数极显著减少, 但小穗数没有明显变化(图5)。在 5个亚类中, 第 1亚类突变体的小穗数和小花数降幅最大; 第 2亚类的株高、穗长和平均节间长的降幅和小穗密度的增幅最大, 第3亚类突变体的节间数降幅最大(图5和附表1)。
2.4 突变农艺性状间的相关分析
基于26个突变体及其诱变亲本的株高等7个性状的二元相关和偏相关分析表明, 株高与穗长、小穗密度和平均节间长等 4个性状的二元相关系数达到了显著或极显著水平, 但只有平均节间长和节间数与株高偏相关; 穗长与小穗数、小穗密度和平均节间长的二元相关系数达到了显著或极显著水平, 但只有小穗密度和平均节间长与穗长存在负偏相关; 小穗数与小穗密度和小花数的二元相关和偏相关系数均达到了极显著水平; 小穗密度与小花数和节间数的二元相关系数达到了显著或极显著水平,但偏相关系数不显著; 虽然平均节间长与节间数的二元相关系数不显著, 但偏相关系数达到了显著水平(表4)。上述结果表明, 26个突变体的株高与平均节间长和节间数关联遗传, 其余4个性状与植株矮化没有遗传关联性。
3 讨论
通过诱变亲本和候选突变体连续 2个年度的株高比对分析, 作者发现了 26个矮秆突变体。基于前人报道的矮秆基因的12个特异性标记检测结果表明26个矮化材料至少携带有2个矮秆基因标记位点。虽然mutant 1、mutant 3和mutant 13等7个候选突变体中也检测到了矮秆基因突变, 但植株偏高, 为(33.76±10.16)~(63.99 ±2.51) cm, 且与诱变亲本‘云麦53’的株高没有显著差异。笔者认为这可能是2个年份间的株高波动降低了“t”值所致。在33个候选突变体中, 26个材料明显矮化、且携带不同的矮秆突变基因, 因此可判定为矮秆突变体。
除株高外, 26个矮秆突变体还携带穗长缩短、小花密度增加和节间数减少等不同突变性状。通过分子检测本研究发现26个突变体均携带与‘云麦53’不同的矮秆基因组合, 如mutant 11携带Rht5和Rht 12矮秆基因(可能还携带其他未被检测的矮秆基因), mutant 2携带Rht-D1b、Rht4、Rht5等9个矮秆基因。通过推广品种株高与穗长、小穗数和穗粒数的关联分析, 陈亮等[8-12]发现矮秆突变基因Rht-D1b、Rht8和Rht9可增加穗粒数; 王清海等[13-14]研究发现Rht8、Rht10、Rht12、Rht14、Rht16、Rht18等矮秆基因的效应不同,Rht10和Rht12的降秆效应大于Rht8的[3,5]; Baloch等[16]发现Rht14、Rht16和Rht18可增加穗长,Rht5可减少每穗小穗数。前人研究结果表明小麦矮秆基因对穗长、小穗数和穗粒数等性状可能具有多效性,但在不同遗传背景中矮秆基因的遗传效应不同。因此作者认为是矮秆基因与穗长、小穗密度和小花数等性状的突变基因及其组合不同导致了26个突变体的农艺性状差异。
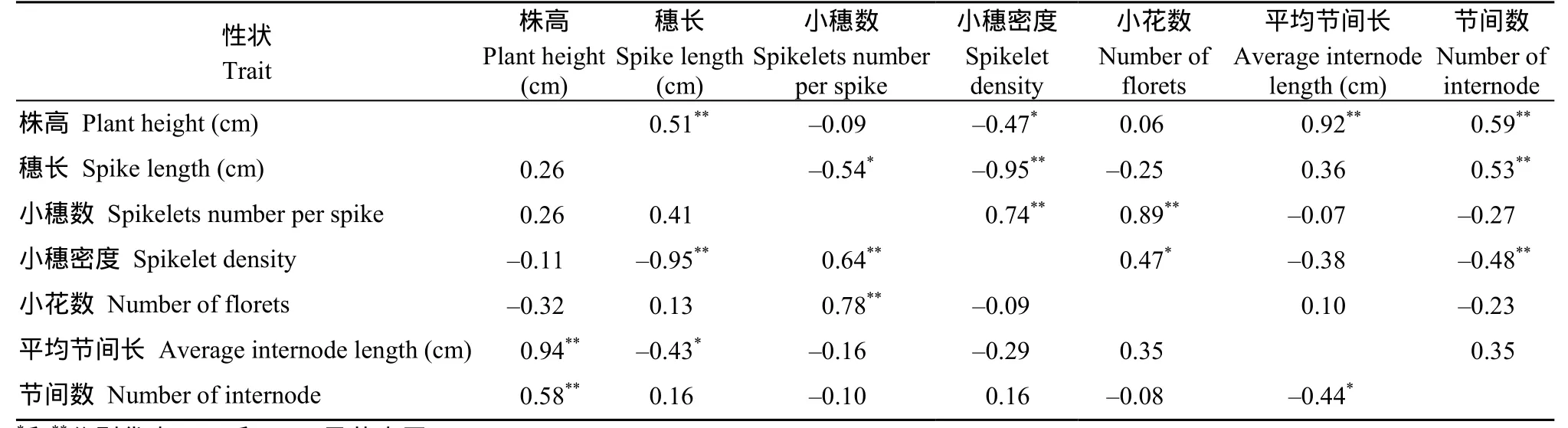
表4 不同突变性状的二元相关和偏相关系数及其显著性Table 4 Binary correlation, partial correlation coefficients and significances among the different mutant traits
本研究发现株高与平均节间长和节间数、以及穗长与小穗数、小穗数与小穗密度、小穗与小花数等性状关联遗传, 该结果与前人报道的基本一致[22-32]。虽然株高降低后mutant 7等 3个突变体的小穗数和小花数增多(均未达到显著水平), 其余突变体的穗长缩短、小穗数和小花数减少、小穗密度增加, 但株高与穗长等4个性状的偏相关系数均未达到显著水平。作者认为该结果可能与本文研究所用材料大多为相同亲本诱导的矮秆突变体有关, 可能是矮秆基因及其组合的多效性较低或者矮秆与其他性状的突变基因位点的连锁强度较低导致了株高与穗长、小穗数和小穗密度等性状不能关联遗传。通过进一步自交繁育,可望从26份矮秆突变体中筛选到适合不同育种需求的矮秆亲本。
通过聚类分析, 作者发现 26个矮秆突变体可分为农艺特性不同的5个亚类, 不同亚类间株高、穗长和小穗数等农艺性状存在差异, 其中第2亚类和第3亚类的mutant 5、mutant 23和mutant 25等5个突变体株高不到20 cm, 均低于陆燕等的报道[12,17,33-35]。虽然株高较低, 但mutant 11、mutant 27和mutant 28等突变体的穗长、小穗数和小花数没有变化, 且节间数只是导致部分突变体矮化的因素之一, 因此上述材料可用于小麦矮化育种。除此之外, 26个突变体携带的株高、穗长和小穗密度等突变性状基因及其组合类型不同, 如mutant 16携带株高较低(13.61 cm±0.11 cm),穗长(3.72 cm±0.02 cm)和平均节间长(4.88 cm±0.62 cm)较短, 小穗密度(5.37±0.24)较高的基因组合; mutant 18具有植株偏高(44.08 cm±1.73 cm), 穗长偏长(7.08 cm±0.48 cm)小花数较少(33.25±0.25)的基因组合。基于上述突变体, 可望解析小麦株高及其构成因素、小穗密度和小花数等性状的遗传机制。
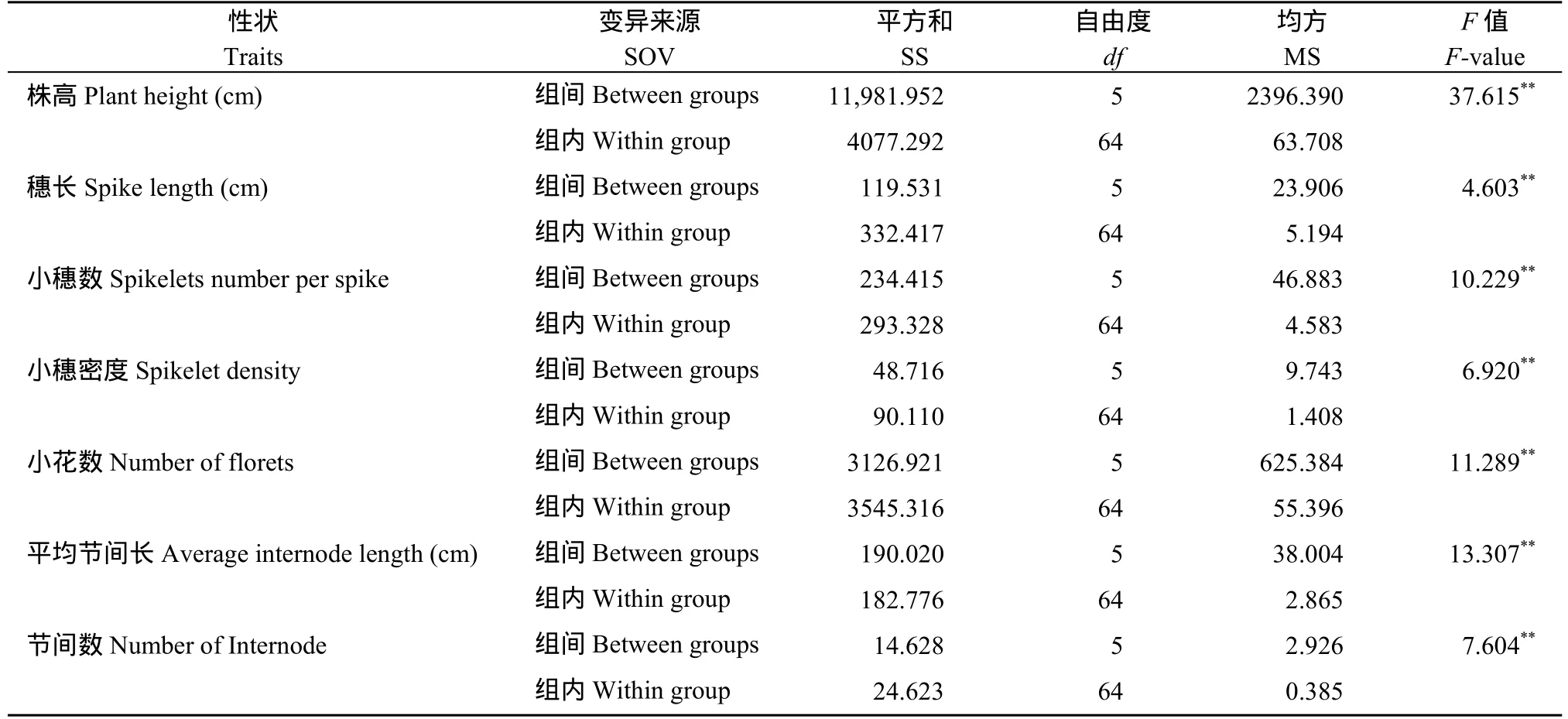
附表1 ‘云麦53’类群和5个矮秆突变体亚类的方差分析结果Table S1 ANOVA result of ‘Yunmai 53’ and 5 subclasses dwarf mutants
