藤黄属植物中二苯甲酮衍生物的研究进展
2021-03-17彭晓辉樊晓杰刘晓佳李达翃李占林华会明
彭晓辉,樊晓杰,刘晓佳,白 皎,李达翃,李占林,华会明
藤黄属植物中二苯甲酮衍生物的研究进展
彭晓辉,樊晓杰,刘晓佳,白 皎,李达翃,李占林,华会明*
沈阳药科大学,辽宁 沈阳 110000
天然的二苯甲酮衍生物主要来源于藤黄属植物,是藤黄属药用植物的主要有效成分之一,具有抗肿瘤、抗炎、抗病毒和抗氧化等生物活性。归纳总结了藤黄属植物中二苯甲酮衍生物的结构分类、生物合成途经、波谱特征及其提取分离方法,为藤黄属植物中二苯甲酮衍生物的深入研究与开发利用提供参考。
藤黄属;二苯甲酮衍生物;结构分类;生物合成途经;波谱特征;提取;分离
藤黄属Linn.植物是隶属于藤黄科的乔木或灌木,全球有450余种,主要分布于热带亚洲、澳大利亚东北部、热带非洲及非洲南部和热带美洲等地[1];在中国有22种,主要分布于云南和广西,其中的云南藤黄.H. H. Hu.、怒江藤黄.C. Y. Wu ex Y. H. Li.等14种藤黄属植物为中国特有种[2]。藤黄属植物的次级代谢产物主要为双苯吡酮、二苯甲酮衍生物、双黄酮和三萜等类型的化合物。其中,二苯甲酮衍生物是一类主要分布于藤黄属植物中的结构多样、具有广泛生物活性的天然产物。如在.Mart.的果实和叶中的7-表猪胶树酮对肺癌A549细胞[3]、恶性胶质瘤U251MG和U138MG细胞增殖具有抑制活性[4],以及一定的抗过敏活性[5],此外该化合物还具有显著的抗炎和镇痛活性[6]。在藤黄属植物中广泛存在的火叶藤黄醇具有显著抑制人白血病细胞增殖的活性[7]以及与万古霉素活性相近的抗耐甲氧西林金黄色葡萄球菌生长活性[8]。Jackson等[9]研究表明火叶藤黄醇可以有效地抑制真菌芽管的出现和生长,而且能够使氟康唑的半最大效应浓度(concentration for 50% of maximum effect,EC50)值从大于1024 μg/mL降至13 μg/mL。.、云树.Roxb.、.Roxb.、非洲山竹.T. Anderson、拇指藤黄.Pierre和金丝李.Chun et How中均有分布的藤黄酮K具有很强的抗人直肠癌HCT-116和HT-29细胞增殖的活性[10]。目前已从42种藤黄属植物中发现二苯甲酮类化合物(表1),且分布于植物的根、茎、叶、花序、果实等各个部位(表2)。复杂多样的结构和广泛的生物活性,使二苯甲酮衍生物受到了药理学、天然药物化学等相关领域学者的广泛关注。本文对从藤黄属植物中分离得到二苯甲酮衍生物的结构类型、生物合成途经、波谱特征和提取分离方法进行了归纳、总结,为其深入研究与开发利用提供参考。

表1 藤黄属植物的名称

表2 植物材料的部位
1 二苯甲酮衍生物的结构类型
二苯甲酮衍生物是由1个酮羰基与2个苯环相连,形成具有13个碳原子(C6-C1-C6)基本骨架的一类化合物。其中1个苯环(A环)结构相对保守,而另1个苯环(B环)则变化较大。根据B环是否具有完整的苯环结构,将二苯甲酮衍生物分为2大类:简单的二苯甲酮衍生物(simple benzophenone derivatives,SBDS或basic benzophenone skeletons,BBS)和多异戊烯基取代的二苯甲酮骨架化合物(polyprenylated benzophenones,PPBS)。
SBDS中2个苯环均保持完整,苯环上可连有羟基、异戊烯基等,也可以成环。PPBS常具有异戊烯基、香叶基、羟基、甲氧基等取代基团,这些基团可以进一步发生加成、环合等反应而形成复杂的多元环结构。PPBS的B环因与之相连的多异戊烯基、香叶基等取代基发生环化反应,形成[3.3.1]壬烷-2,4,9-三酮结构,该结构与苯甲酰基相连,构成了PPBS的基本骨架。关于该基本骨架的编号,通常的标记方法是将B环上与异丙基或取代异丙基相连的桥头碳原子标记为C-1,然后将[3.3.1]壬烷- 2,4,9-三酮中的八元环依次标记为C-1~C-8;将B环中剩余的羰基碳标记为C-9,将连接A、B两环的羰基碳标记为C-10;最后,将A环中的碳原子按相关的顺序规则标记为C-11~C-16[11]。根据PPBS基本骨架中的苯甲酰基与[3.3.1]壬烷-2,4,9-三酮的连接位置不同,将PPBS分为A、B、C型3类,即苯甲酰基与C-1相连的为A型PPBS,与C-3相连的为B型PPBS,与C-5相连的为C型PPBS。此外,将B环上没有形成[3.3.1]壬烷-2,4,9-三酮结构或不能归属为A、B、C型的二苯甲酮衍生物归属为D型PPBS[12]。二苯甲酮衍生物存在酮-烯醇式互变,各种类型二苯甲酮衍生物的基本骨架见图1。
1.1 SBDS
SBDS的A环多为无取代、单取代、双取代苯。取代基多为羟基、甲氧基。B环较A环复杂,常为三取代和四取代,取代基包括羟基、甲氧基、异戊烯基和香叶基及其衍生物等(图2)。异戊烯基可进一步与邻位羟基环合形成吡喃环。从藤黄属植物中发现的SBDS(1~31)见表3,结构见图3。

图1 二苯甲酮衍生物的基本骨架
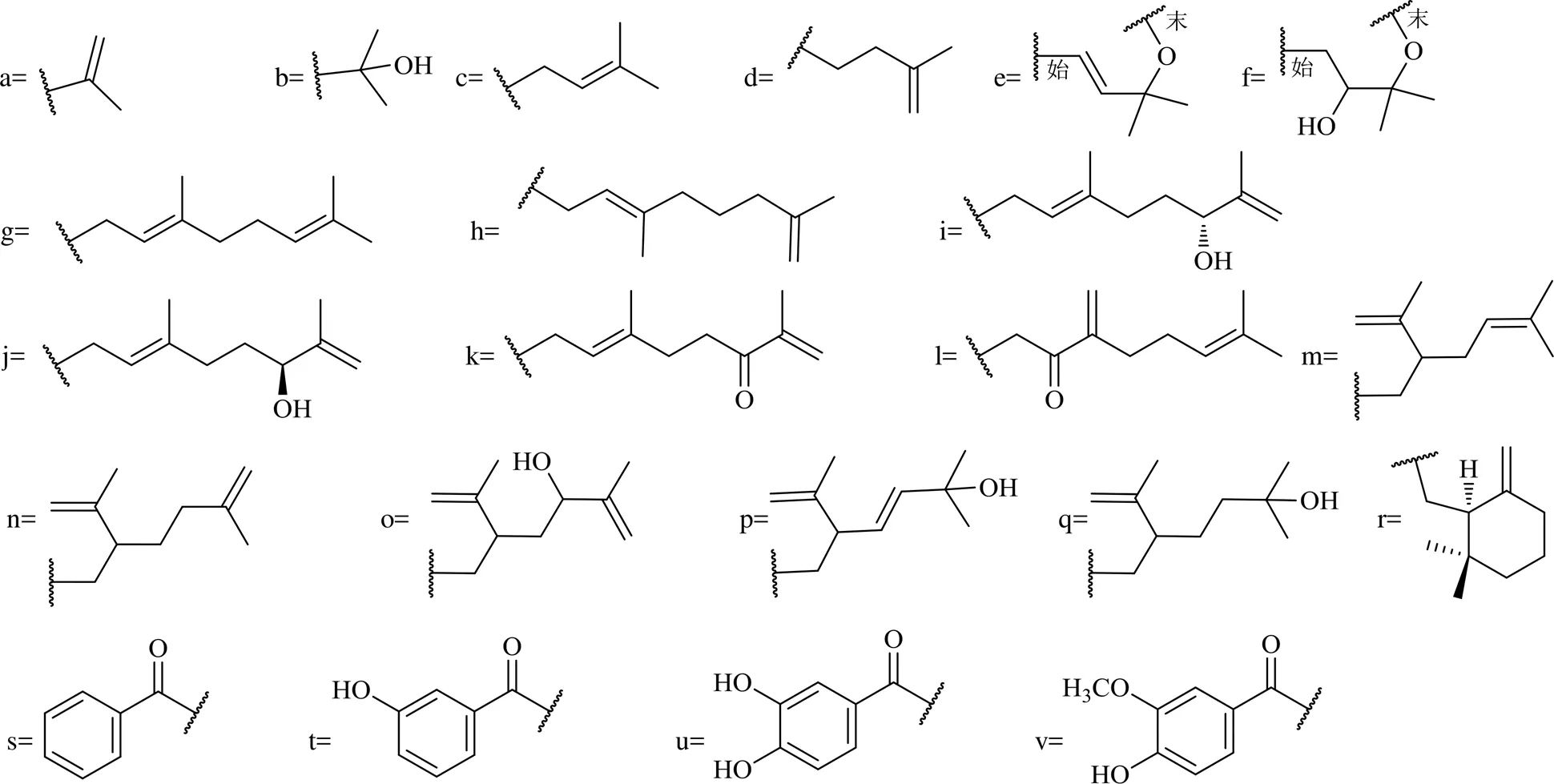
图2 藤黄属植物中二苯甲酮类化合物的取代基
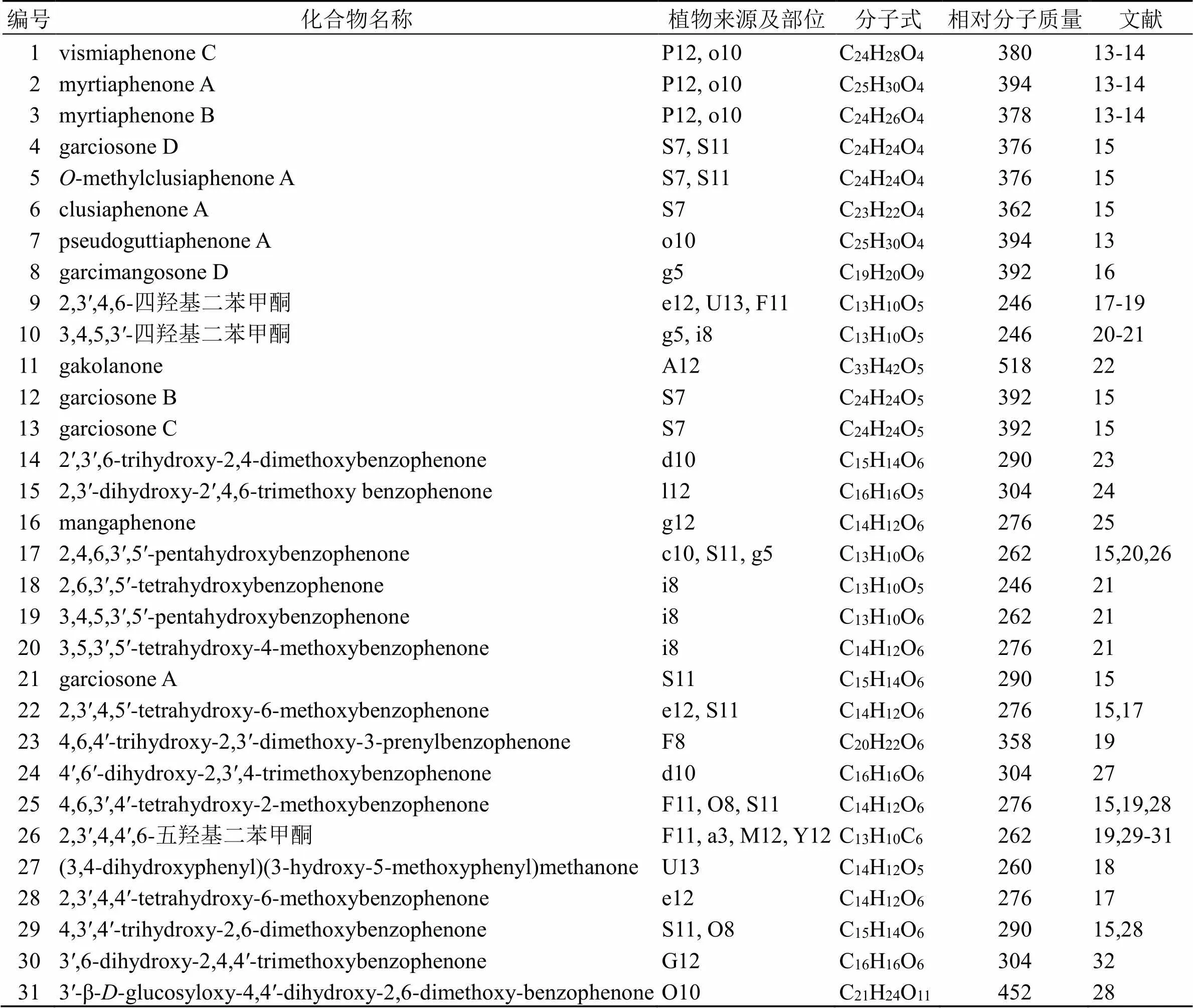
表3 藤黄属植物中的简单的二苯甲酮衍生物

图3 藤黄属植物中SBDS的结构
1.2 A型PPBS
已报道的藤黄属中的A型PPBS的A环取代较简单,多为无取代或3,4-二羟基取代。B环结构复杂,取代基多为香叶草基和异戊烯基,且多发生环化反应,形成双环、三环甚至四环系统,部分化合物还形成笼状结构,如化合物41、42。从藤黄属植物中发现的A型PPBS(32~47)见表4,结构见图4。

表4 藤黄属植物中的A型PPBS
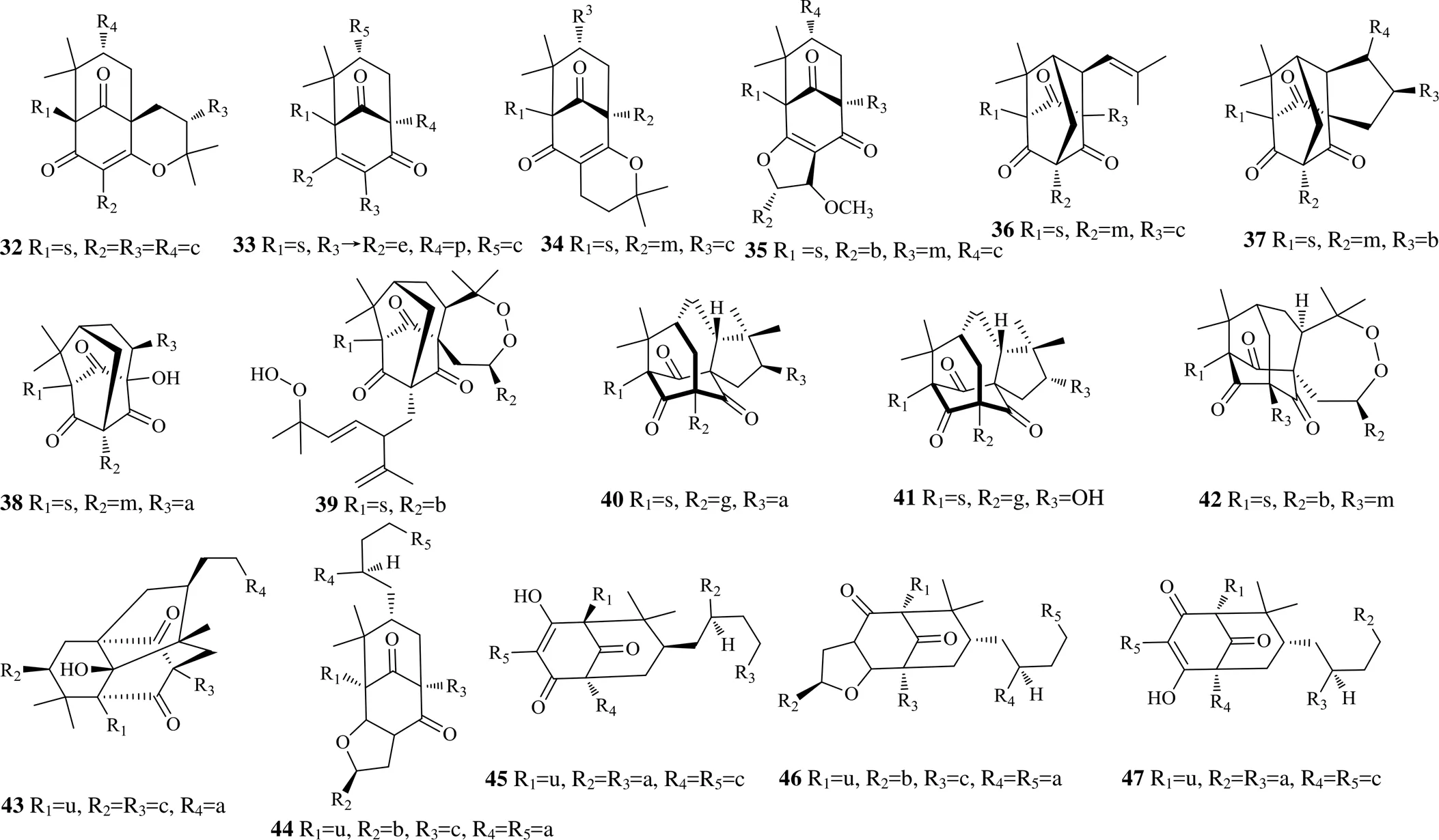
图4 藤黄属植物中的A型PPBS
1.3 B型PPBS
B型PPBS的数量最多,结构复杂、多样。A环主要有4种取代模式:苯甲酰基、3,4-二羟基苯甲酰基、3-羟基苯甲酰基和4-羟基-3-甲氧基苯甲酰基。除了常见的羟基、甲氧基等基团外,香叶草基和异戊烯基及其衍生物在该类化合物中也是广泛存在的。这些取代基可进一步发生环化反应,形成四环、五环和多环体系;香叶草基上的烯基常发生羟基化反应,形成连羟基的手性中心。从藤黄属植物中发现的B型PPBS(48~114)见表5,结构见图5。

表5 藤黄属植物中的B型PPBS

续表5
图5 藤黄属植物中的B型PPBS
Fig. 5 Structures of type-B PPBS in Garcinia
1.4 C型PPBS
藤黄属中的C型PPBS很少见,事实上,与其他几类二苯甲酮衍生物相比,在自然界中发现的C型PPBS也是非常少的。这主要是由于在生物合成C型PPBS的过程中,对于中间体结构的要求较其他类型的二苯甲酮衍生物更为苛刻。这类化合物的结构特点是A环形成3,4-二羟基苯甲酮基,而B环则形成金刚烷基。从藤黄属植物中发现的C型PPBS(115~121)见表6,结构见图6。
1.5 D型PPBS
D型PPBS的结构复杂、多样。藤黄属中发现的D型PPBS具有以下结构特点:(1)A、B 2环由酯键相连(A环与酯羰基相连);(2)[3.3.1]壬烷- 2,4,9-三酮结构扩环,形成[3.3.2]癸烷结构(如gambogenone,122)或[4.3.1]癸烷结构(如xerophenone C,131)的二苯甲酮衍生物;(3)由SBDS与呫吨酮聚合形成的二聚体;(4)在A、B 2环上的2对相邻碳原子分别与羰基和碳原子(或氧原子)相连,形成闭合的环(如garcixanthochymone D,137)。从藤黄属植物中发现的D型PPBS(122~142)见表7,结构见图7。
2 生物合成途经
天然的二苯甲酮衍生物经醋酸-丙二酸-莽草酸途经合成,二苯甲酮合成酶(benzophenone synthase,BPS)是其合成的限速酶[97]。二苯甲酮衍生物基本母核的生物合成途径见图8[12,34]。PPBS在其生物合成过程中常发生Diels-Alder反应、异戊烯基化反应、自由基环化反应、氧化反应等形成复杂的多环结构。虽然缺乏实验研究以阐述其具体的生物合成途经,但是一些学者针对分离得到的化合物结构,提出了一些相关生物合成途经的合理假设[27,43,56,91]。当一个化合物的结构不能用现有的生物合成理论得到合理解释时,该化合物常被怀疑可能为人工产物,这时需要采用一些方法(如LC-MS法)进行验证。Zhang等[47]从岭南山竹子的叶子中分离得到了oblongifolins J(115)和oblongifolins K(116),但是由于这2个化合物中均含有1个丙酮基(这一基团在二苯甲酮衍生物中十分罕见),而且在实验过程中使用过丙酮,因此怀疑该化合物为人工产物。通过对另一批岭南山竹子叶子使用石油醚提取,并在接下来的分离、分析过程中避免使用丙酮,采用LC-MS分析,成功地鉴定岭南山竹子叶子的石油醚提取物中存在这2个化合物,从而证明它们是天然产物。
3 波谱特征
3.1 质谱
具有3,4-二羟基苯甲酰基的二苯甲酮衍生物通常会发生α裂解,形成/137 [C7H5O3]−的碎片离子;具有苯甲酰基的二苯甲酮衍生物则常常会生成/105 [C7H5O]2+的碎片离子[13]。这2种碎片离子会进一步发生诱导裂解,生成/109 [C6H5O2]−和/77 [C6H5]+的脱羰基碎片[28]。由于二苯甲酮衍生物中多含有异戊烯基,因此在质谱信号中会出现/相差68 [C5H8]的2个信号[36],也可能会出现/69 [C5H9]+的碎片离子峰[57]。二苯甲酮衍生物母核中具有羰基,当其同时具有γ-H时,可能会产生麦氏重排[86]。

表6 藤黄属植物中的C型PPBS
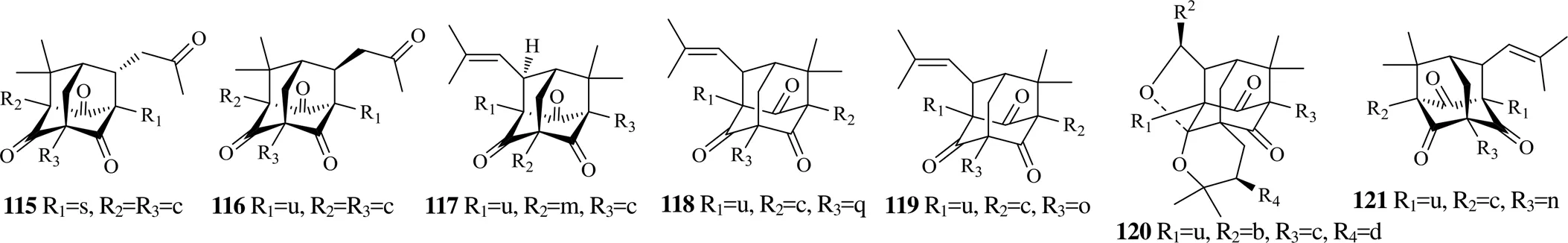
图6 藤黄属植物中C型PPBS的结构

表7 藤黄属植物中的D型PPBS

图7 藤黄属植物中D型PPBS的结构
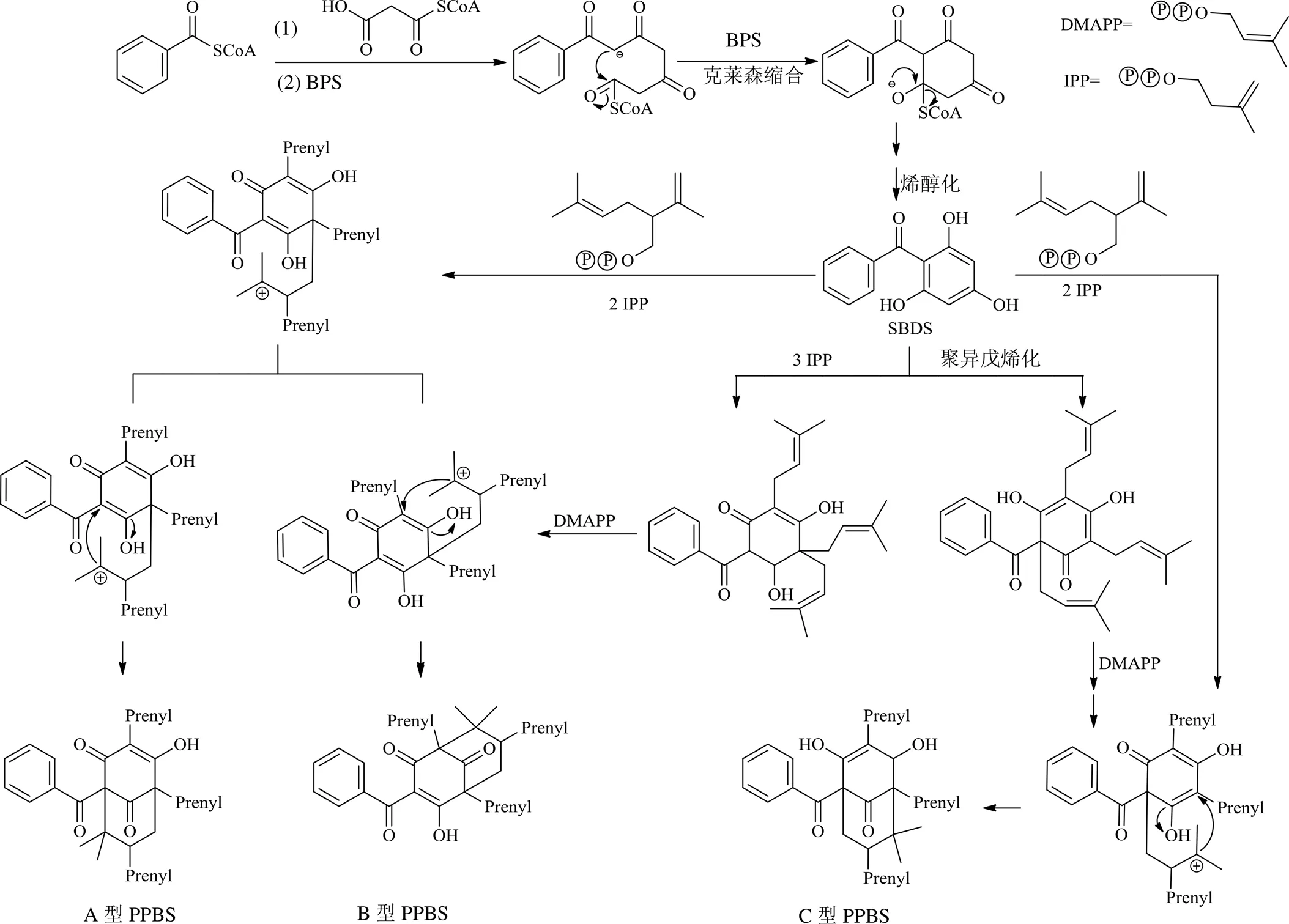
图8 二苯甲酮衍生物的生物合成途经
3.2 核磁共振谱
二苯甲酮衍生物常含有异戊烯基,该基团的2个甲基氢的H均在1.55~1.75,可以根据氢谱高场区的甲基信号数目,大致推测化合物中的异戊烯基数目;甲基碳的C分别为17.5~18.5、25.5~26.5;2个烯碳原子的C常在132~136、119~126。当异戊烯基与邻位羟基环合成吡喃环时,存在顺式偶合的2个烯氢双峰的H6.4~6.5、5.2~5.4,二者的偶合常数约为10 Hz。对于PPBS而言,C-9位非共轭羰基的碳信号通常在C207~210[98];C-8的碳信号通常在C46~53,但当C-8参与构成金刚烷基时,其碳信号将向低场位移,甚至达到C58.9(如化合物37)。
PPBS中的β-羟基-α,β-不饱和酮存在酮-烯醇式互变,直接测试得到的氢谱和碳谱往往信号重叠严重,十分复杂。为了简化图谱,通常使用CD3OD- 0.1%三氟乙酸为测试溶剂,以加快酮-烯醇式互变的速率,通常得到2-酮基-4-羟基异构体的图谱(可能是由于4位羟基与10位羰基形成分子内氢键的缘故)。不过也有得到2-羟基-4-酮基异构体的报道[32,54,61,68]。如Gustafson等[69]在测试化合物86的氢谱和碳谱时发现,在以CDCl3为溶剂时,得到2种互变异构体以3∶1的比例存在的复杂图谱;当将溶剂改为CD3OD-0.1% TFA时,则得到了2-酮基-4-羟基异构体的图谱数据。此外,有些化合物(如化合物73)的氢谱和碳谱测试时,以C5D5N为溶剂可以简化图谱[58]。
酮-烯醇式互变使得PPBS中C-2与C-4的化学位移值大致相等,均位于C194附近,而C-3的化学位移值则约为C119。当在C-2或C-4上形成烯醚时,该碳原子的信号向高场位移至C172附近。以化合物109[5]和化合物95[11]为例,二者结构的主要差别在于化合物109在C-4位形成烯醚,而化合物95在C-4位则为烯醇基。在化合物95中C-2、C-4与C-3的C分别为193.8、195.3、116.4;而在化合物109中,C-4由于形成烯醚,其化学位移值向高场位移至C171.5,C-2、C-3的C值分别为194.8、123.8。在确定烯醇化的1,3-二酮中的羰基在C-2与C-4的相对位置时,Zhang等[37]总结出了一条经验性规律,对于A型PPBS而言,当C-1与C-5的化学位移值相差约21时,羰基位于C-2,烯醇基位于C-4;当2者的化学位移值相差约7时,羰基位于C-4,烯醇基位于C-2。
PPBS由于含有多个手性中心,常常需要综合运用多种方法确定其立体构型。对于相对构型的确定可根据特定氢和/或碳的化学位移,以及偶合常数来判断。
大部分PPBS的基本母核中具有成桥的双环系统,这决定了其C-1和C-5位上的氢和侧链位于e键[32,46,52,57,61]。
绝大多数PPBS的C-7为手性碳,关于确定C-7构型的文献报道很多,确定其主要有以下3种方法。(1)根据C-7的化学位移值:当C41.0~44.0时,H-7位于a键;当C46.0~48.0时,H-7位于e键[43,56,99]。(2)根据H-6与H-7的偶合常数:由于磁各向异性,2个H-6的化学位移值通常是H-6ax的化学位移值较小。当H-6ax与H-7的偶合常数大于9 Hz(通常为10~13 Hz)时,H-6ax与H-7处于反式双直立的位置,因而可以推断H-7处于a键上;当H-6ax与H-7的偶合常数不超过8 Hz(通常为7~8 Hz)时,H-7处于e键上。在典型的环己烷衍生物中,以椅式为优势构象,邻位偶合常数aa多在10~12 Hz,ae≈ee多在2~5 Hz。可见,当H-7处于a键上时,H-7与H-6ax的偶合常数与典型环己烷衍生物的数值相近;而当H-7处于e键上时,两者则相差较大。这主要是由于C-7构型不同时,PPBS基本骨架中的双环系统的优势构象不同,如化合物77(H-7处于a键)的优势构象为椅式,而化合物86(H-7处于e键)的优势构象则由椅式和扭船式共同构成[67]。(3)根据C-8上角甲基的化学位移值:当C-8上处于a键和e键上角甲基的C26~28、22~25时,提示C-7上的侧链处于a键;当C-8上处于a键和e键上角甲基的C15~17、22~24时,提示C-7上的侧链处于e键。这主要是由于当C-7上的侧链处于e键时,该取代基与C-8上处于a键的甲基在空间上非常接近,产生了γ-效应[98-99]。
对于C-6为亚甲基,C-7位的侧链是异戊烯基,C-8上连有2个角甲基的A型和C型PPBS而言,当含有C-6的饱和环为椅式构象、C-7位的异戊烯基为exo型时,C-6上2个氢的化学位移值之差大约为0.5,C-8上2个角甲基的碳化学位移相差约为7.7,C-7的C43;当含有C-6的饱和环为椅式构象、C-7位的异戊烯基为endo型时,C-6上的2个氢的化学位移值相差大约为0.2,C-8上2个角甲基的碳化学位移相差约为4.0,C-7的C48[37]。
通常采用计算电子圆二色谱(electrostatic circular dichroism,ECD)法确定PPBS的绝对构型,将实测的ECD谱与在相应水平下计算得到的ECD谱对比,当两者在相应波长下的Cotton效应一致时,可认为样品分子的立体构型与分子模型的立体构型相同[51,92]。此外,对于存在手性仲醇碳的二苯甲酮衍生物,也有采用莫舍酯法确定二苯甲酮衍生物碳绝对构型的[47,51]。
4 提取分离
藤黄属植物二苯甲酮衍生物的提取分离常采用的方法是:(1)主要采用浸渍法和回流法提取,用丙酮[37,48,63,75]、甲醇[23]、乙醇[37,90]、二氯甲烷[38]、氯仿[38]、醋酸乙酯[61]等为提取溶剂。有时在提取之前还需要用小极性溶剂(如正己烷)脱脂[25]。(2)有液液萃取和固相萃取2种方法对提取物进行粗分。萃取通常是用水悬浮提取物后,依次使用石油醚、二氯甲烷、醋酸乙酯和正丁醇等溶剂萃取。根据具体的实验需要,可以灵活地采用适当数量与种类的有机溶剂萃取。如Gao等[48]则直接用二氯甲烷萃取。对于难以水混悬,或容易发生乳化现象的样品,则可以考虑使用固相萃取或硅胶柱色谱等方法对提取物进行粗分。如Minami等[23]将样品用硅藻土拌样后,依次使用正己烷、二氯甲烷、醋酸乙酯和甲醇洗脱;Zhang等[37]将样品用硅胶拌样后,用三氯甲烷-甲醇-丙酮三元溶剂系统梯度洗脱。(3)样品经过上述处理后,综合运用硅胶柱色谱、葡聚糖凝胶色谱、制备型高效液相色谱等色谱技术,实现样品的分离纯化。
活性导向和结构导向的分离策略也应用于二苯甲酮衍生物的研究。活性导向分离有利于快速、有针对性地获得活性化合物,因此广泛应用于二苯甲酮类化合物的分离[21,58-59]。Liu等[50]将多花山竹子枝的丙酮提取物用D101型大孔树脂以60%和95%的乙醇分别洗脱,得到的95%乙醇洗脱部位,再用硅胶柱色谱粗分,得到组分A~I。分别测定这些组分对宫颈癌HeLa-C3细胞(经过基因工程处理,能够用于检测涉及半胱氨酸蛋白酶-3激活的细胞凋亡)的促细胞凋亡活性后发现组分D、E、G的活性最强。进一步应用多种色谱技术从这3个组分中分离得到了化合物72、94、96、97、107等,均对HeLa-C3细胞具有诱导细胞凋亡活性的化合物。Williams等[58]依次对长柱藤黄茎的醋酸乙酯和甲醇提取物进行细胞毒活性筛选,对活性较强的醋酸乙酯提取物进一步的活性跟踪分离,最终得到了2个对人卵巢癌A2780细胞具有细胞毒活性的化合物73、84。
但是,在实际工作中,往往由于活性物质含量过低,难以实现有效分离,或活性物质性质不稳定在实验过程中发生变化,或由于相关成分在发挥生物活性时存在协同作用等原因,活性导向分离常常会导致活性降低甚至丧失,而得不到活性强的化合物。如Williams等[58]在对.的果皮进行研究时发现,己烷粗提物的抗利什曼原虫活性高于从中分离得到的9个成分的生物活性之和,提示活性成分可能存在协同作用。
结构导向分离是根据某类化合物的结构特征与波谱特征,利用HPLC-DAD、LC-MS/MS或UPLC- QTOF/MSE等技术定向获取某类化合物,甚至是新化合物的一种研究策略。Li等[92]对金丝李种子的乙醇提取物用石油醚脱脂后,用硅胶色谱柱将其分为9个流分,然后利用UPLC-QTOF/MSE技术在“MS全扫描”和“MSE实验”2个模式下,对每个流分进行分析。根据分子式、诊断离子(/177.02)以及藤黄属植物中化学成分数据对比后,发现源自这9个流分中的31个色谱峰可能是二苯甲酮衍生物,其中19个色谱峰为已知的二苯甲酮衍生物,而另外12个色谱峰则由于在MSE谱中观测到异戊烯基、苯环的丢失的碎片离子以及/177.018 8(C9H5O4)的诊断离子峰,提示其中很有可能含有二苯甲酮衍生物。对这12个色谱峰进行跟踪分离,得到了5个新的二苯甲酮衍生物(125~128、136)。可见,结构导向分离的优势在于“去重复化”,有利于获得新化合物。但遗憾的是,这5个化合物对人乳腺癌MDA-MB-231、SKBR3、MCF-7细胞均不具有细胞毒活性。
活性导向分离与结构导向分离各有所长,综合运用2种研究策略,可以优势互补,得到更好的实验结果。如Xu等[60]测试了云南藤黄的枝、叶和果实粗提物的抗HeLa-C3细胞活性,发现果实的丙酮粗提物活性最好,然后进一步对果皮和种子的粗提物做活性筛选,发现果皮的丙酮提取物活性最好,由此确定以果皮为实验材料。用硅胶柱色谱分离果皮的丙酮提取物,依次以三氯甲烷、醋酸乙酯和丙酮为洗脱剂,活性测定后发现三氯甲烷洗脱物的活性最好。然后利用UPLC/PDA/MS分析三氯甲烷洗脱物,并与该团队以前从该属植物中分离得到的二苯甲酮类和双苯吡酮类化合物的相关数据(保留时间、紫外光谱和质谱)对比,初步判断三氯甲烷洗脱物中含有4个已知的化合物和3个可能是二苯甲酮类或双苯吡酮类的“未知”化合物。通过活性跟踪对三氯甲烷洗脱物展开了分离和纯化,只分离活性较好的部位,最终得到了1个具有抗HeLa-C3细胞活性的新的二苯甲酮衍生物(70)。
5 结语
天然的二苯甲酮衍生物由于其独特的结构以及广泛的生物活性,尤其具有显著的抗肿瘤[31]和抑菌杀菌[8-9]活性,受到广泛关注,具有广阔的开发应用前景。藤黄属植物是天然二苯甲酮衍生物的主要来源之一,有必要对该属植物展开深入研究[100],通过活性导向分离快速寻找活性成分,采用结构导向分离定向获取该类化合物,从而高效发现更多结构新颖、有活性的化合物,为藤黄属植物资源的开发利用以及天然二苯甲酮衍生物的新药研发奠定科学基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 马婷, 司马永康, 马惠芬, 等. 云南省藤黄属植物的地理分布及其区系特征 [J]. 云南大学学报: 自然科学版, 2013, 35(1): 99-107.
[2] 李西林, 张红梅, 谭红胜, 等. 中国藤黄属植物的资源分布、分类与可持续利用 [J]. 世界中医药, 2016, 11(7): 1176-1179.
[3] Ionta M, Silva G A F, Niero E L,. 7-Epiclusianone, a benzophenone extracted from(Clusiaceae), induces cell cycle arrest in G1/S transition in A549 cells [J]., 2015, 20(7): 12804-12816.
[4] Sales L, Pezuk J A, Borges K S,. Anticancer activity of 7-epiclusianone, a benzophenone from, in glioblastoma [J]., 2015, 15(1): 393-400.
[5] Neves J S, Coelho L P, Cordeiro R S B,. Antianaphylactic properties of 7-epiclusianone, a tetraprenylated benzophenone isolated from[J]., 2007, 73(7): 644-649.
[6] Cecilia F V S, Freitas L A S, Vilela F C,. Antinociceptive and anti-inflammatory properties of 7-epiclusianone, a prenylated benzophenone from[J]., 2011, 670: 280-285.
[7] Matsumoto K, Akao Y, Kobayashi E,. Cytotoxic benzophenone derivatives fromspecies display a strong apoptosis-inducing effect against human leukemia cell lines [J]., 2003, 26(4): 569-571.
[8] Iinuma M, Tosa H, Tanaka T,. Antibacterial activity of somebenzophenone derivatives against methicillin-resistant[J]., 1996, 19(2): 311-314.
[9] Jackson D N, Yang L, Wu S,.benzophenones promote hyphal apoptosis and potentiate activity of fluconazole againstbiofilms [J]., 2015, 59(10): 6032-6038.
[10] Yang H, Figueroa M, To S,. Benzophenones and biflavonoids fromfruits [J]., 2010, 58: 4749-4755.
[11] 范翊民. 多花山竹子中PPBS类成分的分离与新型Wnt信号通路激活剂莪术醇的结构优化 [D]. 贵阳: 贵州大学, 2016.
[12] Wu S B, Long C, Kennelly E J. Structural diversity and bioactivities of natural benzophenones [J]., 2014, 31(9): 1158-1174.
[13] Ali S, Goundar R, Sotheeswaran S,. Benzophenones of(Clusiaceae) [J]., 2000, 53(2): 281-284.
[14] Spino C, Lal J, Sotheeswaran S,. Three prenylated phenolic benzophenones from[J]., 1995, 38(1): 233-236.
[15] Pailee P, Kuhakarn C, Sangsuwan C,. Anti-HIV and cytotoxic biphenyls, benzophenones and xanthones from stems, leaves and twigs of[J]., 2018, 147: 68-79.
[16] Huang Y L, Chen C C, Chen Y J,. Three xanthones and a benzophenone from[J]., 2001, 67(7): 903-906.
[17] Jamila N, Khairuddean M, Yaacob N S,. Cytotoxic benzophenone and triterpene from[J]., 2014, 54: 60-67.
[18] Mian J V Y, Lian E G C, Aspollah S M,. Benzophenone constituents from the roots of[J]., 2012, 16(1): 36-39.
[19] Chiang Y M, Kuo Y H, Oota S,. Xanthones and benzophenones from the stems of[J]., 2003, 66(8): 1070-1073.
[20] Jiang H Z, Quan X F, Tian W X,. Fatty acid synthase inhibitors of phenolic constituents isolated from[J]., 2010, 20: 6045-6047.
[21] Jantan I, Saputri F C. Benzophenones and xanthones fromvar.and their inhibitory activities on human low-density lipoprotein oxidation and platelet aggregation [J]., 2012, 80: 58-63.
[22] Akoro S M, Aiyelaagbe O O, Onocha P A,. Gakolanone: A new benzophenone derivative fromHeckel stem-bark [J]., 2018, 34(2): 241-250.
[23] Minami H, Hamaguchi K, Kubo M,. A benzophenone and a xanthone from[J]., 1998, 49(6): 1783-1785.
[24] Fouotsa H, Lannang A M, Dzoyem J P,. Antibacterial and antioxidant xanthones and benzophenone from[J]., 2015, 81(7): 594-599.
[25] See I, Ee G C L, Teh S S,. Two new chemical constituents from the stem bark of[J]., 2014, 19(6): 7308-7316.
[26] Rao A V R, M R Sarma, K Venkataraman,. A benzophenone and xanthone with unusual hydroxylation patterns from the heartwood of[J]., 1974, 13(7): 1241-1244.
[27] Minami H, Kinoshita M, Fukuyama Y,. Antioxidant xanthones from[J]., 1994, 36(2): 501-506.
[28] Muriithi E, Gomotsang B M, Majinda R R T. Benzophenonederivatives fromand their antioxidant activities [J]., 2016, 18: 29-34.
[29] Karanjgoakar C G, Rao A V R, Venkataraman K,. The constitution of xanthochymol and isoxanthochymol [J]., 1973, 14(50): 4977-4980.
[30] Han Q B, Tian H L, Yang N Y,. Polyprenylated xanthones fromshowing apoptotic effects against HeLa-C3 cells [J]., 2010, 5(12): 2710-2717.
[31] Ito C, Itoigawa M, Miyamoto Y,. Polyprenylated benzophenones fromand their potential cancer chemopreventive activities [J]., 2003, 66(2): 206-209.
[32] Nilar Nguyen L H D, Venkatraman G, Sim K Y,. Xanthones and benzophenones fromand[J]., 2005, 66(14): 1718-1723.
[33] Chen J J, Ting C W, Hwang T L,. Benzophenone derivatives from the fruits ofand their anti-inflammatory activity [J]., 2009, 72(2): 253-258.
[34] Wang Z Q, Li X Y, Hu D B,. Cytotoxic garcimultiflorones K-Q, lavandulyl benzophenones frombranches [J]., 2018, 152: 82-90.
[35] Sriyatep T, Maneerat W, Sripisut T,. Cowabenzophenones A and B, two new tetracyclo [7.3. 3.33,11.03,7] tetradecane-2,12,14-trione derivatives, from ripe fruits of[J]., 2014, 92: 285-289.
[36] Ting C W, Hwang T L, Chen I S,. Garcimultiflorone G, a novel benzoylphloroglucinol derivative fromwith inhibitory activity on neutrophil pro-inflammatory responses [J]., 2014, 11(5): 819-824.
[37] Zhang L J, Chiou C T, Cheng J J,. Cytotoxic polyisoprenyl benzophenonoids from[J]., 2010, 73(4): 557-562.
[38] Wu C C, Lu Y H, Wei B L,. Phloroglucinols with prooxidant activity from[J]., 2008, 71(2): 246-250.
[39] Wu C C, Weng J R, Won S J,. Constituents of the pericarp of[J]., 2005, 68(7): 1125-1127.
[40] Baggett S, Protiva P, Mazzola E P,. Bioactive benzophenones fromfruits [J]., 2005, 68(3): 354-360.
[41] Youn U J, Sripisut T, Miklossy G,. Bioactive polyprenylated benzophenone derivatives from the fruits extracts of[J]., 2017, 27: 3760-3765.
[42] Lyles J T, Negrin A, Khan S I,.antiplasmodial activity of benzophenones and xanthones from edible fruits ofspecies [J]., 2014, 80: 676-681.
[43] Xia Z X, Zhang D D, Liang S,. Bioassay-guided isolation of prenylated xanthones and polycyclic acylphloroglucinols from the leaves of[J]., 2012, 75: 1459-1464.
[44] Kaur R, Chattopadhyay S K, Tandon S,. Large scale extraction of the fruits offor the isolation of new and known polyisoprenylated benzophenone derivatives [J]., 2012, 37(1): 420-426.
[45] Krishnamurthy N, Lewis Y S, Ravindranath B. On the structures of garcinol, isogarcinol and camboginol [J]., 1981, 22(8): 793-796.
[46] Ngameni B, Fotso G W, Ngachussi E,. Hemisynthesis and spectroscopic characterization of two novel-allylated benzophenones fromOliv. (Clusiaceae) [J]., 2014, 26(20): 6943- 6949.
[47] Zhang H, Tao L, Fu W W,. Prenylated benzoylphloroglucinols and xanthones from the leaves ofwith antienteroviral activity [J]., 2014, 77(4): 1037-1046.
[48] Gao X M, Yu T, Lai F S F,. Novel polyisoprenylated benzophenone derivatives from[J]., 2010, 51(18): 2442-2446.
[49] Nguyen H D, Trinh B T D, Nguyen L H D. Guttiferones Q-S, cytotoxic polyisoprenylated benzophenones from the pericarp of[J]., 2011, 4(2): 129-133.
[50] Liu X, Yu T, Gao X M,. Apoptotic effects of polyprenylated benzoylphloroglucinol derivatives from the twigs of[J]., 2010, 73(8): 1355-1359.
[51] Zhang H, Zhang D D, Lao Y Z,. Correction to cytotoxicand anti-inflammatory prenylated benzoylphloroglucinols and xanthones from the twigs of[J]., 2014, 77(77): 1700-1707.
[52] Trisuwan K, Ritthiwigrom T. Benzophenone and xanthone derivatives from the inflorescences of[J]., 2012, 35(10): 1733-1738.
[53] Masullo M, Bassarello C, Suzuki H,. Polyisoprenylated benzophenones and an unusual polyisoprenylated tetracyclic xanthone from the fruits of[J]., 2008, 56(13): 5205-5210.
[54] Merza J, Mallet S, Litaudon M,. New cytotoxic guttiferone analogues fromfrom New Caledonia [J]., 2006, 72(1): 87-89.
[55] Feng C, Huang S X, Gao X M,. Characterization of proapoptotic compounds from the bark of[J]., 2014, 77(5): 1111-1116.
[56] Xu G, Kan W L T, Zhou Y,. Cytotoxic acylphloroglucinol derivatives from the twigs of[J]., 2010, 73(2): 104-108.
[57] Rubio O C, Padron A, Castro H V,. Aristophenones A and B. A new tautomeric pair of polyisoprenylated benzophenones from[J]., 2001, 64: 973-975.
[58] Williams R B, Hoch J, Glass T E,. A novel cytotoxic guttiferone analogue from the Suriname Rainforest [J]., 2003, 69: 864-866.
[59] Huang S X, Feng C, Zhou Y,. Bioassay-guided isolation of xanthones and polycyclic prenylated acylphloroglucinols from[J]., 2009, 72(1): 130-135.
[60] Xu G, Feng C, Zhou Y,. Bioassay and ultraperformance liquid chromatography/mass spectrometry guided isolation of apoptosis-inducing benzophenones and xanthone from the pericarp ofHu [J]., 2008, 56(23): 11144-11150.
[61] Hamed W, Brajeul S, Betzer F M,. Oblongifolins A-D, polyprenylated benzoylphloroglucinol derivatives from[J]., 2006, 69(5): 774-777.
[62] Boonyong C, Pattamadilok C, Suttisri R,. Benzophenones and xanthone derivatives frominduce P-glycoprotein overexpression in human colorectal Caco-2 cells via oxidative stress-mediated mechanisms [J]., 2017, 27: 8-14.
[63] Gao X M, Yu T, Lai F S F,. Identification and evaluation of apoptotic compounds from[J]., 2010, 18(14): 4957- 4964.
[64] 沈杰, 杨峻山. 云南山竹子中的一个新奇的苯甲酮类化合物 [J]. 化学学报, 2007, 65(16): 1675-1678.
[65] Masullo M, Menegazzi M, Micco S D,. Direct interaction of garcinol and related polyisoprenylated benzophenones offruits with the transcription factor STAT-1 as a likely mechanism of their inhibitory effect on cytokine signaling pathways [J]., 2014, 77(3): 543-549.
[66] Pereira I O, Marques M J, Pavan A L R,. Leishmanicidal activity of benzophenones and extracts fromMart. fruits [J]., 2010, 17: 339-345.
[67] Naldoni F J, Claudino A L R, J W Cruz J,. Antimicrobial activity of benzophenones and extracts from the fruits of[J]., 2009, 12(2): 403-407.
[68] Magadula J J, Kapingu M C, Bezabih M,. Polyisoprenylated benzophenones from(Clusiaceae) [J]., 2008, 1(4): 215-218.
[69] Gustafson K R, Blunt J W, Munro M H G,. The guttiferones, HIV-inhibitory benzophenones from,,and[J]., 1992, 48(46): 10093- 10102.
[70] Terrazas P M, Marques E D S, Mariano L N B,. Benzophenone guttiferone A fromRusby (Clusiaceae) presents genotoxic effects in different cells of mice [J]., 2013, 8(11): e76485.
[71] Lannang A M, Komguem J, Ngninzeko F N,. Antioxidant benzophenones and xanthones from the root bark of[J]., 2006, 20(2): 247-252.
[72] Kuete V, Komguem J, Beng V P,. Antimicrobial components of the methanolic extract from the stem bark ofOliver (Clusiaceae) [J]., 2007, 73(3): 347-354.
[73] Herath K, Jayasuriya H, Ondeyka J G,. Guttiferone I, a new prenylated benzophenone fromas a liver X receptor ligand [J]., 2005, 68(4): 617-619.
[74] Masullo M, Bassarello C, Bifulco G,. Polyisoprenylated benzophenone derivatives from the fruits ofand their absolute configuration by quantum chemical circular dichroism calculations [J]., 2010, 66(1): 139-145.
[75] Han Q B, Yang N Y, Tian H L,. Xanthones with growth inhibition against HeLa cells from[J]., 2008, 69(11): 2187-2192.
[76] Roux D, Hadi H A, Thoret S,. Structure-activity relationship of polyisoprenyl benzophenones fromon the tubulin/microtubule system [J]., 2000, 63(8): 1070-1076.
[77] Kumar S, Chattopadhyay S K. High-performance liquid chromatography and LC-ESI-MS method for the identification and quantification of two biologically active polyisoprenylated benzophenones xanthochymol and isoxanthochymol in different parts of[J]., 2007, 21(2): 139-163.
[78] Hussain R A, Waterman P G. Lactones, flavonoids and benzophenones fromand[J]., 1982, 21(6): 1393-1396.
[79] Kumar S, Chattopadhyay S K, Darokar M P,. Cytotoxic activities of xanthochymol and isoxanthochymol substantiated by LC-MS/MS [J]., 2007, 73(14): 1452-1456.
[80] Waterman P G, Crichton E G. Xanthones, benzophenones and triterpenes from the stem bark of[J]., 1980, 40(12): 351-355.
[81] Ting C W, Hwang T L, Chen I S,. A new benzoylphloroglucinol derivative with an adamantyl skeleton and other constituents from: effects on neutrophil pro-inflammatory responses [J]., 2012, 9(1): 99-105.
[82] Shan W G, Lin T S, Yu H N,. Polyprenylated xanthones and benzophenones from the bark of[J]., 2012, 95(8): 1442- 1448.
[83] 余辅松. 岭南山竹子树皮化学成分研究 [D]. 苏州: 苏州大学, 2013.
[84] Kumar S, Sharma S, Chattopadhyay S K. High- performance liquid chromatography and LC-ESI-MS method for identification and quantification of two isomeric polyisoprenylated benzophenones isoxanthochymol and camboginol in different extracts ofspecies [J]., 2009, 23: 888-907.
[85] Rao A V R, Venkatswamy G, Pendse A D. Camboginol and cambogin [J]., 1980, 21(20): 1975- 1978.
[86] Sahu A, Das B, Chatterjee A. Polyisoprenylated benzophenones from[J]., 1989, 28(4): 1233-1235.
[87] Jia Y W, Jiang J W, Lu X Y,. Garcinol suppresses RANKL-induced osteoclastogenesis and its underlying mechanism [J]., 2018, 234(5): 7498-509.
[88] Hartati S, Soemiati A, Wang H B,. A novel polyisoprenyl benzophenone derivative from[J]., 2008, 10(6): 509-513.
[89] Chien S C, Chyu C F, Chang I S,. A novel polyprenylated phloroglucinol, garcinialone, from the roots of[J]., 2008, 49(50): 5276-5278.
[90] 李慧, 杨先会, 王宁, 等. 岭南山竹子化学成分的研究 [J]. 时珍国医国药, 2012, 23(6): 1353-1355.
[91] Chen Y, Gan F, Jin S,. Adamantyl derivatives and rearranged benzophenones fromfruits [J]., 2017, 7(28): 17289-17296.
[92] Li P, Senthilkumar H A, Figueroa M,. UPLC- QTOFMSE-guided dereplication of the endangered Chinese speciesto identify additional benzophenone derivatives [J]., 2016, 79: 1619-1627.
[93] Thoison O, Cuong D D, Gramain A,. Further rearranged prenylxanthones and benzophenones from[J]., 2005, 61(35): 8529- 8535.
[94] Weng J R, Tsao L T, Wang J P,. Anti-inflammatory phloroglucinols and terpenoids from[J]., 2004, 67(11): 1796-1799.
[95] Hussain R A, Owegby A G, Parimoo P,. Kolanone, a novel polyisoprenylated benzophenone with antimicrobial properties from the fruit of[J]., 1982, 44(2): 78-81.
[96] Iinuma M, Tosa H, Ito T,. Three new benzophenone- xanthone dimers from the root of[J]., 1996, 44(9): 1744-1747.
[97] Beerhues L, Liu B. Biosynthesis of biphenyls and benzophenones - evolution of benzoic acid-specific type III polyketide synthases in plants [J]., 2009, 70(15/16): 1719-1727.
[98] Rubio O C, Piccinelli A L, Rastrelli L. Chemistry and biological activity of polyisoprenylated benzophenone derivatives [J]., 2005, 32(5): 671-720.
[99] Piccinelli A L, Rubio O C, Chica M B,. Structural revision of clusianone and 7-epi-clusianone and anti-HIV activity of polyisoprenylated benzophenones [J]., 2005, 61(34): 8206-8211.
[100]张俊艳, 韩英梅, 常允平. 藤黄属植物的化学成分和药理作用研究进展 [J]. 现代药物与临床, 2012, 27(3): 297-303.
Research progress on benzophenone derivatives from
PENG Xiao-hui, FAN Xiao-jie, LIU Xiao-jia, BAI Jiao, LI Da-hong, LI Zhan-lin, HUA Hui-ming
Shenyang Pharmaceutical University, Shenyang 110000, China
Natural benzophenone derivatives are mainly distributed inplants. They are main effective constituents ofand showed antitumor, anti-inflammatory, and antioxidant activities. The structure classification, biosynthetic pathway, spectrascopic characteristics and extraction and separation methods of benzophenone derivatives inplants are summarized in this paper, in order to provide a reference for further study, development and application of benzophenone derivatives ofplants.
Linn.; benzophenone derivatives; structural classification; biosynthetic pathway; spectroscopic characteristics; extraction; separation
R282.71
A
0253 - 2670(2021)06 - 1799 - 17
10.7501/j.issn.0253-2670.2021.06.030
2020-06-13
国家自然科学基金资助项目(31570350)
彭晓辉(1994—),男,湖北随州人,硕士研究生,从事天然药物化学研究。Tel: 18272359831 E-mail: 2755130849@qq.com
华会明,教授。E-mail: huimhua@163.com
[责任编辑 崔艳丽]
