大果藤黄中2个新的香豆素类化学成分
2021-03-17武瑞芳宣利江
武瑞芳,宣利江
•化学成分 •
大果藤黄中2个新的香豆素类化学成分
武瑞芳1, 2,宣利江1*
1. 中国科学院上海药物研究所,上海 201203 2. 中国科学院大学,北京 100049
研究大果藤黄果实的化学成分,以期发现新的活性化合物。运用硅胶、Sephadex LH-20、Chromatorex C18、Diol silica gel、MCI gel CHP-20P以及反相半制备型高效液相等各种现代色谱分离技术进行系统的分离纯化,根据化合物的光谱数据和理化性质进行结构鉴定。从大果藤黄中共分离得到11个香豆素类化合物,分别鉴定为()-5-羟基-7-甲氧基-8-(2-羟基-3-甲基-3-丁烯-1-基)-2-1-苯并吡喃-2-酮(1)、()-5-羟基-7-甲氧基-8-(2-羟基-3-乙氧基-3-甲基丁基)-2-1-苯并吡喃-2-酮(2)、异欧前胡素(3)、橙皮油内酯(4)、(−)-3′-乙基-橙皮内酯水合物(5)、(+)-2′-羟基-异蛇床子素(6)、(+)-2′-乙酰基-3′-羟基-蛇床子素(7)、(−)-yuehgesin B(8)、异橙皮内酯(9)、(−)-橙皮内酯水合物I(10)、(−)-橙皮内酯水合物(11)。化合物1、2是新香豆素类化合物,命名为()-5,2′-二羟基-异蛇床子素和橙皮内酯水合物V,以上香豆素类成分均在大果藤黄中首次分离得到。
大果藤黄;香豆素;()-5,2′-二羟基-异蛇床子素;橙皮内酯水合物V;异欧前胡素;异橙皮内酯
大果藤黄为藤黄科(Guttiferae)藤黄属Linn. 植物大果藤黄Roxb.的果实。藤黄属植物全世界约有450种,主要分布于亚洲热带地区、非洲南部和波利尼西亚西部。我国有20多种,主产于福建、海南、广西、云南以及湖南等地区[1]。大果藤黄又名减肥果,其中含有大量的羟基柠檬酸,能抑制脂肪的合成。同时,大果藤黄中的藤黄新酸对肿瘤有一定的抑制作用[2]。国内外学者对于该植物化学成分研究较少,分离得到的化合物主要为呫酮类化合物[3]。针对该植物的活性研究也多集中于粗提物,研究表明该植物粗提物具有降血糖和抗氧化[4]、肝保护[5]、调血脂[6]等多种活性。为了进一步明确大果藤黄的药效物质基础,确定其活性成分。本课题组对其95%乙醇提取物经萃取得到的醋酸乙酯层进行系统的化学成分研究,分离得到11个香豆素类化合物。分别鉴定为()-5-羟基-7-甲氧基-8-(2-羟基-3-甲基-3-丁烯-1-基)-2- 1-苯并吡喃-2-酮 [()-5-hydroxy-7-methoxy-8-(2- hydroxy-3-methyl-3-buten-1-yl)-2-1-benzopyran-2-one,1]、()-5-羟基-7-甲氧基-8-(2-羟基-3-乙氧基- 3-甲基丁基)-2-1-苯并吡喃-2-酮 [()-5-hydroxy-7- methoxy-8-(2-hydroxy-3-ethoxy-3-methylbutyl)-2-1- benzopyran-2-one,2]、异欧前胡素(isoimperatorin,3)、橙皮油内酯(auraptene,4)、(−)-3′-乙基-橙皮内酯水合物 [(−)-3′-ethyl-meranzin hydrate,5]、(+)-2′-羟基-异蛇床子素 [(+)-2′-hydroxyl- isoothole,6]、(+)-2′-乙酰基-3′-羟基-蛇床子素 [(+)-2′- acetyloxy-3′-hydroxy-osthole,7]、[(−)- yuehgesin B,8]、异橙皮内酯(isomeramazin,9)、(−)-橙皮内酯水合物I [(−)-meranzin hydrate I,10]、(−)-橙皮内酯水合物 [(−)-meranzin hydrate,11]。其中,化合物1和2为新香豆素类化合物,分别命名为()-5,2′-二羟基-异蛇床子素和(−)-橙皮内酯水合物V。
1 仪器与材料
Rudolph Autopol Ⅵ automatic polarimeter旋光仪(Rudolph,美国);Bruker AM-400 spectrometer(400 MHz)以及Bruker Advance Ⅲ 600 spectrometer(600 MHz,150 MHz)核磁共振波谱仪(Bruker,瑞士);Agilent 1100 serie半制备型高效液相色谱仪(Agilent,美国),半制备色谱柱为YMC-Pack ODS-A型号(250 mm×10 mm,5 μm);Agilent G6224A TOF型液相质谱联用仪(Agilent,美国)。
柱色谱硅胶(200~300、300~400目,青岛海洋化工有限公司);MCI-gel CHP-20P树脂(75~150 μm,Mitsubishi Chemical Industries Co.,Ltd.);Diol柱硅胶(60 μm,Fuji Silysia Chemical Ltd.);C18键合硅胶(20~45 μm,Fuji Silysia Chemical Ltd.);Sephadex LH-20(20~80 μm,Amersham,Pharmacia Biotech AB);GF254硅胶板(烟台江友硅胶开发有限公司);AR级甲醇、二氯甲烷、丙酮、醋酸乙酯、石油醚(60~90 ℃),中国医药集团(上海)化学试剂公司;氘代甲醇、氘代氯仿和氘代吡啶,中国医药集团(上海)化学试剂公司。
大果藤黄果实15 kg,于2018年7月从中国广西采集,由广西药检所杨鹤鸣教授鉴定确定为大果藤黄Roxb.的果实,标本(SIMM880)保存于中国科学院上海药物研究所海科路园区2319室。
2 提取与分离
取大果藤黄果实切片15 kg,粉碎后用95%乙醇水溶液常温浸提3次,每次48 h。提取液浓缩蒸干得到粗浸膏。将植物浸膏用水混悬后用醋酸乙酯进行萃取,重复3次得到水层和醋酸乙酯层,醋酸乙酯层(340 g)利用硅胶拌样后进行柱色谱分离,用石油醚-醋酸乙酯(20∶1、10∶1、4∶1、2∶1、1∶1、1∶2、1∶4、0∶1)梯度洗脱,得到6个组分(Fr. 1~6)。随后用Silica gel、Diol silica gel、Chromatorex C18、MCI gel CHP-20P、Sephadex LH-20柱色谱和半制备高效液相色谱等多种技术进行了分离纯化,从Fr. 3得到化合物3(19.8 mg)、4(149.6 mg),从Fr. 4得到化合物1(3.8 mg)、2(7.9 mg)、5(107.9 mg)、6(22.1 mg)、7(17.8 mg)、8(110.0 mg)、9(26.5 mg),从Fr. 5得到化合物10(14.2 mg)、11(404.0 mg)。
3 结构鉴定
化合物1:淡黄色固体,易溶于甲醇、氯仿。HR-ESI-MS测定其准分子离子峰为/277.106 6 [M+H]+(计算值为277.107 1),结合13C-NMR谱图分析,确定其分子式为C15H16O5,不饱和度为8。
1H-NMR谱(表1)可以明显看出2个甲基氢信号 [H1.80 (3H, s), 3.85 (3H, s)],其中H3.85是1个甲氧基信号,2组烯氢信号 [H8.08 (1H, d,= 9.5 Hz), 6.06 (1H, d,= 9.5 Hz)] 和 [H4.59 (2H, m)] 和1个孤立的苯环氢信号 [H6.38 (1H, s)]。13C- NMR谱(表1)显示15个碳信号,其中包括7个季碳、4个次甲基、2个亚甲基、2个甲基。根据其化学位移确认为1组苯环碳信号(C163.3, 156.0, 155.3, 106.7, 104.1, 95.1),1个内酯羰基信号(C164.1),2组烯烃信号 (C141.57, 109.86) 和 (C148.53, 111.34)。这些特征信号与已知化合物2′-hydroxyl-isoothole[7]类似,区别在于化合物1中5位碳化学位移明显向低场移动,结合该化合物分子式中有5个氧原子确定C-5 (C156.0) 位置处连氧取代。该化合物结构可进一步由HMBC谱图确定。在HMBC谱(图1)中,H-6 (H6.38) 和C-4a (C104.1)、C-8 (C106.6) 相关,甲氧基信号 (H3.85) 与C-7 (C163.3) 信号相关,说明7位是甲氧基取代,H-4 (H8.08) 与C-5 (C156.0) 相关确定5位羟基取代。H-1′ (H3.00, 2.91) 与C-7 (C163.3)、C-8a (C155.3)、C-3′ (C148.5) 相关确定8位取代支链的结构。化合物1的平面结构被确定如图1所示。
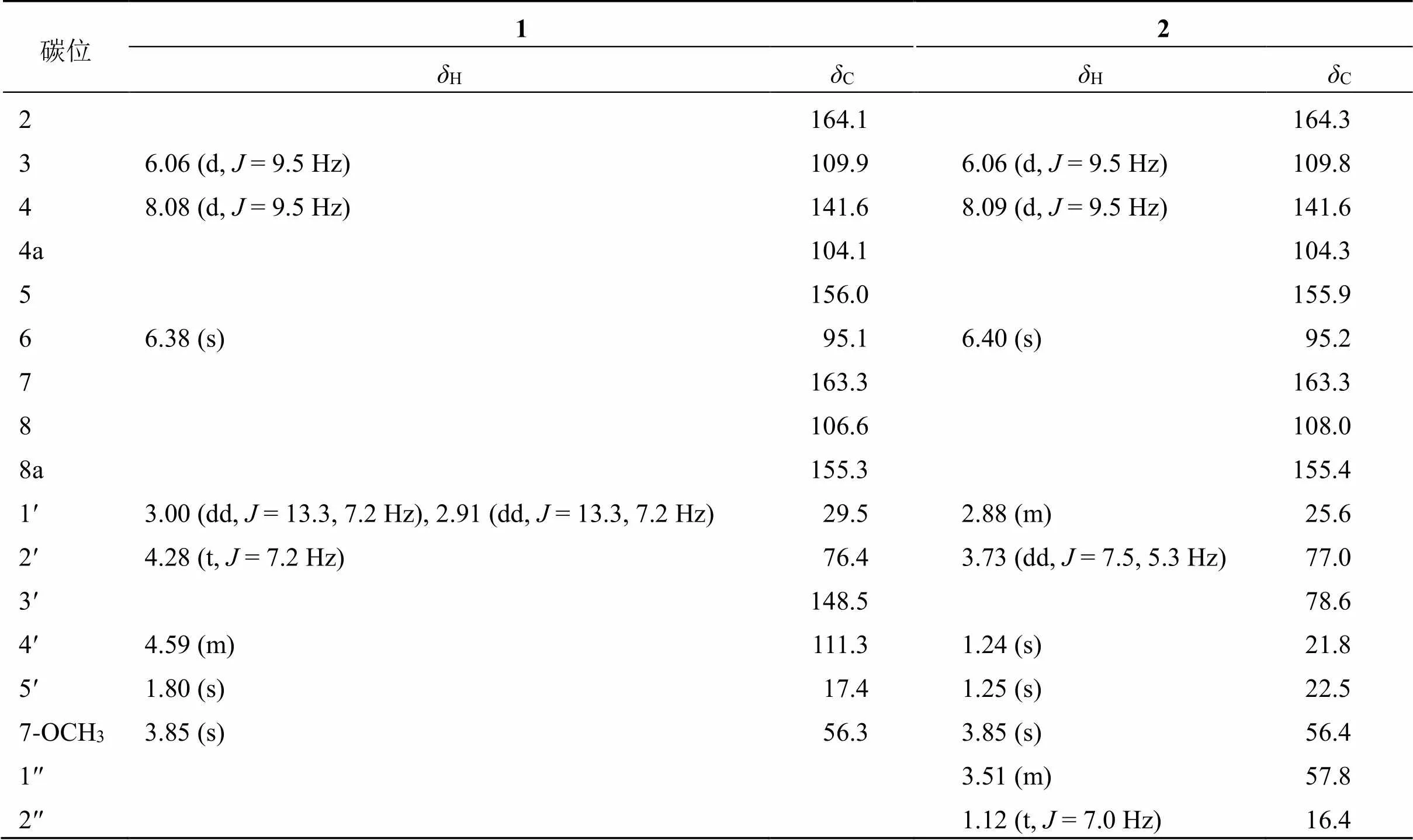
表1 化合物1和2的1H-NMR (600 MHz, CD3OD)和13C-NMR数据(150 MHz, CD3OD)
化合物1绝对构型通过Mosher法确定。取化合物1(1 mg)于EP管中,以200 μL 无水吡啶溶解后,加入10 μL的()-或()-MTPA-Cl,振摇使其均匀混合,室温静置12 h。反应液用硅胶柱[石油醚-醋酸乙酯(7∶1)]进行纯化,得到化合物1的()-MTPA酯(0.7 mg)或()-MTPA酯(0.7 mg)。化合物1的7-OCH3、H-1′、H-4′和H-5′的化学位移差(Δδ-Δδ)分别为+0.07、+0.06、+0.11、−0.15、−0.08和−0.11(图2)。因此化合物1的2′为羟基绝对构型为S,确定化合物1的结构为()-5-羟基-7-甲氧基-8-(2-羟基-3-甲基-3-丁烯-1-基)-2-1-苯并吡喃-2-酮,命名为()-5,2′-二羟基-异蛇床子素。
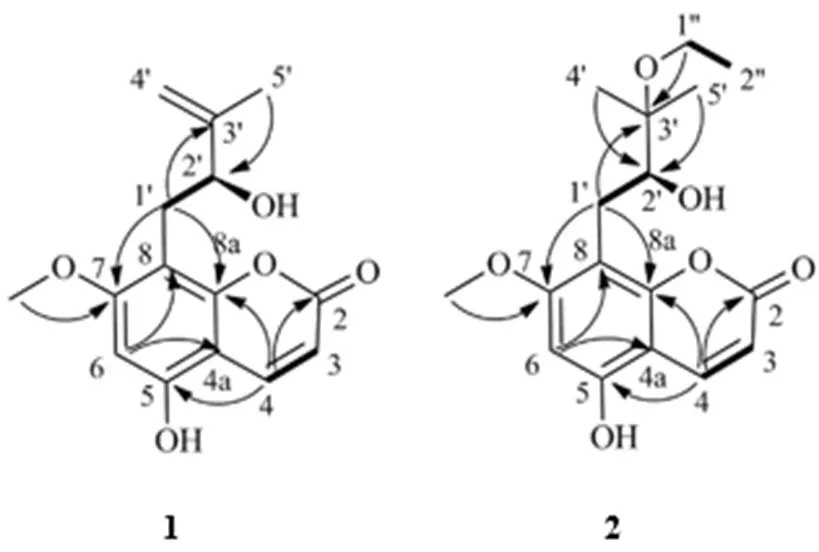
图1 化合物1和2的结构及关键COSY (粗线)、HMBC (箭头) 相关信号
化合物2:淡黄色固体,易溶于甲醇、氯仿。HR-ESI-MS测定其准分子离子峰为/345.130 3 [M+Na]+(计算值为345.130 9)。结合13C-NMR谱图分析,确定其分子式为C17H22O6,不饱和度为7。
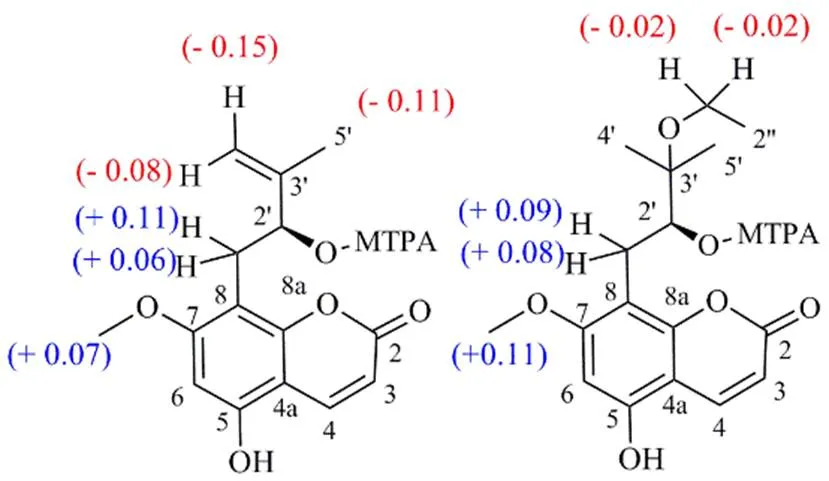
图2 化合物1和2 (S)-和(R)-MTPA酯的化学位移差(600 MHz, CD3OD)
1H-NMR谱(表1)可以明显看到4个甲基氢信号 [H1.12 (3H, t,= 7.0 Hz), 1.23 (3H, s), 1.24 (3H, s), 3.85 (3H, s)],其中1个t峰推测可能是乙基取代 [H3.51 (2H, m), 1.12 (3H, t,= 7.0 Hz)],1对烯氢信号 [H8.09 (1H, d,= 9.5 Hz ), 6.06 (1H, d,= 9.5 Hz )],1个孤立的苯环氢信号 [H6.40 (1H, s)]。13C-NMR谱(表1)显示17个碳信号,其中包括7个季碳、4个次甲基、2个亚甲基、4个甲基。根据其化学位移确认其有1组苯环碳信号 (C163.3, 155.9, 155.4, 108.0, 104.3, 95.2)、1个内酯羰基信号 (C164.3),1组烯烃信号 (C141.6, 109.8)。这些特征信号文献中meranzin hydrate I[8]的核磁数据类似,只多出一组连氧乙基取代基 (C57.8, 17.6)信号。在HMBC谱(图1)H-1′′ (H3.54, 3.49)与C-3′ (C78.6) 相关,确定连氧乙基的取代位置为C-3′位。甲氧基氢信号 (H3.85) 与C-7 (C163.3) 信号相关,确定7位是甲氧基取代。化合物2的平面结构被确定,如图1所示。
化合物2绝对构型是通过Mosher法确定,取化合物2(1 mg)于EP管中,以200 μL无水吡啶溶解后,加入10 μL的()-或()-MTPA-Cl,振摇使其均匀混合,室温静置12 h。反应液用硅胶柱[石油醚-醋酸乙酯(7∶1)]进行纯化,得到化合物1的()-MTPA酯(0.7 mg)或()-MTPA酯(0.6 mg)。化合物2的7-OCH3,H-1′和H-1′′的Δδ-Δδ分别为+0.11、+0.08、+0.09、−0.02(图2)。2结构确定为()-5-羟基-7-甲氧基-8-(2-羟基-3-乙氧基-3-甲基丁基)-2-1-苯并吡喃-2-酮,命名为橙皮内酯水合物V。
化合物3:白色块状结晶(甲醇),1H-NMR (400 MHz, CDCl3): 8.16 (1H, d,= 9.8 Hz, H-4), 7.59 (1H, d,= 2.4 Hz, H-10), 7.15 (1H, s, H-8), 6.95 (1H, dd,= 2.4, 1.0 Hz, H-9), 6.27 (1H, d,= 9.8 Hz, H-3), 5.53 (1H, t,= 7.0 Hz, H-2′), 4.92 (2H, d,= 7.0 Hz, H-1′), 1.80 (3H, s, H-5′), 1.70 (3H, s, H-4′);13C-NMR (125 MHz, CDCl3): 161.5 (C-2), 158.3 (C-7), 152.8 (C-5), 149.1 (C-8a), 145.0 (C-10), 140.0 (C-3′), 139.7 (C-4), 119.2 (C-2′), 114.3 (C-6), 112.7 (C-3), 107.7 (C-4a), 105.2 (C-9), 94.4 (C-8), 69.9 (C-1), 26.0 (C-4′), 18.4 (C-5′)。以上波谱数据与文献报道基本一致[9],故鉴定化合物3为异欧前胡素。
化合物4:白色块状结晶(甲醇),1H-NMR (400 MHz, CDCl3): 7.61 (1H, d,= 9.5 Hz, H-4), 7.34 (1H, d,= 8.6 Hz, H-5), 6.82 (1H, dd,= 8.6, 2.4 Hz, H-6), 6.78 (1H, d,= 2.4 Hz, H-8), 6.21 (1H, d,= 9.5 Hz, H-3), 5.44 (2H, qt,= 6.5, 1.3 Hz, H-2′), 5.05 (1H, m, H-6′), 4.57 (2H, d,= 6.5 Hz, H-1′), 2.08 (4H, m, H-4′, 5′), 1.73 (3H, d,= 1.3 Hz, H-9′), 1.64 (3H, d,= 1.5 Hz, H-8′), 1.57 (3H, d,= 1.3 Hz, H-10′);13C-NMR (125 MHz, CDCl3): 162.2 (C-2), 161.4 (C-7), 155.9 (C-8a), 143.6 (C-4), 142.4 (C-3′), 132.0 (C-7′), 128.8 (C-5), 123.7 (C-6′), 118.5 (C-2′), 113.3 (C-6), 112.9 (C-3), 112.5 (C-4a), 101.6 (C-8), 65.5 (C-1′), 39.6 (C-4′), 26.3 (C-5′), 25.7 (C-8′), 17.8 (C-10′), 16.8 (C-9′)。以上波谱数据与文献报道基本一致[10],故鉴定化合物4为橙皮油内酯。
化合物5:淡黄色油状体,[α]20 D −18°(0.1,MeOH)。1H-NMR (600 MHz, CD3OD): 7.84 (1H, d,= 9.5 Hz, H-4), 7.45 (1H, d,= 8.6 Hz, H-5), 7.01 (1H, d,= 8.6 Hz, H-6), 6.22 (1H, d,= 9.5 Hz, H-3), 3.95 (3H, s, 7-OCH3), 3.81 (1H, dd,= 7.9, 4.0 Hz, H-2′), 3.56 (2H, m, H-1′′), 3.01 (2H, m, H-1′), 1.30 (3H, s, H-4′), 1.30 (3H, s, H-5′), 1.17 (3H, t,= 7.0 Hz, H-2′′);13C-NMR (125 MHz, CD3OD): 163.6 (C-2), 162.5 (C-7), 154.8 (C-8a), 146.3 (C-4), 128.3 (C-5), 117.4 (C-4a), 114.3 (C-8), 113.0 (C-3), 108.9 (C-6), 78.6 (C-3′), 76.7 (C-2′), 57.9 (C-1′′), 56.6 (7-OCH3), 26.2 (C-1′), 22.6 (C-5′), 21.7 (C-4′), 16.4 (C-2′′)。以上波谱数据与文献报道基本一致[11],故鉴定化合物5为(−)-3′-乙基-橙皮内酯水合物。
化合物6:淡黄色结晶(甲醇),[α]20 D+14°(0.1,MeOH)。1H-NMR (400 MHz, CD3OD): 7.87 (1H, d,= 9.5 Hz, H-4), 7.49 (1H, d,= 8.6 Hz, H-5), 7.03 (1H, d,= 8.6 Hz, H-6), 6.23 (1H, d,= 9.5 Hz, H-3), 4.60 (2H, m, H-4′), 4.37 (1H, t,= 7.1 Hz, H-2′), 3.95 (3H, s, 7-OCH3), 3.12 (2H, m, H-1′), 1.85 (3H, s, H-5′);13C-NMR (125 MHz, CD3OD): 163.4 (C-2), 162.5 (C-7), 154.6 (C-8a), 148.5 (C-3′), 146.3 (C-4), 128.6 (C-5), 115.8 (C-4a), 114.2 (C-8), 113.1 (C-3), 111.3 (C-4′), 108.9 (C-6), 76.1 (C-2′), 56.6 (7-OCH3), 30.0 (C-1′), 17.4 (C-5′)。以上波谱数据与文献报道基本一致[7],故鉴定化合物6为(+)-2′-羟基-异蛇床子素。
化合物7:淡黄色油状体,[α]19 D+24°(0.1,MeOH)。1H-NMR (400 MHz, CDCl3): 7.88 (1H, d,= 9.4 Hz, H-4), 7.50 (1H, d,= 8.6 Hz, H-5), 7.02 (1H, d,= 8.6 Hz, H-6), 6.24 (1H, d,= 9.4 Hz, H-3), 5.13 (1H, dd,= 10.7, 2.4 Hz, H-2′), 3.96 (3H, s, 7-OCH3), 3.25 (1H, dd,= 13.6, 10.7 Hz, H-1′), 3.08 (1H, dd,= 13.6, 2.4 Hz, H-1′), 1.74 (3H, s, H-2′′), 1.33 (3H, s, H-4′), 1.30 (3H, s, H-5′);13C-NMR (125 MHz, CDCl3): 170.7 (C-1′′), 161.3 (C-2), 160.8 (C-7), 153.6 (C-8a), 144.0 (C-4), 127.4 (C-5), 114.8 (C-4a), 113.0 (C-3), 112.8 (C-8), 107.3 (C-6), 79.2 (C-2′), 72.6 (C-3′), 56.3 (7-OCH3), 26.6 (C-4′), 25.4 (C-5′), 23.4 (C-1′), 20.8 (C-2′′)。以上波谱数据与文献报道基本一致[7],故鉴定化合物7为(+)-2′-乙酰基- 3′-羟基-蛇床子素。
化合物8:淡黄色油状体,[α]19 D −26°(0.1,MeOH)。1H-NMR (400 MHz, CD3OD): 7.82 (1H, d,= 9.4 Hz, H-4), 7.43 (1H, d,= 8.6 Hz, H-5), 6.99 (1H, d,= 8.6 Hz, H-6), 6.20 (1H, d,= 9.4 Hz, H-3), 3.95 (3H, s, 7-OCH3), 3.80 (1H, dd,= 9.9, 3.0 Hz, H-2′), 3.32 (3H, s, 3′-OCH3), 3.00 (1H, dd,= 13.5, 9.9 Hz, H-1′), 2.91 (1H, dd,= 13.5, 3.0 Hz, H-1′), 1.30 (3H, s, H-4′), 1.29 (3H, s, H-5′);13C-NMR (125 MHz, CD3OD): 163.5 (C-2), 162.3 (C-7), 154.5 (C-8a), 146.2 (C-4), 128.3 (C-5), 117.1 (C-4a), 114.2 (C-8), 112.9 (C-3), 108.8 (C-6), 78.7 (C-3′), 76.5 (C-2′), 56.6 (7-OCH3), 49.8 (3′-OCH3), 26.1 (C-1′), 21.7 (C-4′), 21.2 (C-5′)。以上波谱数据与文献报道基本一致[12],故鉴定化合物8为(−)-yuehgesin B。
化合物9:淡黄色结晶(甲醇),1H-NMR (400 MHz, CD3OD): 7.86 (1H, d,= 9.5 Hz, H-4), 7.52 (1H, d,= 8.6 Hz, H-5), 7.02 (1H, d,= 8.6 Hz, H-6), 6.21 (1H, d,= 9.5 Hz, H-3), 4.02 (2H, s, H-1′), 3.90 (3H, s, 7-OCH3), 2.89 (1H, hept,= 6.9 Hz, H-3′), 1.21 (3H, s, H-4′), 1.19 (3H, s, H-5′);13C-NMR (125 MHz, CD3OD): 213.6 (C-2′), 162.9 (C-2), 162.0 (C-7), 154.4 (C-8a), 146.1 (C-4), 129.3 (C-5), 114.2 (C-4a), 113.2 (C-3), 112.7 (C-8), 108.8 (C-6), 56.8 (7-OCH3), 41.9 (C-3′), 35.6 (C-1′), 18.8 (C-4′, 5′)。以上波谱数据与文献报道基本一致[13],故鉴定化合物9为异橙皮内酯。
化合物10:黄色无定形粉末,[α]19 D −27°(0.1,MeOH)。1H-NMR (400 MHz, CD3OD): 8.10 (1H, d,= 9.5 Hz, H-4), 6.39 (1H, s, H-6), 6.05 (1H, d,= 9.5 Hz, H-3), 3.85 (3H, s, 7-OCH3), 3.58 (1H, dd,= 7.7, 5.2 Hz, H-2′), 2.88 (2H, m, H-1′), 1.27 (3H, s, H-4′), 1.24 (3H, s, H-5′);13C-NMR (125 MHz, CD3OD): 164.6 (C-2), 163.4 (C-7), 156.7 (C-5), 155.3 (C-8a), 141.9 (C-4), 109.4 (C-3), 107.4 (C-8), 104.5 (C-4a), 95.4 (C-6), 79.1 (C-3′), 74.1 (C-2′), 56.4 (7-OCH3), 25.8 (C-1′), 25.5 (C-4′, 5′)。以上波谱数据与文献报道基本一致[8],故鉴定化合物10为(−)-橙皮内酯水合物I。
化合物11:黄色油状体。[α]19 D −42°(0.1,MeOH)。1H-NMR (400 MHz, CD3OD): 7.77 (1H, d,= 9.5 Hz, H-4), 7.38 (1H, d,= 8.6 Hz, H-5), 6.95 (1H, d,= 8.6 Hz, H-6), 6.17 (1H, d,= 9.5 Hz, H-3), 3.93 (3H, s, 7-OCH3) 3.66 (1H, dd,= 9.7, 3.1 Hz, H-2′), 2.92 (2H, m, H-1′), 1.33 (3H, s, H-5′), 1.32 (3H, s, H-4′);13C-NMR (125 MHz, CD3OD): 163.4 (C-2), 162.0 (C-7), 154.2 (C-8a), 146.1 (C-4), 128.2 (C-5), 116.7 (C-8), 113.9 (C-4a), 112.7 (C-3), 108.7 (C-6), 78.6 (C-2′), 73.9 (C-3′), 56.6 (7-OCH3), 26.1 (C-1′), 25.6 (C-4′), 25.4 (C-5′)。以上波谱数据与文献报道基本一致[14],故鉴定化合物11为(−)-橙皮内酯水合物。
利益冲突 所有作者均声明不存在利益冲突
[1] 张俊艳, 韩英梅, 常允平. 藤黄属植物的化学成分和药理作用研究进展 [J]. 现代药物与临床, 2012, 27(3): 297-303.
[2] 李春宇, 张彤, 郭庆华, 等. 大果藤黄乙醇提取物的降血脂与抗氧化性 [J]. 贵州农业科学, 2017, 45(7): 68-73.
[3] Vo H T, Ngo N T N, Bui T Q,. Geranylated tetraoxygenated xanthones from the pericarp of[J]., 2015, 13: 119-122.
[4] Ali M Y, Paul S, Tanvir E M,. Antihyperglycemic, antidiabetic, and antioxidant effects ofin rats [J]., 2017, 2017: 2979760.
[5] Bhuyan B, Deka T, Rajak P. Assessment ofRoxb. role on biological markers in carbonchloride induced rat model [J]., 2020, 35(3): 331-338.
[6] Sarma R, Kumari S, Elancheran R,. Polyphenol rich extract offruit attenuates the hyperlipidemia induced by high fat diet [J]., 2016, 7: 294.
[7] Lv X, Xin X L, Deng S,. Biotransformation of osthole by[J]., 2012, 47(12): 2542-2546.
[8] Tian D M, Wang F F, Duan M L,. Coumarin analogues from the(L.) osbeck and their hepatoprotective activity [J]., 2019, 67(7): 1937-1947.
[9] Li Y H, Luo F, Peng S L,. A new dihydroisocoumarin from the rhizomes of[J]., 2006, 20(9): 860-865.
[10] Saleem M, Afza N, Anwar M A,. Aromatic constituents from fruit peels of[J]., 2005, 19(6): 633-638.
[11] Bishay D, El-Sayyad S, Abd El-Hafiz M,. Phytochemical study ofl. cultivated in egypt ii-coumarins of the leaves [J]., 1988, 11(1): 88-104.
[12] Lin J K, Wu T S. Constituents of flowers of[J]., 1994, 41(2): 213-216.
[13] 牛艳, 王磊, 黄晓君, 等. 化橘红香豆素类的化学成分 [J]. 暨南大学学报: 自然科学与医学版, 2012, 33(5): 501-505.
[14] Zhou P, Takaishi Y, Duan H,. Coumarins and bicoumarin from: Anti-HIV activity and inhibition of cytokine release [J]., 2000, 53(6): 689-697.
Two new coumarins from fruit of
WU Rui-fang1, 2, XUAN Li-jiang1
1. Shanghai Institute of Materia, Chinese Academy of Sciences, Shanghai 201203, China 2. University of Chinese Academy of Sciences, Beijing 100049, China
For the purpose of finding new bioactive compounds from natural resources, the phytochemical investigation on the fruit ofwas carried out.The chemical constituents fromwere isolated through various modern chromatographic separation techniques including silica gel, Sephadex LH-20, Chromatorex C18, Diol silica gel, MCI gel CHP-20P, and semi-preparative HPLC. The structures of compounds were identified based on spectroscopic data and physicochemical properties.Eleven coumarins were isolated and identified as ()-5-hydroxy-7-methoxy-8-(2-hydroxy-3- methyl-3-buten-1-yl)-2-1-benzopyran-2-one (1), ()-5-hydroxy-7-methoxy-8-(2-hydroxy-3-ethoxy-3-methylbutyl)-2-1-benzopyran- 2-one (2), isoimperatorin (3), auraptene (4), (−)-3′-ethyl-meranzin hydrate (5), (+)-2′-hydroxyl-isoosthole (6) (+)-2′-acetoxy-3′- hydroxy-osthole (7), (−)-yuehgesin B (8), isomeramazin (9), (−)-meranzin hydrate I (10), and (−)-meranzin hydrate (11).Compounds 1 and 2 are identified as two new coumarins named as ()-5,2′-dihydroxy-isoothole and meranzin hydrate V.
Roxb.; coumarins; ()-5,2′-dihydroxy-isoosthole; meranzin hydrate V; isoimperatorin; isomeramazin
R284.1
A
0253 - 2670(2021)06 - 1549 - 06
10.7501/j.issn.0253-2670.2021.06.001
2020-09-23
国家自然科学基金资助项目(8147311)
武瑞芳,硕士研究生,从事中药及天然药物的活性成分研究。Tel/Fax: (021)20231000 E-mail: 15529526285@163.com
宣利江,研究员,博士生导师,从事中药及天然药物的活性成分研究。Tel/Fax: (021)20231968 E-mail: ljxuan@simm.ac.cn
[责任编辑 王文倩]
