Box-Behnken效应面法优化大黄素/小檗碱-壳聚糖双载药纳米粒的处方工艺研究
2021-03-17谢青璇李小芳梁由单
谢青璇,李小芳,谢 龙,王 娴,曹 怡,梁由单
Box-Behnken效应面法优化大黄素/小檗碱-壳聚糖双载药纳米粒的处方工艺研究
谢青璇,李小芳*,谢 龙,王 娴,曹 怡,梁由单
成都中医药大学药学院/中药材标准化教育部重点实验室/四川省中药资源系统研究与开发利用重点实验室——省部共建国家重点实验室培育基地,四川 成都 611137
优化大黄素(Emo)与小檗碱(Ber)壳聚糖双载药纳米粒的制备工艺和处方,并考察其稳定性及溶出度。以壳聚糖(CS)为载体,三聚磷酸钠(TPP)为交联剂,采用离子交联法包载大黄素/羟丙基-β-环糊精(HP-β-CD)和小檗碱,得到载药纳米粒(Emo/HP-β-CD-Ber-CS NPs),以粒径和多分散指数(PDI)为自变量,运用总评归一值(OD)法进行数据处理,采用Box-Behnken效应面法优化处方并进行验证。最后对纳米粒的最佳冻干条件进行筛选,考察保护剂种类和用量。并对制剂进行表征和溶出度考察。优化得到的最佳制备工艺为壳聚糖与TPP质量比为3∶1,小檗碱与载体质量比为0.166∶1,Emo/HP-β-CD与载体质量比为0.2∶1。测得Emo/HP-β-CD-Ber-CS NPs的平均粒径为(178.0±2.0)nm,PDI为0.187±0.006,平均OD值为0.953 6,实测值与预测值接近。大黄素和小檗碱的载药量分别为0.34%和0.95%。稳定性考察结果表明,纳米粒胶体溶液在9 d内以4 ℃储存物理性质稳定,以6%葡萄糖为保护剂制得的冻干制剂效果较好,复溶迅速,再分散后的平均粒径为(161.8±4.8)nm,PDI为0.263±0.047。体外释放研究表明载药纳米粒冻干粉溶解度和溶出度显著提高。Box-Behnken效应面法所建立的模型能较好的用于Emo/HP-β-CD-Ber-CS NPs制剂的处方优化,精度高,预测效果较好,且Emo/HP-β-CD-Ber-CS NPs制备工艺稳定可行。
大黄素;羟丙基-β-环糊精;小檗碱;壳聚糖;纳米粒;Box-Behnken效应面法;总评归一值法;离子交联法
大黄-黄连药对为中药清热泻火解毒的代表药味配伍之一,其源于张仲景《伤寒论》大黄黄连泻心汤,二者常相须配伍使用[1]。以大黄-黄连药对为基础的制剂疗效显著,因此二者在临床应用上有广阔的前景[2]。大黄素(emodin,Emo)是传统中药大黄和虎杖的天然蒽醌类成分,现代药理发现大黄素在保肝[1]、抗炎[2]、抗糖尿病[3]、抗溃疡[4]、免疫抑制[5],以及肿瘤治疗[6]中均有一定疗效。然而大黄素的水溶性极差,口服生物利用度低,使其在临床应用中受限。
小檗碱(berberine,Ber)即黄连素,是毛茛科黄连属植物黄连根和皮中提取的异喹啉类生物碱,具备多种药理活性,如清热解毒、抗菌、抗痢、抗肿瘤、降血糖、调节血脂等功能[7-12]。然而小檗碱具有较大的极性,口服易被胃肠道中的黏蛋白吸附而降低其吸收率,im和静脉滴注给药又易引起药疹、过敏性休克等较强的不良反应,而制剂味苦增加了儿童服药的困难[13]。因此,设计大黄素-小檗碱给药系统,以增加两者的溶解度,改善其生物利用度,是亟待解决的问题之一。
大黄素和小檗碱分别是大黄和黄连药对的主要有效成分,小檗碱与大黄素相须为用,《本草纲目》认为“相须”即“同类不可离也”,相须二药之间存在特殊的协同增效关系,彼此相须而不可离。研究表明二者联用可协同增效从而限制乳腺癌细胞生长,并诱导其凋亡[14]。然而大黄素与小檗碱的共同包载的研究还未见报道。
环糊精是一类重要的高分子材料,通过与药物形成包合物结构而实现提高难溶性药物溶解性、增强药物稳定性、改善药物生物利用度等目的[15]。经改性后的羟丙基-β-环糊精(HP-β-CD)与天然的β-环糊精相比,HP-β-CD水溶性大幅度提高,并具有更高的安全性[16]。以HP-β-CD包载大黄素,可增加大黄素的溶解度,提高其稳定性。壳聚糖(CS)是一种带正电的天然高分子化合物碱性多糖,来源广泛且价格低廉,具有良好的生物相容性、可降解性、低毒、低致敏性和生物黏附性,可以延长药物在体内的滞留时间和释放时间,增加机体对药物的吸收,已广泛地应用于生物医用材料、靶向给药等领域[17]。
为了提高大黄素与小檗碱的溶解度,本实验采用溶剂法制备Emo/HP-β-CD包合物(Emo/HP-β- CD),在此基础上,以壳聚糖为载体,采用离子交联法,与小檗碱和壳聚糖制备成大黄素/小檗碱-壳聚糖双载药纳米粒(Emo/HP-β-CD-Ber-CS NPs),并对所制得纳米粒进行工艺优化,以期为大黄素与小檗碱新制剂的开发及应用提供参考。
1 仪器与试剂
Nicomp 380ZLS型激光粒度分析仪,美国PSS公司;SJIA-10N-50型冷冻干燥机,宁波市双嘉仪器有限公司;Agilent 1200高效液相色谱仪,美国Agilent公司;Nicolet IS10傅里叶红外光谱分析仪,美国热电公司;JSM-IT300LA扫描电子显微镜(SEM),日本电子株式会社。
原料药大黄素(批号XC20161203,质量分数98%)、小檗碱(批号XC20170112,质量分数97%),西安小草植物科技有限责任公司;壳聚糖,浙江金壳有限公司;三聚磷酸钠(TPP)、HP-β-CD,成都市科龙试剂化工厂;对照品大黄素(批号MUST- 16110712,质量分数99.48%)、小檗碱(批号MUST- 16111115,质量分数98.95%),成都曼思特生物科技有限公司;85-2A数显恒温测速磁力搅拌器,金坛市白塔新宝仪器厂;甲醇,赛默飞世尔科技(中国)有限公司;乙醇,超纯水。
2 方法与结果
2.1 Emo/HP-β-CD的制备
根据前期预试验结果得知,将大黄素包载于HP-β-CD中,可提高大黄素的溶解性及稳定性,再将其与小檗碱共同包载于壳聚糖中,从而增加载药纳米粒的体系稳定性,有利于后续制剂制备。采用溶剂法进行制备,称取13.5 mg的大黄素溶解于一定量的乙醇溶液中,再将1.618 g的HP-β-CD溶于去离子水中,将大黄素溶液缓慢滴加进HP-β-CD溶液中,磁力搅拌一定时间,然后自然挥干乙醇,之后将挥干后的溶液采用冷冻干燥的方法冻干成Emo/HP-β-CD冻干粉。
2.2 大黄素与小檗碱的含量测定
精密称取大黄素对照品1.77 mg,置于10 mL量瓶中,用甲醇溶解稀释配制成质量浓度为70.8 μg/mL的对照品溶液。
色谱条件[18]:色谱柱为Agilent EP-C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.1%磷酸水溶液(85∶15);检测波长为254 nm;柱温30 ℃;体积流量1.0 mL/min;进样量20 μL。
取0.708、7.080、14.160、21.240、35.400、70.800 μg/mL大黄素对照品溶液,按照“2.2”项下的色谱条件测定,以大黄素对照品质量浓度为横坐标(),峰面积为纵坐标()进行线性回归,得回归方程=36.154-22.599,=0.999 6,线性范围0.708~70.800 μg/mL。
精密称取小檗碱对照品20.260 mg于100 mL量瓶中,用甲醇溶解并稀释成101.300 μg/mL的对照品溶液。根据文献方法[19]调整色谱条件,色谱柱为Agilent EP-C18柱(250 mm×4.6 mm,5 μm),流动相为乙腈-0.5%磷酸水溶液(以三乙胺调pH至3)(30∶70);检测波长为345 nm;柱温30 ℃;体积流量1.0 mL/min;进样量20 μL。取小檗碱对照品溶液进样测定,以对照品质量浓度为横坐标(),峰面积为纵坐标(),进行线性回归,得回归方程=36.351+10.989,=0.999 5,线性范围2.026~101.300 μg/mL。
2.3 壳聚糖纳米粒(CS NPs)的制备
将100 mg的壳聚糖溶于100 mL 1%醋酸溶液中,配制成壳聚糖溶液;再将TPP溶于去离子水配制成TPP溶液;将TPP溶液逐滴滴加到不断搅拌的壳聚糖溶液中,直至产生乳光,得到混悬液,即为CS NPs。
2.4 单因素考察CS NPs处方比例及工艺参数
2.4.1 CS NPs的平均粒径及多分散系数(PDI)的测定 取上述制备的混悬液1 mL,采用纳米激光粒度仪测定其粒径及PDI,平行测定3次,取平均值。
2.4.2 壳聚糖与TPP质量比对CS NPs平均粒径和PDI的影响 将适量的壳聚糖溶于1%醋酸溶液中,配制成1 mg/mL的壳聚糖溶液;配制质量浓度为1 mg/mL的TPP溶液;分别以壳聚糖与TPP质量比为6∶1、5∶1、4∶1、3∶1、2∶1,将TPP溶液逐滴滴加到不断搅拌的壳聚糖溶液中,室温下以600 r/min的转速搅拌10 min,对壳聚糖与TPP质量比进行考察,结果见表1。随着TPP用量的增加,CS NPs平均粒径和PDI均为先减小后增大,当壳聚糖与TPP质量比为3∶1时,平均粒径和PDI最小,这可能是因为带正电荷的壳聚糖与带负电荷的TPP交联,当TPP用量过高时,使壳聚糖分子间交联机率增大,从而使平均粒径增加,因此,初步选择壳聚糖与TPP质量比为3∶1。

表1 不同壳聚糖和TPP质量比下CS NPs平均粒径和PDI比较 (, n = 3)
2.4.3 壳聚糖质量浓度对CS NPs平均粒径和PDI的影响 在确定壳聚糖和TPP质量比的基础上,按“2.4.2”项下方法将适量的壳聚糖溶于1%醋酸溶液中,分别配制成质量浓度为5、4、3、2、1 mg/mL的壳聚糖溶液;对壳聚糖质量浓度进行考察,结果见表2。随着壳聚糖质量浓度的增加,平均粒径不断增大,而PDI先增大后减小,可能是当壳聚糖质量浓度较高时,较强的分子链间氢键结合力造成分子链间缠绕增加,使得交联时较多的分子链参与单一粒子的形成而得到微米级粒子。因此,选择质量浓度为1 mg/mL的壳聚糖溶液。

表2 不同壳聚糖质量浓度对CS NPs平均粒径和PDI的影响(, n = 3)
2.4.4 搅拌速度对CS NPs平均粒径和PDI的影响 取上述优化的实验条件以3∶1(壳聚糖∶TPP)的比例将TPP溶液逐滴滴加到不断搅拌的壳聚糖溶液中,室温下分别以200、300、400、500、600 r/min的转速搅拌10 min,对搅拌速度进行考察,结果见表3。随着搅拌速度的增大,平均粒径逐渐减小,而PDI先减小后增大,搅拌速度在600 r/min时粒径最小,此时体系中壳聚糖与TPP能够充分交联,因而选择搅拌速度为600 r/min。
2.4.5 搅拌时间对CS NPs平均粒径和PDI的影响 取上述优化的实验条件,室温下以600 r/min的速度分别搅拌2、5、10、15、20 min,对搅拌时间进行考察,结果见表4。随着搅拌时间的增加,CS NPs平均粒径和PDI均为先增大再减小再增大,而搅拌时间太短则不能使整个体系反应充分,搅拌时间太长则不利于体系的整体稳定。因此,搅拌时间选择10 min。
2.4.6 滴加速度对CS NPs平均粒径和PDI的影响 取上述优化的实验条件,将TPP溶液逐滴滴加到不断搅拌的壳聚糖溶液中,滴加速度分别为15、30、60、120、240 s/mL,室温下以600 r/min的速度分别搅拌10 min,对滴加速度进行考察,结果见表5。随着滴加时间的增加,平均粒径先减小再增大,再减小后增大,而PDI先减小再增大再减小,根据预试验的稳定性及平均粒径的变化情况来看,当滴加速度为60 s/mL时,整个体系的稳定性最佳,因而选择滴加速度为60 s/mL。

表3 不同搅拌速度对CS NPs平均粒径和PDI的影响(, n = 3)

表4 不同搅拌时间对CS NPs平均粒径和PDI的影响(, n = 3)

表5 不同滴加速度对CS NPs平均粒径和PDI的影响(, n = 3)
2.5 小檗碱-壳聚糖纳米粒(Ber-CS NPs)的制备
选择上述优化的实验条件,将小檗碱配制成质量浓度为1 mg/mL的溶液,再分别以小檗碱与载体质量比为1∶1、1∶2、1∶4、1∶6、1∶8制备Ber-CS NPs,平行实验3次,测定Ber-CS NPs平均粒径和PDI,结果见表6。随着小檗碱用量的增大,平均粒径逐渐增大,相较于空白组,平均粒径都略有增长,说明小檗碱进入了载体中,而载药比例将进行后续优化。

表6 不同小檗碱与载体比例对Ber-CS NPs平均粒径和PDI的影响(, n = 3)
2.6 Emo/HP-β-CD-Ber-CS NPs的制备
在上述Ber-CS NPs的基础上,加入EMO/HP- β-CD溶液,分别以药载比为1∶6、2∶6、3∶6的比例制备Emo/HP-β-CD-Ber-CS NPs,平行实验3次。测定其平均粒径和PDI,结果见表7,随着大黄素包合物用量的增加,平均粒径也逐渐增大,相较于空白组,平均粒径略有增大,说明大黄素包合物被载体包载,为确定合适的药载比,后续将进一步优化其比例。

表7 不同大黄素包合物与载体比例对Emo/HP-β-CD-Ber- CS NPs平均粒径和PDI的影响(, n = 3)
2.7 Emo/HP-β-CD-Ber-CS NPs制备工艺优化
2.7.1 Box-Behnken设计实验 为得到最佳的制备工艺,在结合文献和前期预试验的基础上,选择TPP与壳聚糖质量比(A)、小檗碱与载体质量比(B)以及Emo/HP-β-CD与载体质量比(C)为考察因素,以Box-Behnken响应面法优化其工艺参数,因素水平及实验结果见表8。以平均粒径(1)和PDI(2)的总评归一值(overall desirability,OD)为考察指标,1和22个指标取值均为越小越好,因此,选用d=(max-Y)/(max-min)和OD=(1×2…×d)1/k进行计算,得到OD=1.149 79-0.422 62 A-8.578 04 B+7.862 53 C+14.185 08 AB+21.741 36 AC+35.954 23 BC-13.458 54 A2-11.699 15 B2-48.071 86 C2,2=0.828 5,=0.047 4<0.05。拟合方程具有相关性和显著性。

表8 EMO/HP-β-CD-Ber-CS NPs制备工艺Box-Behnkn实验设计及结果
根据Box-Behnken效应面试验设计结果(图2),得到优化后的最优处方为TPP与壳聚糖质量比为0.25,小檗碱与载体质量比为0.17,Emo/HP-β-CD与载体质量比为0.21,为了便于称量和计算,修正处方为小檗碱与载体质量比为0.166,Emo/HP-β-CD与载体质量比为0.2。
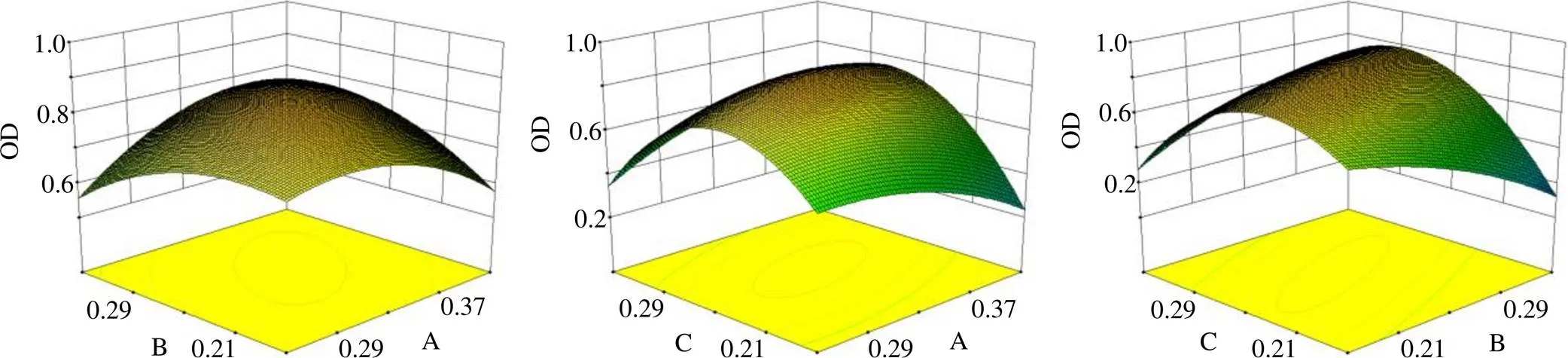
图2 A、B、C对OD值影响的效应曲面图
2.7.2 处方验证试验 根据上述修正的最优处方,平行制备3批EMO/HP-β-CD-Ber-CS NPs,结果见图3。测得平均粒径为(178.0±2.0)nm,PDI为0.187±0.006,平均OD值为0.953 6,预测OD值为0.974 6,Zeta电位为(11.02±0.03)mV,各实测值与预测值接近,说明采用OD法得到的回归方程预测性良好,处方的优化较为理想。
2.8 载药纳米粒稳定性考察
将制备的Emo/HP-β-CD-Ber-CS NPs混悬液分别保存于4 ℃冰箱与室温(温度为18~25 ℃)条件下,分别在0、1~7、9 d定时取样测定其平均粒径及PDI大小变化,考察其稳定性。结果见表9。经过考察发现,保存于4 ℃冰箱和室温中的纳米粒外观没有太大变化,仍是淡蓝色乳光的胶体溶液。由表10可知,冰箱中Emo/HP-β-CD-Ber-CS NPs测得的平均粒径和PDI各项指标变化不大,说明Emo/ HP-β-CD-Ber-CS NPs在9 d内4 ℃条件下稳定性良好。但室温下测得的Emo/HP-β-CD-Ber-CS NPs的平均粒径和PDI发生明显变化,且总体上呈现逐渐增大的趋势。所以纳米粒胶体溶液应保存于低温条件下,低温条件下,载药纳米粒具有一定的稳定性。但后续长时间的物理稳定效果仍需进一步考察。

图3 采用最佳制备工艺制备的Emo/HP-β-CD-Ber-CS NPs的粒径
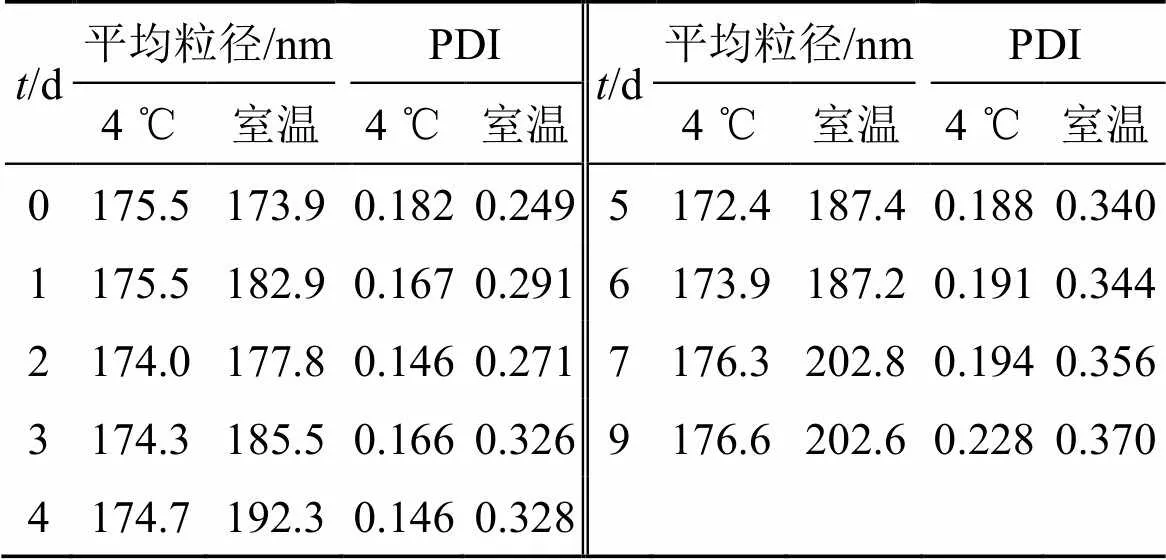
表9 4 ℃和室温下纳米粒的稳定性(n = 3)
2.9 Emo/HP-β-CD-Ber-CS NPs冻干粉的制备
2.9.1 冻干保护剂种类的考察 按最优处方制备纳米粒,分别加入6%的常用冻干保护剂山梨醇、甘露醇、乳糖、葡萄糖制备冻干粉,并设置空白对照组,然后全部置于冻干容器中,置−55 ℃冷冻干燥机中预冻12 h,再减压冷冻干燥48 h,即得Emo/ HP-β-CD-Ber-CS NPs冻干粉。将所得冻干制剂加适量去离子水复溶,测试其平均粒径和PDI,考察不同种类冻干保护剂对纳米粒的保护作用。通过表10可以看出,未加冻干保护剂的空白组冻干粉质地相对粗糙,复溶后粒径增大最为明显。以葡萄糖作为冻干保护剂时,冻干粉外观形状良好,稍有黏性,复溶迅速。因此考虑选择葡萄糖作为冻干保护剂,再进行后续用量考察。

表10 冻干保护剂种类对冻干粉外观及平均粒径和PDI的影响 (, n = 3)
2.9.2 冻干保护剂葡萄糖用量的考察 按最优处方制备纳米粒,分别加入2%、4%、6%、8%的葡萄糖,空白组不加冻干保护剂。通过冷冻干燥法制备冻干制剂,考察各组制剂的冻干效果。将所得冻干制剂加适量去离子水复溶,测试其平均粒径和PDI,考察不同用量葡萄糖对纳米粒的保护作用。通过表11可以看出,当加入6%的葡萄糖,冻干粉表面较为均匀,无坍塌稍有黏性,加入去离子水后能迅速复溶。综合考虑,选用6%的葡萄糖作为冻干保护剂,可用于制剂的后续研究。

表11 不同葡萄糖用量对Emo/HP-β-CD-Ber-CS NPs平均粒径和PDI的影响(, n = 3)
2.10 Emo/HP-β-CD-Ber-CS NPs冻干粉的表征
2.10.1 SEM观察形态 分别取适量大黄素和小檗碱原料药以及Emo/HP-β-CD-Ber-CS NPs冻干粉,黏附于样品池上,表层减压喷金处理以增加其电导率,于SEM下观察其形态,结果见图4。由图4可知,大黄素原料药为大小不均匀的块状,杂乱无章;小檗碱原料药大小不一,表面粗糙;而Emo/HP-β- CD-Ber-CS NPs冻干粉为大小较均匀的棒状,表面较为光滑。
2.10.2 红外光谱(FT-IR)检测 取大黄素原料药、小檗碱原料药、物理混合物和Emo/HP-β-CD-Ber-CSNPs冻干粉作为样品,与KBr混合压片,分别在4000~400 cm−1扫描,进行FT-IR分析,结果见图5。小檗碱原料药在1 567.91、1 504.26 cm−1具有明显的特征峰,而大黄素原料药在1 473.27、1 272.85 cm−1处显示特征峰,物理混合物和Emo/HP-β-CD- Ber-CS NPs冻干粉均保留了大黄素和小檗碱的特征峰,且未出现新的吸收峰,表明大黄素和小檗碱在纳米粒中化学结构并未改变。

图4 大黄素原料药、小檗碱原料药和Emo/HP-β-CD-Ber-CS NPs冻干粉

图5 小檗碱原料药(a)、大黄素原料药(b)、小檗碱和大黄素物理混合物(c)、Emo/HP-β-CD-Ber-CS NPs冻干粉(d) 的FT-IR
2.11 体外溶出度的测定
按《中国药典》2020年版四部项下第二法(桨法)进行溶出度测定,称取等量Emo/HP-β-CD-Ber- CS NPs冻干粉与大黄素、小檗碱原料药,以900 mL磷酸盐缓冲液(pH 6.8)为介质,控制实验温度为(37.0±0.5)℃,转速100 r/min,分别于5、20、40、60、120 min取样5 mL(补足同温等量介质),经0.45 µm微孔滤膜滤过,照HPLC法分别测定其峰面积,计算药物溶出度,并绘制溶出曲线,结果见图6。由图可知,冻干粉中,大黄素和小檗碱在120 min时的溶出率分别达到了72.12%和82.55%,而大黄素和小檗碱原料药的溶出率不超过25%,具有显著差异性,说明大黄素和小檗碱制成冻干粉能提高其体外溶出度。
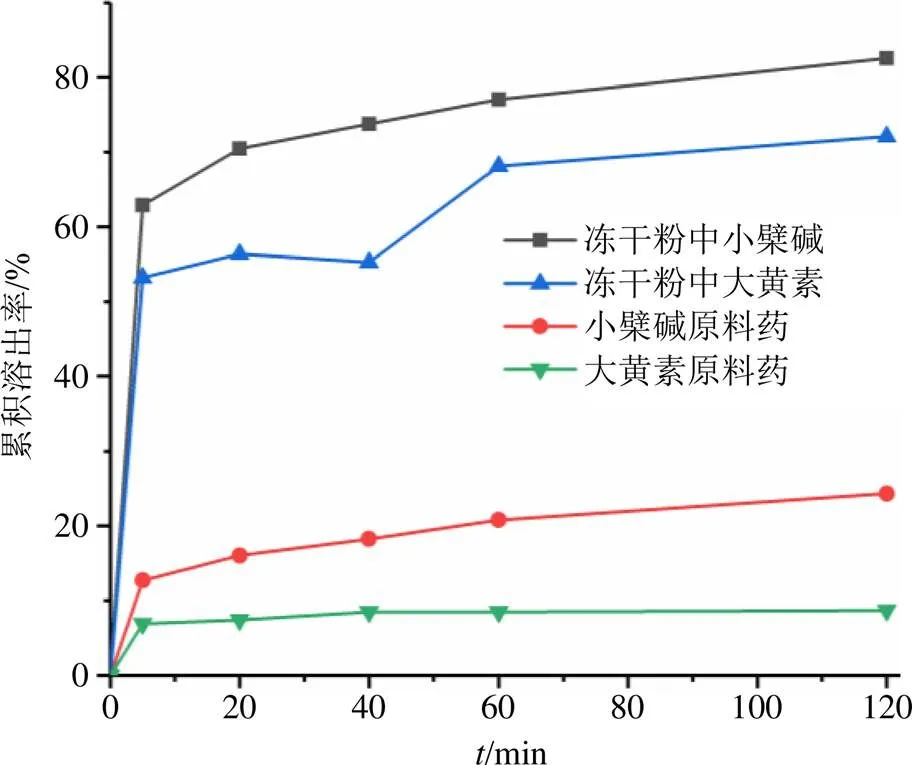
图6 Emo/HP-β-CD-Ber-CS NPs冻干粉和大黄素、小檗碱原料药的溶出曲线
2.12 载药量及溶解度的测定
取适量纳米粒冻干粉,甲醇超声溶解,经0.22 μm微孔滤膜滤过,按照“2.2”项下色谱条件测定,计算载药量(载药量=药/总,其中药为大黄素或小檗碱的实际测得量,总为冻干粉总质量),根据测得值计算得出,小檗碱和大黄素的载药量分别为0.95%和0.34%。取过量大黄素、小檗碱原料药及纳米粒冻干粉,pH 6.8缓冲液溶解,经0.22 μm微孔滤膜滤过,按照“2.2”项下色谱条件测定,计算溶解度。根据测得值计算得出,大黄素和小檗碱原料药的溶解度分别为9.21 µg/mL和153.05 µg/mL,而纳米粒冻干粉中大黄素和小檗碱的溶解度分别为23.95 µg/mL和167.87 µg/mL,较其原料药,二者溶解度均有一定的增大。
3 讨论
口服缓释纳米粒是新一代亚微粒给药系统,壳聚糖是阳离子聚合物,因其具有生物可降解性、生物相容性及靶向性等特点,已成为纳米药物载体的研究热点[20-21],TPP是一种在水溶液中带负电荷的小分子阴离子化合物,壳聚糖中带正电的基团与TPP中带负电的基团通过静电作用相互吸引,壳聚糖长链就团聚形成纳米粒,所以壳聚糖与TPP的比例是形成纳米粒的关键之一。当壳聚糖量较大时,TPP相对不足,不能交联成球;而壳聚糖量的减小,黏度降低,分散的长链和适当的TPP含量有利于壳聚糖分子交联成球;当壳聚糖量较小,而TPP相对含量较高时,壳聚糖表面游离氨基数目减少,电荷逐渐接近于零,整个体系失去静电排斥作用而团聚进而发生沉淀[22-23]。小檗碱带正电荷,与壳聚糖及TPP以静电吸附的方式而结合,大黄素被HP-β-CD包合形成包合物后,以空间作用与空白纳米粒结合,从而形成双载药纳米粒。搅拌速度适当时,制得纳米粒粒径分布较窄,而过于激烈时,较强的剪切力会破坏粒子间的静电斥力及水化层阻隔而造成粒子间聚集[22],本实验因未进行更大转速的考察而存在不足之处,后续应改进。
离子交联法作用时间短、条件较温和,未使用有机溶剂,未经历高温高压,对于所包载药物的生物性质影响较小,且易于得到较为稳定、均一的纳米粒。本研究以纳米粒的粒径和PDI为评价指标,通过单因素实验筛选出影响较大的3个因素,并通过3因素3水平的Box-Behnken效应面法优化得到最终处方。处方验证试验证实,该最优处方使纳米粒粒径和PDI均较小,且增加了大黄素与小檗碱的溶解度。以6%葡萄糖为保护剂所得到的冻干粉表面较为平整,质地均一。
载药纳米粒中小檗碱与大黄素的载药量的比例约为3∶1,这与张仲景所著《金匮要略》的大泻心汤中的黄连-大黄3∶1的用药比例相吻合,基本符合经方中记载的用药比例,相较于目前的上市产品一清胶囊中大黄-黄连3∶1的用量,纳米粒与其用量有一定的差异。然而大黄黄连临床使用广泛,常以不同的剂量和炮制品相须配伍使用[24],因此二者用药比例不尽相同。
综上,本研究较好的解决了大黄素与小檗碱难溶性的问题,实现了二者的共同载药,制得的冻干粉增加了其纳米粒的稳定性并提高其溶出度,复溶效果较好,为后续相关制剂的研究奠定了基础,但对其生物利用度能否提高仍需进一步进行研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Lin C C, Chang C H, Yang J J,. Hepatoprotective effects of emodin from[J]., 1996, 52(2): 107-111.
[2] Chang C H, Lin C C, Yang J J,. Anti-inflammatory effects of emodin from[J]., 1996, 24(2): 139-142.
[3] Feng Y, Huang S L, Dou W,. Emodin, a natural product, selectively inhibits 11beta-hydroxysteroid dehydrogenase type 1 and ameliorates metabolic disorder in diet-induced obese mice [J]., 2010, 161(1): 113-126.
[4] Goel R K, Das Gupta G, Ram S N,. Antiulcerogenic and anti-inflammatory effects of emodin, isolated fromWall [J]., 1991, 29(3): 230-232.
[5] Kuo Y C, Meng H C, Tsai W J. Regulation of cell proliferation, inflammatory cytokine production and calcium mobilization in primary human T lymphocytes by emodin fromOhwi [J]., 2001, 50(2): 73-82.
[6] Garg A K, Buchholz T A, Aggarwal B B. Chemosensitization and radiosensitization of tumors by plant polyphenols [J]., 2005, 7(11/12): 1630-1647.
[7] 马林, 刘小翠, 邓斌. 小檗碱通过影响糖原结构调节肝糖代谢研究 [J]. 中草药, 2020, 51(16): 4259-4265.
[8] 刘昊, 周志斌. 小檗碱调脂的研究进展 [J]. 药物评价研究, 2019, 42(8): 1676-1679.
[9] 曹力凡, 周纲, 杨建设, 等. 盐析法制备小檗碱壳聚糖纳米载药微球 [J]. 中国实验方剂学杂志, 2014, 20(1): 5-8.
[10] 孟治平, 路曼琪, 苏文强, 等. 盐酸小檗碱粉雾剂的制备及其对金黄色葡萄球菌肺炎的作用研究 [J]. 中草药, 2020, 50(2): 348-355.
[11] 郭江红, 任刚, 蒋建东. 小檗碱通过改善代谢水平抗肝细胞癌的研究进展 [J]. 现代药物与临床, 2018, 33(3): 703-708.
[12] 孙强, 何曼, 张梦, 等. 小檗碱抗肿瘤作用机制的研究进展 [J]. 中草药, 2021, 52(2): 603-612.
[13] 林爱华, 李鸿燕, 刘奕明, 等. 小檗碱壳聚糖纳米粒的制备及其体外释药特性研究 [J]. 中国药房, 2007, 18(10): 755-757.
[14] Ponnusamy L, Kothandan G, Manoharan R. Berberine and emodin abrogates breast cancer growth and facilitates apoptosis through inactivation of SIK3-induced mTOR and Akt signaling pathway [J]., 2020, 1866(11): doi: 10.1016/j.bbadis.2020.165897.
[15] Harata K. The structure of the cyclodextrin complex. IV. the crystal structure of α-cyclodextrin-sodium 1-propanesulfonate nonahydrate [J]., 1977, 50(5): 1259-1266.
[16] Manka J S, Lawrence D S. Template-driven self-assembly of a porphyrin-containing supramolecular complex [J]., 1990, 112(6): 2440-2442.
[17] Zhang J, Chen X G, Sun G Z,. Effect of molecular weight on the oleoyl-chitosan nanoparticles as carriers for doxorubicin [J]., 2010, 77(2): 125-130.
[18] 马祖兵, 李小芳, 谢龙, 等. 大黄素自微乳-微丸的制备及其体外评价 [J]. 中药材, 2019, 42(1): 144-149.
[19] 田雁钰. HPLC法同时测定小儿肺热平胶囊中两组分含量 [J]. 中国药师, 2010, 13(9): 1350-1351.
[20] Fan W, Yan W, Xu Z S,. Formation mechanism of monodisperse, low molecular weight chitosan nanoparticles by ionic gelation technique [J]., 2012, 90: 21-27.
[21] 陈田娥, 王鸽, 陈敏婷, 等. TPGS-壳聚糖载紫杉醇胶束的制备及大鼠在体肠吸收研究 [J]. 中草药, 2018, 49(24): 5780-5786.
[22] Wang X M, Chi N, Tang X. Preparation of estradiol chitosan nanoparticles for improving nasal absorption and brain targeting [J]., 2008, 70(3): 735-740.
[23] Vila A, Sánchez A, Janes K,. Low molecular weight chitosan nanoparticles as new carriers for nasal vaccine delivery in mice [J]., 2004, 57(1):123-131.
[24] 张薛光. 谈谈对《金匮要略》泻心汤出处、方名的理解 [J]. 中医文献杂志, 2007, 25(3): 9-12.
Optimization of prescription process of emodin/berberine chitosan dual drug-loaded nanoparticles by Box-Behnken response surface method
XIE Qing-xuan, LI Xiao-fang, XIE Long, WANG Xian, CAO Yi, LIANG You-dan
Key Laboratory of Standardization of Chinese Herbal Medicine, Ministry of Education, Sichuan Key Laboratory of Research and Utilization of Chinese Medicine Resources, Key Laboratory Breeding Base of Co-founded by Sichuan Province and Ministry of Science and Technology, College of Pharmacy, Chengdu University of Traditional Chinese Medicine,Chengdu 611137, China
To optimize the preparation process and formulation of emodin (Emo) and berberine (Ber) chitosan (CS) dual drug-loaded nanoparticles, and investigate its stability and dissolution.Using CS as the carrier and sodium tripolyphosphate (TPP) as the cross-linking agent, emodin/hydroxypropyl-β-cyclodextrin (HP-β-CD) and Ber were encapsulated by ion cross-linking method to obtain drug-loaded nanoparticles (Emo/HP-β-CD-Ber-CS NPs). Then, with particle size and polydispersity index (PDI) as independent variables, data processing was performed using the overall desirability value method, and the Box-Behnken effect surface method was used to optimize the prescription and verify it. Finally, a preliminary screening of the optimal freeze-drying conditions of the nanoparticles was carried out,and the type and dosage of lyoprotectants was investigated.The optimized preparation process was as follows: mass ratio of TPP to CS was 3:1, Ber to carrier was 0.166:1, and Emo/HP-β-CD to carrier was 0.2:1. The measured average particle size was (178.0 ± 2.0) nm, PDI was 0.187 ± 0.006, and the average OD value was 0.953 6. The measured value was close to the predicted value. The drug loading of Emo and Ber were 0.34% and 0.95, respectively. Stability investigation showed that the nanoparticles colloidal solution was physically stable when stored at 4 ℃ within 9 d. And the freeze-dried formulation prepared with 6% glucose as the protective agent had better effect and rapid reconstitution. The average particle size after redispersion was (161.8 ± 4.8) nm,and PDI was 0.263 ± 0.047.release studies have shown that the solubility and dissolution of drug-loaded nanoparticle freeze-dried powder were significantly improved.The model established by the Box-Behnken response surface method can be used to optimize the formulation of Emo/HP-β-CD-Ber-CS NPs with high accuracy and good prediction effect. And the preparation process of Emo/HP-β-CD-Ber-CS NPs is stable and feasible.
emodin; hydroxypropyl-β-cyclodextrin; berberine; chitosan; nanoparticles; Box-Behnken response surface method; overall desirability value; ion cross-linking method
R283.6
A
0253 - 2670(2021)06 - 1614 - 09
10.7501/j.issn.0253-2670.2021.06.009
2020-10-10
四川省科技厅项目(2019YFS0113);国家中医药管理局项目(2018YZ03002);四川省科技厅苗子工程委员会(2020095)
谢青璇(1996—),女,硕士研究生,研究方向为中药新制剂、新剂型、新技术。Tel: 18375760856 E-mail: 635544103@qq.com
李小芳(1964—),女,博士生导师,研究方向为中药新剂型、新制剂、新技术。Tel: 13808195110 E-mail: lixiaofang@cdutcm.edu.cn
[责任编辑 郑礼胜]
