氟硅酸钾滴定法测定锌精矿中的SiO2
2021-03-16丁晓彤
丁晓彤
(山东省冶金科学研究院有限公司,山东 济南250014)
1 前 言
随着我国冶炼产能的不断增加,各个企业对于锌精矿的需求量越来越大[1]。锌精矿作为一种非常重要的工业生产原料,其质量直接关系到冶炼企业利润空间。锌精矿中含有的SiO2会影响其产品质量,因此,为了提高冶炼产品品质,需加强对锌精矿中SiO2含量的测定与分析。常用的SiO2分析方法有高氯酸脱水重量法、动物胶凝聚法、硅钼蓝分光光度法、X 荧光光谱法、氟硅酸钾滴定法等[2-6]。其中,动物胶凝聚法分析结果较为准确,但过程繁琐,耗时较长;硅钼蓝分光光度法溶样时间较长,显色液不稳定;X 荧光光谱法简单快速,但锌精矿成分复杂,干扰较多,分析结果不够准确可靠。对比较而言,氟硅酸钾滴定法操作简便,快速,准确性较好,能够满足要求[7]。
传统的氟硅酸钾滴定法采用的溶样方法多数为酸溶[8],溶样过程中使用大量氢氟酸,对人体的伤害较大,且锌精矿较为难溶,酸溶较难溶清[9]。本研究采用碱融的方法,以KOH 为熔剂于镍坩埚中650 ℃熔融试样,采用氟硅酸钾滴定法测定其中的SiO2,结果令人满意。
2 实验部分
2.1 试 剂
NaOH;KOH;KCl;邻苯二甲酸氢钾,基准试剂105 ℃烘干2 h;HNO3;盐酸(1+1);KF溶液200 g/L,称取100 g KF 溶于300 mL 水中,加入100 mL HNO3,用水稀释至500 mL,加入KCl 固体至饱和,混匀后干过滤至塑料瓶中备用;KCl 洗涤液5%,称取45 g KCl 溶于600 mL 水中,加入300 mL 无水乙醇,混匀;KCl-乙醇溶液,称取5 g KCl溶于50 mL水中,加入50 mL 乙醇混匀;酒石酸钾钠溶液10 g/L,称取10 g 酒石酸钾钠溶于1 L 水中,煮沸后加入5滴酚酞-乙醇溶液,用NaOH溶液(0.2 mol/L)中和至微红色;NaOH 标准滴定溶液0.1 mol/L,称取110 g NaOH 溶于100 mL 无CO2的水中,混匀后注入聚四氟乙烯容量瓶中,密闭放置至溶液清亮。用塑料量筒量取27 mL上述NaOH钠溶液的上清液,用无CO2的水稀释定容至5 L,混匀;NaOH溶液0.2 mol/L,用塑料量筒量取11 mL上述NaOH溶液的上清液,用无CO2的水稀释定容至1 L,混匀;酚酞-乙醇溶液10 g/L。实验用水为去离子水,所用试剂均为分析纯。
2.2 NaOH标准滴定溶液的标定
称取3 份0.750 0 g 邻苯二甲酸氢钾分别置于300 mL锥形瓶中,加入50 mL无CO2的水溶解,滴加2滴酚酞-乙醇溶液,用NaOH标准滴定溶液滴定至溶液呈粉红色并保持30 s 不褪色,记录滴定体积。随同做空白实验。标定结果计算公式为:
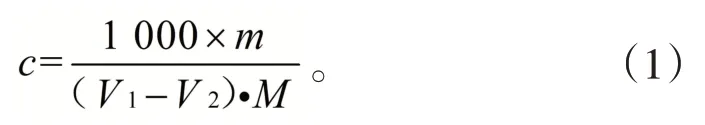
式中:c为NaOH 标准滴定溶液的实际浓度,mol/L;m为邻苯二甲酸氢钾的质量,g;V1为标定时,滴定邻苯二甲酸氢钾消耗的NaOH 标准滴定溶液的体积,mL;V2为标定时,滴定空白试剂溶液消耗的NaOH 标准滴定溶液的体积,mL;M为邻苯二甲酸氢钾的摩尔质量,204.22 g/mol。
取3次标定结果的平均值。
2.3 实验方法
准确称取0.2 g试样(精准至0.000 1 g)于30 mL镍坩埚中,加入2 g 固体KOH,电炉上加热熔融摇匀,移入650 ℃马弗炉中熔融10 min,取出冷却。将坩埚移入400 mL聚四氟乙烯烧杯中,加10 mL热水,盖上表面皿,待坩埚内的熔融物作用完毕后,将坩埚内的物质倒入聚四氟乙烯烧杯,沿坩埚壁滴加盐酸(1+1)清洗坩埚,用尽量少的热水洗净坩埚(控制总体积不要超过50 mL)。加入16 mL HNO3,混匀,冷却至室温,然后向溶液中加入固体KCl 至饱和,6 mL KF 溶液,振荡5 min 后静置10 min。用中速滤纸于塑料漏斗中过滤,KCl 洗涤液洗涤聚四氟乙烯烧杯及滤纸各3 次,弃去滤液,将滤纸及沉淀一同移入原聚四氟乙烯烧杯中。加入10 mL KCl-乙醇溶液,滴加20 滴酚酞乙醇溶液,用NaOH 溶液中和大部分游离酸,小心捣碎滤纸,以NaOH 标准滴定溶液滴至淡粉色,此时不计读数。加入150 mL煮沸的酒石酸钾钠溶液,趁热以NaOH标准滴定溶液滴定至微红色为终点,记录消耗的体积,按式(2)计算试样中硅的含量。
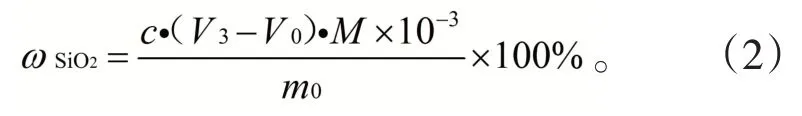
式中:c为NaOH标准滴定溶液的实际浓度,mol/L;V3为滴定试液消耗的NaOH标准滴定溶液的体积,mL;V3为滴定空白试剂溶液消耗的NaOH标准滴定溶液的体积,mL;M为1/4 SiO2的摩尔质量,15.02 g/mol;m0为试样的质量,g。
计算结果表示为小数点后两位。
3 结果与讨论
3.1 熔剂的选择
常见的碱金属氢氧化物NaOH 与KOH 熔剂均对SiO2的熔解力较强,但Na3AlF6与Na2TiF6在水中的溶解度均比相对应的K3AlF6与K2TiF6小的多。未溶于水的Na3AlF6与Na2TiF6沉淀,同K2SiF6沉淀一起于滤纸上,水解后生成氢氟酸,影响SiO2的测定。因此,选择KOH熔剂可降低Al、Ti对于测定产生的干扰。同时,KOH 熔剂进入试液后,经过HNO3酸化,成为H2SiF6的沉淀剂,有利于生成K2SiF6沉淀,因此,本实验选择KOH为熔剂。
3.2 熔样温度及条件
KOH熔剂较为活泼,易溢出,经实验表明,熔融温度为650 ℃,熔融时间为10 min较为合适。温度过高试样会溢出,温度过低需延长熔融时间。同时,在放入马弗炉熔融之前,必须于电炉上加热至熔融状态,否则650 ℃熔融时,试样易溢出坩埚,导致实验失败。
3.3 指示剂与试剂空白
滴定反应原理为中和反应,其滴定终点pH 值约为7.5~8.3,因此选择酚酞为指示剂,滴定至微红色为终点。因试剂质量问题等因素,可能存在空白值,因此随同试料做试剂空白。
4 样品分析
4.1 精密度实验
选择含量不同的锌精矿标准物质,按照本方法进行实验分析,结果见表1。从表中可以看出,测定结果的相对标准偏差(RSD,n=5)均≯0.36%。因此,本法测定锌精矿中SiO2重复性较好,精密度与准确度能够满足分析要求。
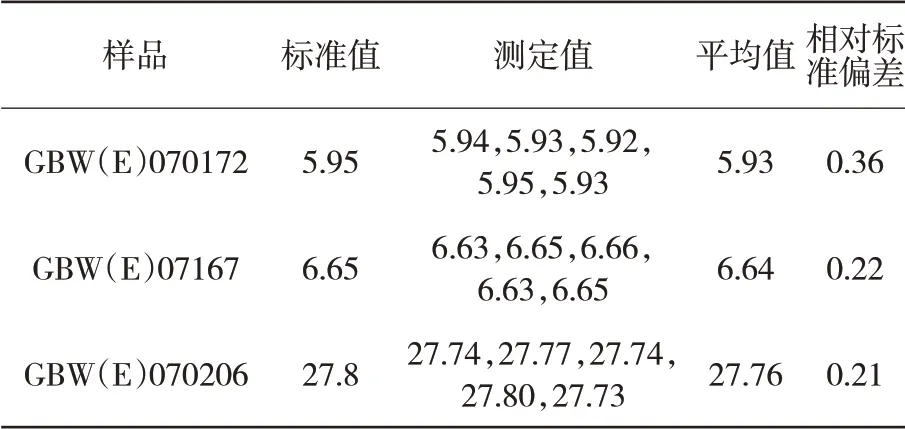
表1 锌精矿样品中SiO2含量的分析结果 %
4.2 比对实验
选择两个锌精矿样品,按照本方法测定其中的SiO2含量,并与按照国标方法钼蓝分光光度法测得的数值进行对比,结果见表2。分析可得,两种方法测得的结果相近,表明采用氟硅酸钾滴定法测定锌精矿中SiO2含量具有较高的准确性。
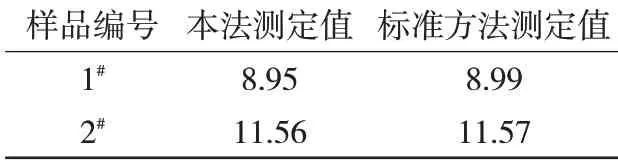
表2 对比实验结果%
4.3 加标回收实验
选择锌精矿标准物质GBW(E)07167 为基体,采用氟硅酸钾滴定法,分别加入不同量的SiO2标准溶液,进行加标回收实验,测定结果见表3。由表3可知,试液中不同含量的SiO2的加标回收率都能达到98%以上,结果令人满意。
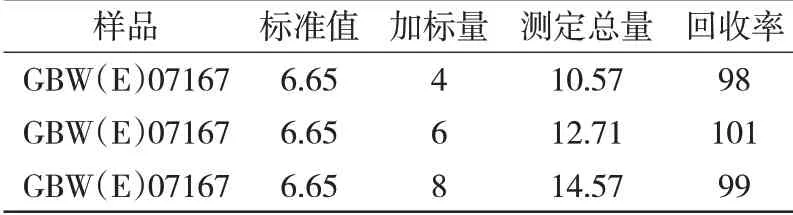
表3 锌精矿样品中SiO2加标回收分析结果 %
5 结 语
本研究采用氟硅酸钾滴定法测定锌精矿中SiO2的含量,样品经KOH 碱融后完全分解,测定结果的相对标准偏差(RSD,n=5)≯0.36%,经加标回收实验,加标回收率为98%~101%,测定结果较为满意。该方法能够满足锌精矿的分析要求,可用于实际样品分析。
