K-ras诱导细胞衰老与胃癌及癌前病变关系研究
2021-03-16张云清尹香利
王 洁,张云清,赵 斌,尹香利,2
(1.延安大学附属医院,陕西 延安 716000;2.渭南市中心医院,陕西 渭南 714000)
细胞衰老是导致衰老相关性疾病(包括慢性炎症和肿瘤)的主要机制,通过清除衰老细胞或调控衰老相关标志物治疗衰老相关性疾病和肿瘤正受到越来越多的关注。近年来,细胞培养和动物实验相继揭示了癌基因诱发的细胞衰老与肿瘤发生密切相关[1-5]。胃癌是全球高发肿瘤之一,严重威胁着人类的健康[6-9]。胃癌的发展是一个多因素、多步骤、多阶段的过程,细胞衰老与细胞增殖在其中起着重要的作用,P53、P16INK4a、衰老相关的β半乳糖苷酶(SA-β-Gal)是细胞衰老过程中重要的调控因子。K-ras是RAS基因家族成员之一,与肿瘤的发展及增殖有很大关系。本研究通过观察K-ras、P16INK4a、P53、SA-β-Gal等在胃癌及癌旁组织中的表达情况,分析K-ras能否诱导细胞衰老以及细胞衰老与癌前病变的关系。
1 资料与方法
1.1 一般资料 收集延安大学附属医院2016—2017年具有完整手术切除记录的138例胃管状腺癌患者的病理样本。其中,女性35例,男性103例;年龄38~90岁,中位年龄62岁,57例患者≤52岁,81例>52岁;57例发生于近端胃,81例发生于远端胃;肿瘤大小>5 cm者73例,≤5 cm者65例;高分化者25例,中分化者62例,低分化者51例;pTNM分期Ⅰ-Ⅱ期67例,Ⅲ期71例;发生淋巴结转移77例,无淋巴结转移61例;4例查见脉管内癌栓,5例查见周围神经侵犯。所有患者均为新诊断病例,且术前均未经过放化疗及免疫治疗。
1.2 主要试剂 K-ras(ab180772)、SA-β-Gal(ab4761)购自Abcam公司,P16INK4a、P53免疫组化Elivision试剂盒(2011099921H)及DAB显色剂购自福州迈新生物技术开发有限公司。
1.3 免疫组化染色 所有标本均经4%甲醛固定,常规脱水、透明、浸蜡,石蜡包埋,切片厚4 μm,柠檬酸缓冲液修复,EliVision二步法免疫组化染色所用P16INK4a、K-ras、SA-β-Gal抗体稀释滴度为1∶100,均设阳性与阴性对照。具体步骤:逐级脱蜡水化;柠檬酸缓冲液进行抗原修复;封酶水洗;一抗室温孵育60 min;二抗室温孵育15 min;DAB显色3~5 min;苏木素复染;脱水、透明和封片。
1.4 结果判定 每切片随机选取10个高倍视野,按视野中阳性细胞数占总细胞数的比例定义阳性与阴性。如果无阳性着色或阳性细胞数<10%,则定义为阴性染色;当阳性细胞数≥10%时,定义为阳性染色。K-ras以细胞膜和(或)细胞质出现棕黄色染色为阳性细胞;P53以细胞核出现棕黄色染色为阳性细胞;P16INK4a以细胞核和(或)细胞质出现棕黄色染色为阳性细胞;SA-β-Gal以细胞膜出现棕黄色染色为阳性细胞。
1.5 统计学方法 采用SPSS 17.0统计学软件对所得实验数据进行分析。胃癌及癌前病变组织中各项检测指标的差异、K-ras蛋白与衰老相关标记物(P16INK4a、P53、SA-β-Gal)的相关性分析采用卡方检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 胃癌及癌旁组织染色结果 HE染色结果显示:癌旁组织中胃黏膜固有腺减少,腺体之间间距增大,间质内出现不等量的淋巴细胞浸润,部分腺体发生了肠上皮化生,表现为慢性萎缩性胃炎(图1A);胃癌组织病理学表现为管状腺癌,高、中分化腺癌腺体可见不规则的腺管结构,低分化腺癌无明显腺管形成,癌细胞呈散在、巢状或线状排列,细胞异型性显著,可见核分裂像(图1B)。免疫组化染色结果显示:胃管状腺癌组织中K-ras阳性表达,呈细胞膜和(或)细胞质棕黄色染色(图1C);胃管状腺癌组织中P53阳性表达,呈中-高强度细胞核棕黄色染色(图1D);P16INK4a蛋白阳性表达,腺管或癌细胞细胞核和(或)细胞质呈棕黄色颗粒状染色(图1E);胃管状腺癌组织中SA-β-Gal蛋白阳性表达,细胞膜呈棕黄色染色(图1F)。

注:A为癌旁组织HE染色;B为胃管状腺癌HE染色;C-F依次为胃管状腺癌K-ras、P53、P16INK4a及SA-β-Gal免疫组化染色(EliVision法)
2.2 胃癌与癌旁组织K-ras表达水平比较 胃癌组织中K-ras阳性表达者132例,阳性率为95.70%,癌旁组织中K-ras阳性表达者5例,阳性率仅为3.60%,两者比较具有统计学差异(χ2=233.77,P<0.05)。
2.3 胃癌组织中K-ras与P16INK4a、P53、SA-β-Gal相关性分析 见表1。胃癌组织中,K-ras阳性组P53、SA-β-Gal、P16INK4a阳性表达率均明显高于K-ras阴性组(均P<0.05),提示癌组织中K-ras基因可能诱导细胞衰老。

表1 胃癌组织中K-ras与P16INK4a、P53、SA-β-Gal相关性分析[例(%)]
2.4 癌旁组织中K-ras与P16INK4a、P53、SA-β-Gal相关性分析 见表2。癌旁组织中,K-ras阳性组P53、SA-β-Gal、P16INK4a阳性表达率均显著高于K-ras阴性组(均P<0.05),提示在胃癌的癌前病变中也存在由K-ras诱导的细胞衰老现象。
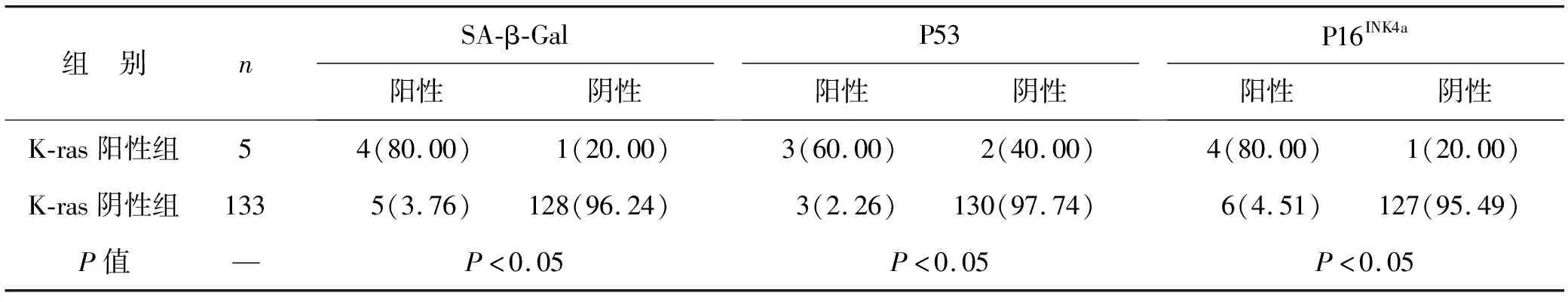
表2 癌旁组织中K-ras与P16INK4a、P53、SA-β-Gal相关性分析[例(%)]
3 讨 论
本研究检测了K-ras以及细胞衰老标志物P53、P16INK4a、SA-β-Gal在胃癌组织及癌前病变组织中的表达。研究结果显示,胃癌组织K-ras的表达显著高于癌前病变,说明癌基因K-ras的激活可能参与胃癌的发生及发展过程。此外,K-ras阳性组衰老相关指标物P53、P16INK4a、SA-β-Gal的表达均显著高于K-ras阴性组,表明胃癌组织中的K-ras基因可以诱导细胞发生衰老。因此,K-ras相关的细胞衰老对胃癌的发生和发展具有推波助澜的作用。
癌基因表达不断增加及其蛋白质产物的累积与肿瘤发生、发展密切相关。研究[10]显示,RAS、Myc等癌基因过度表达可诱发细胞衰老和(或)细胞凋亡,诱发细胞进入非增殖但可存活的衰老状态,癌细胞可通过抑制细胞衰老或凋亡从而适应高水平的致癌信号传导,这种现象称为癌基因诱导的细胞衰老(OIS)。细胞衰老这一术语是Hayflick于1961年提出的,因体外细胞培养时发现细胞具有增殖极限的现象[11]。细胞衰老曾被认为是机体的一种自我防御和修复机制,原癌基因也可以激活DNA损伤反应来诱发细胞的衰老。
细胞周期抑制剂P16INK4a、P53与SA-β-Gal是常见的细胞衰老分子标志物。正常情况下,这些细胞周期抑制剂阳性表达可以通过P16INK4a/pRB、P53/P21[12]和Wnt[13]等信号通路发挥作用,进而抑制肿瘤的发生和发展。然而,当这些肿瘤抑制分子突变或失活后,若衰老细胞中受损DNA不能及时被修复,可使得部分衰老细胞获得恶性表型,从而诱发肿瘤发生与异常增殖。尽管本研究发现胃癌及癌前病变中均存在K-ras诱发的细胞衰老,但在胃癌组织中K-ras及细胞衰老相关标志物的阳性表达率高于癌前病变,间接表明了K-ras诱导的细胞衰老在慢性萎缩性胃炎、肠上皮化生等胃癌癌前病变胃黏膜腺体中持续存在,若能在合适的微观调控作用下使这些癌前病变腺上皮细胞高表达衰老相关标记物并诱导细胞发生凋亡,则将有望将肿瘤扼杀在萌芽阶段。
细胞衰老是一把双刃剑,正常情况下体内的衰老细胞可被巨噬细胞、中性粒细胞或自然杀伤细胞清除,永久性地从细胞周期中撤离,从而阻断了肿瘤的发生。但当这些衰老的细胞多年未被及时地清除而保持衰老状态时,这些衰老细胞将伴随着年龄的增长而逐渐累积,一旦有机会重新进入细胞周期,将会诱发肿瘤的发生[14]。研究[15-17]发现,细胞衰老诱导的致癌机制可能与衰老细胞产生的一系列可溶性细胞因子相关,如血管内皮生长因子(VEGF)、基质金属蛋白酶-3(MMP-3)等,此类细胞因子免疫表型的改变可能通过上皮-间叶转化使得肿瘤细胞的侵袭性显著增强。鉴于此原因,未来临床医生除对肿瘤进行放化疗外,有望通过清除机体中的衰老细胞从而达到延缓或阻止肿瘤发生与发展的目的,同时也可延长患者的寿命。积累的衰老细胞若不能及时有效地加以清除,也将有可能成为细胞恶性转变的保护伞和屏障[18]。
综上所述,K-ras诱导的细胞衰老与胃癌发生与发展密切相关。细胞衰老诱导肿瘤发生的双向作用给临床肿瘤治疗工作提出了严峻挑战,科技工作者要充分探索不同肿瘤中细胞衰老的形成、维持和阻断的分子机制,为抗肿瘤治疗提供合理的策略。
