卷曲蛋白8在胃癌BGC823细胞中的表达及其对胃癌细胞迁移、侵袭的影响
2021-03-16宋香妮陈瑶莉穆金姬
宋香妮,陈瑶莉,杨 剑,穆金姬
(铜川市人民医院消化内科,陕西 铜川 727000)
胃癌是常见的消化道恶性肿瘤,严重影响人们的身心健康[1-3]。近年来科学技术的进步、手术方法的改进、免疫治疗及新辅助化疗的广泛应用大大提高了胃癌患者的预后,但是胃癌患者术后5年生存率仍然较低[4-7]。胃癌细胞的侵袭和转移是胃癌患者死亡的主要原因[1],因此了解胃癌发生与发展的分子机制对胃癌的治疗及预后非常重要。卷曲蛋白8(Frizzled 8,FZD8)是Wnt家族的受体之一,是一种7次跨膜蛋白,结构类似于G蛋白偶联型受体。FZD8参与体内多种生理和病理过程,在人类肺癌、口腔癌、急性淋巴细胞白血病、前列腺癌等多种肿瘤中参与细胞增殖及恶性转移[8-10]。Demirci等[11]使用qRT-PCR方法检测到FZD8在胃癌组织中高表达,并与胃癌的转移相关。但FZD8在胃癌中的作用机制尚未完全阐明。本研究旨在检测FZD8在人胃癌细胞株BGC823细胞中的表达水平,并通过沉默人胃癌细胞株BGC823细胞中的FZD8来评价其对BGC823细胞迁移和侵袭的影响,总结其潜在作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞:人胃癌细胞BGC823细胞和人胃黏膜上皮细胞GES1购于中国科学院上海细胞库,在含10%胎牛血清(FBS)的RPMI-1640培养液中,于37 ℃、5% CO2恒温培养箱中传代培养,细胞进入对数生长期即可收割用于实验。
1.1.2 主要试剂:Trizol试剂购自上海碧云天生物技术研究所;慢病毒(批号:JRR041B)购自中国吉凯生物有限公司;逆转录试剂盒(批号:DCR048A)购自日本Takara公司;电化学发光(ECL)系统购自康为世纪生物有限责任公司;兔抗人FZD8、β-actin抗体和羊抗兔荧光素标记的IgG抗体购自美国Santa公司;基质胶购自美国 BD Biosciences公司;Transwell小室购自美国Corning公司;BCA蛋白定量试剂盒购自康为世纪生物有限责任公司。
1.2 实验方法 用慢病毒介导的shRNA转染BGC823细胞,建立稳定的FZD8基因敲减细胞(shFZD8)[12],采用Western blot和实时荧光定量PCR验证,并进行Transwell迁移和侵袭实验。
1.2.1 实时荧光定量PCR检测mRNA水平:用TrIzol试剂提取细胞总RNA,用逆转录试剂盒逆转录为cDNA。PCR循环扩增,内参为甘油醛-3-磷酸脱氢酶(GAPDH)。GAPDH基因上游引物序列为5’-AGCDACTCCTCCACCTTTG-3’,下游引物序列为5’-CACAACCCTGTTGCTGTAT-3’。FZD8基因上游引物序列为5’-TCGCAGCCTCCGGGTG-3’,下游引物序列为5’-TGTCTGTGCTCATAGCCTGG-3’[13]。
1.2.2 Western blot检测蛋白表达水平:蛋白质裂解缓冲液裂解提取细胞总蛋白质。按照BCA蛋白定量试剂盒的标准操作进行蛋白定量,并稀释到相同浓度。各组蛋白样品与蛋白上样缓冲液混合后,100 ℃下煮沸10 min,加入到配置好的10%和5% SDS-PAGE中进行电泳。电泳结束后,100 V电压湿转1 h,切胶,蛋白转到PVDF膜上,5%脱脂奶粉封闭1 h,分别加入兔抗人FZD8抗体(1∶1000稀释)和兔抗人β-actin抗体(1∶1000稀释),4 ℃孵育过夜,并用TBST清洗3次,每次10 min,羊抗兔荧光素标记的IgG(1∶10000稀释)室温孵育1 h,TBST清洗3次。采用电化学发光系统显影,用Bio-Rad成像系统采集图像并对图像进行灰度分析。
1.2.3 Transwell迁移实验:收集对数生长细胞,PBS洗涤2次。用无血清培养基重悬细胞,进行细胞计数,然后稀释浓度至1×105/ml,用移液器给每孔加200 μl细胞悬液到Transwell小室的上室,下层小室加入0.5 ml 含10%胎牛血清的培养基。每组设3个重复孔。37 ℃培养箱中培养36 h后取出Transwell小室,PBS轻轻淋洗3遍,用棉签轻轻拭去小室上室中的细胞,95%乙醇固定5 min,用滴管加入4 g/L结晶紫染色10 min。PBS轻轻淋洗3遍,显微镜下观察穿过膜的细胞并随机取8个视野计数。实验重复3次。
1.2.4 Transwell侵袭实验:将基质胶和无血清培养基按照1∶8比例稀释并混合,加入到Transwell小室中,每孔50 μl,于37 ℃培养箱中固化。其余步骤同迁移实验。实验重复3次。
1.3 统计学方法 采用GraphPad Prism 8.0统计学软件处理数据。计数资料比较采用χ2检验,计量资料比较采用t检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 BGC823和GES1细胞FZD8蛋白及mRNA表达水平比较 见图1。与GES1细胞相比,BGC823细胞FZD8 mRNA和蛋白的表达水平均明显增高(t=6.379、7.972,均P<0.01),分别约为前者的2.8倍和2.4倍。
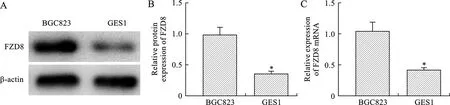
注:与BGC823细胞比较,*P<0.01
2.2 BGC823细胞FZD8基因沉默验证 见图2。Western blot和PCR检测结果显示,相比于对照组(未沉默FZD8基因的BGC823细胞),shFZD8组细胞中FZD8蛋白及mRNA表达水平均明显降低(t=6.366、5.803,均P<0.01)。

注:与对照组比较,*P<0.01
2.3 沉默FZD8基因对BGC823细胞侵袭、迁移能力的影响 见图3。Transwell侵袭和迁移实验结果显示,对照组穿膜细胞数分别为(110.7±12.4)个和(121.6±13.8)个,shFZD8组穿膜细胞数分别为(42.3±10.2)个和(56.4±9.6)个。与对照组相比,shFZD8组穿膜细胞数明显减少(t=4.668、9.500,均P<0.01)。

注:与对照组比较,*P<0.01
3 讨 论
胃癌是全球常见的恶性肿瘤之一。近年来,内镜检查的普及与早癌诊疗技术的开展大大提高了早期胃癌患者的生存率,但胃癌早期症状并不典型,大多数胃癌患者被诊断时已发生转移,导致中晚期胃癌具有较高的死亡率[14-15]。因此,探究胃癌早期病变指标,探讨胃癌发生、发展的相关机制,对改善胃癌患者预后尤为重要。
FZD8是Wnt家族的受体之一,为一种7次跨膜蛋白,结构类似于G蛋白偶联型受体。FZD8参与多种人体生理过程,如参与胚胎时期形态发生,维持原始造血干细胞静息状态下的功能[16-17]。同时,FZD8在包括肿瘤、耐药等病理过程中发挥着重要作用[9-10,17]。张焕新[12]研究发现FZD8在费城染色体阳性急性淋巴细胞白血病细胞中表达,而在正常人外周单核细胞中并未发现FZD8表达,进一步研究发现FZD8通过非经典Wnt/β-catenin信号通路来实现白血病细胞对化疗药的耐药。Yang等[8]报道FZD8在肾细胞癌组织中高表达,并通过非经典Wnt信号通路促进肾癌细胞异常增殖及转移。Li等[9]研究发现,过表达FZD8可以促进肿瘤细胞的增殖与转移,并且通过激活经典的Wnt/β-catenin信号促进前列腺癌骨转移。
FZD8也可以作为分子靶点在肿瘤发生、发展中发挥重要作用。Liu等[18]报道miRNA-99b-5p通过直接作用FZD8激活Wnt/β-catenin信号通路,从而抑制非小细胞肺癌细胞的增殖、迁移和侵袭。编码转录因子基因ERG可以直接作用于FZD8,从而促进前列腺癌的发生与发展。Demirci等[11]使用qRT-PCR方法检测胃癌和癌旁组织中FZD8的表达,发现其在胃癌组织中高表达,胃癌转移组FZD8表达明显高于非转移组,提示FZD8可能是胃癌的新生标志物。但FZD8的表达水平是否影响胃癌的发生、发展及其机制尚不明确。
本研究首先检测人胃癌BGC823细胞和人胃黏膜上皮GES1细胞FZD8表达水平,通过筛选出能够稳定敲减FZD8的BGC823 细胞株探讨FZD8敲减对人胃癌BGC823细胞侵袭及迁移能力的影响。结果显示,人胃癌BGC823细胞中FZD8 mRNA及蛋白表达水平明显高于人胃黏膜上皮GES1细胞。沉默FZD8的BGC823细胞中FZD8 mRNA及蛋白表达含量明显低于对照组,提示敲减FZD8后的BGC823细胞可以稳定地下调FZD8的表达,能够用于后续实验研究。Transwell迁移实验和侵袭实验结果显示shFZD8组细胞的迁移和侵袭能力显著低于对照组,说明沉默FZD8基因能够显著抑制人胃癌BGC823细胞的迁移和侵袭能力。
综上所述,FZD8在胃癌细胞中高表达,敲减人胃癌细胞株BGC823细胞中的FZD8可以抑制BGC823细胞的迁移和侵袭能力。FZD8作为促癌基因,对其结构及功能的认识有望为胃癌的防治及预后提供新思路。但是,本研究只是初步探索了FZD8在BGC823细胞中的作用,在后续的研究工作中,我们还需要完善其他生物学功能检测(细胞周期、增殖、凋亡、耐药等),并且从细胞水平和动物水平探索FZD8在胃癌中的具体作用机制。
