环状RNA hsa_circ_103809在骨肉瘤中的表达及生物学作用实验研究
2021-03-16张开亮关国锋
张开亮,韩 康,张 勇,陈 明,关国锋
(1.解放军第960医院泰安医疗区,山东 泰安 271000;2.解放军第960医院济南医疗区,山东 济南 250000;3.解放军联勤保障部队北戴河康复疗养中心,山东 秦皇岛 066100;4.空军军医大学唐都医院骨科,陕西 西安 710038;5.滨州医学院附属医院足踝外科,山东 滨州 256600)
骨肉瘤是常见的原发性骨恶性肿瘤[1]。然而,令人遗憾的是,骨肉瘤的治疗在近几十年来并未取得明显进展。其治疗方案目前包括新辅助化疗、手术治疗和术后化疗,患者5年生存率仍只有60%左右[2]。发生转移的患者预后更差[3]。因此,急需寻找新的治疗方案或靶点来提高骨肉瘤患者的预后。研究[3-5]表明,异常表达的环状RNA(Circular RNA,circRNA)存在于多种肿瘤中,这意味着circRNA在肿瘤的发生和发展中可能扮演重要角色,有可能成为肿瘤治疗的靶点和诊断指标。此外,多个异常表达的circRNA参与骨肉瘤的增殖、侵袭和迁移等生物学行为的调节[6-7]。hsa_circ_103809作为circRNA家族中的一员,已被证实可促进乳腺癌、肝细胞癌、肺癌、胃癌和膀胱癌等多种肿瘤细胞的增殖、侵袭或迁移,进而促进肿瘤的进展[8-12]。但其在骨肉瘤中是否同样具有促进作用,尚未见报道。本研究观察hsa_circ_103809对骨肉瘤细胞增殖、侵袭和迁移等生物学行为的影响,分析其表达水平与骨肉瘤临床参数的相关性,期望明确其在骨肉瘤中的作用,同时为骨肉瘤的临床治疗提供新的思路和靶点。
1 材料与方法
1.1 标本采集 40例骨肉瘤临床组织标本以及10例相应骨肉瘤瘤旁组织于2016年3月至2018年12月采集于唐都医院骨科。所有病例在标本采集前均未进行过放化疗,且标本采集前均取得患者同意并签署同意书。标本采集后立刻放入液氮罐保存。
1.2 细胞培养 人成骨细胞系hFOB1.19及人骨肉瘤细胞系MG63、Saos-2和143B均保存于唐都医院骨科全军骨肿瘤研究所。hFOB1.19细胞采用含有10%胎牛血清的DMEM/F12培养基进行培养。MG63和Saos-2细胞采用含有10%胎牛血清的DMEM培养基进行培养。143B细胞采用含有10%胎牛血清的MEM培养基进行培养。所有细胞均在含有5% CO2的37 ℃恒温培养箱进行培养。
1.3 细胞转染与分组 hsa_circ_103809 siRNA及其阴性对照(NC)序列(批号:R10043.8;广州锐博生物科技有限公司)的瞬时转染均采用Lipofectamine2000TM(批号:11668019;美国Invitrogen公司)进行。待6孔板内细胞汇合度为40%~50%时,采用100 nmol/L浓度进行转染。实验组转染hsa_circ_103809 siRNA,对照组转染siRNA NC。转染48 h后,收集细胞进行CCK-8和Transwell实验。
1.4 荧光定量PCR(qRT-PCR)检测 细胞及组织内RNA均采用TRIzol试剂(批号:T9424;美国Sigma公司)进行提取。提取RNA后,采用PrimeScript RT Reagent Kit(批号:RR037A;日本Takara公司)进行反转录合成cDNA。然后采用SYBR Premix Ex Taq(批号:RR420A;日本Takara公司)进行qRT-PCR检测。hsa_circ_103809正向引物序列为5’-ACGCATTCTTCGAGACCTCT-3’,反向引物序列为5’-TGC-CTGTAACTCCTCTTCAGT-3’。GAPDH正向引物序列为5’-GAAGGTGAAGGTCGGAGTC-3’,反向引物序列为5’-GAAGATGGTGATGGGATTTC-3’。相对表达量的计算以GAPDH为参照,采用2-△△CT方法进行。
1.5 CCK-8增殖实验 收集转染后细胞,以3000细胞/孔铺于96孔板,每组采用6复孔,共铺24、48、72、96 h四块板,每24 h取一块板,每孔加入10 μl CCK-8溶液(批号:CK04;日本同仁)。在细胞培养箱培养1 h后检测波长450 nm处的光密度(OD)值,然后绘制生长曲线。
1.6 Transwell侵袭实验 将Matrigel基质胶(批号:35623;美国BD公司)采用Opti-MEM(批号:31985070;美国Gibco公司)培养基以1∶8进行稀释,然后取50 μl铺于小室内并置于培养箱1 h后使其凝固。收集转染后细胞,采用相应无血清培养基进行重悬,计数后取5×104细胞添加至每小室上室,下室添加含有20%胎牛血清的相应培养基。18 h后取出小室,用95%乙醇固定,再用0.5%结晶紫溶液染色,通过树脂封片后进行观察计数。
1.7 Transwell迁移实验 上室不铺基质胶,经过12 h后取出小室,后续处理同1.6。
1.8 统计学方法 采用SPSS 22.0统计学软件进行分析,采用Graphpad Prism 7.0软件作图。CCK-8实验结果采用双因素方差分析,hsa_circ_103809表达水平与骨肉瘤临床参数的相关性分析采用Fisher确切概率法进行,骨肉瘤及瘤旁组织hsa_circ_103809表达水平比较采用配对t检验,其余实验采用独立样本t检验。若P<0.05,则认为差异有统计学意义。
2 结 果
2.1 骨肉瘤组织与瘤旁组织、骨肉瘤细胞系与成骨细胞系hsa_circ_103809表达水平比较 见图1。相对于瘤旁组织,骨肉瘤组织中hsa_circ_103809的表达水平明显升高(P<0.01)。此外,骨肉瘤细胞系hsa_circ_103809的表达水平均明显高于成骨细胞系hFOB1.19(均P<0.05)。以上结果提示,骨肉瘤组织和细胞系中上调的hsa_circ_103809可能起到促进骨肉瘤进展的作用。

注:A图中,与瘤旁组织比较,**P<0.01;B图中,与成骨细胞系hFOB1.19比较,*P<0.05,***P<0.001
2.2 两组细胞hsa_circ_103809表达水平比较 见图2。qRT-PCR结果显示,转染siRNA 24 h以后,实验组细胞中hsa_circ_103809的表达水平较对照组明显降低(P<0.01)。此结果提示,采用siRNA抑制hsa_circ_103809的表达有效,其可被用于后续功能实验的研究。

注:与对照组比较,**P<0.01
2.3 两组细胞增殖能力比较 见图3。CCK-8实验结果显示,实验组细胞在24、48 h的OD值与对照组比较没有统计学差异,而在72、96 h的OD值均较对照组明显降低(均P<0.01),表明实验组细胞在72、96 h的增殖能力较对照组明显减弱。此结果提示,hsa_circ_103809可促进骨肉瘤细胞的增殖。

注:与相同时间点对照组比较,**P<0.01,***P<0.001
2.4 两组细胞侵袭能力比较 见图4。Transwell侵袭实验结果显示,实验组穿膜细胞数明显低于对照组(P<0.01),表明实验组细胞侵袭能力明显低于对照组。此结果提示,hsa_circ_103809可促进骨肉瘤细胞的侵袭。

注:A图为两组细胞Transwell侵袭实验代表图(结晶紫染色,×200);B图中,与对照组相比,**P<0.01
2.5 两组细胞迁移能力比较 见图5。Transwell迁移实验结果显示,实验组细胞迁移能力较对照组明显减弱(P<0.01)。此结果提示,hsa_circ_103809可促进骨肉瘤细胞的迁移。

注:A图为两组细胞Transwell迁移实验代表图(结晶紫染色,×200);B图中,与对照组相比,**P<0.01
2.6 hsa_circ_103809表达水平与骨肉瘤患者临床参数相关性分析 见表1。在对临床骨肉瘤组织标本进行hsa_circ_103809表达水平的检测后,以所有样本的平均值为基准,将高于平均值的分为hsa_circ_103809高表达组,反之为hsa_circ_103809低表达组。然后对两组患者性别、年龄、肿瘤大小、临床分期及转移与否等临床参数进行分析,结果显示hsa_circ_103809表达水平与骨肉瘤患者临床分期及远处转移均呈正相关(均P<0.05),提示hsa_circ_103809在骨肉瘤的临床中作为癌基因,可促进骨肉瘤进展。
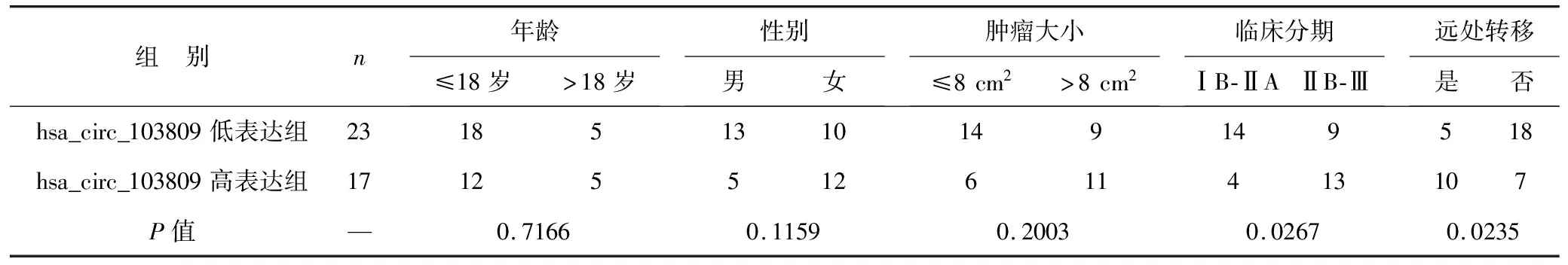
表1 hsa_circ_103809表达水平与骨肉瘤患者临床参数相关性分析(例)
3 讨 论
作为青少年常见的原发性骨恶性肿瘤之一,骨肉瘤的发病机制在近年来已得到广泛的研究[13-15]。特别是随着RNA测序技术的发展,大量非编码RNA被证实参与骨肉瘤的调控。在非编码RNA领域,随着circRNA成为现在的研究热点,一些circRNA已被证实参与骨肉瘤的进展,可作为骨肉瘤潜在诊治靶点。例如,骨肉瘤中高表达hsa_circ_001621可促进骨肉瘤细胞的增殖和迁移[16]。同样,hsa_circ_001105在骨肉瘤中的表达被下调,而低表达的hsa_circ_001105被证实可抑制骨肉瘤的转移[17]。
本研究中发现,hsa_circ_103809在骨肉瘤细胞和组织中表达水平均上调。为进一步明确高表达的hsa_circ_103809是否可促进骨肉瘤进展,我们采用了siRNA沉默技术进行实验,在同一细胞系中对实验组细胞采用siRNA沉默技术来下调hsa_circ_103809的表达,然后将实验组的增殖、侵袭和迁移等功能实验结果与对照组进行比较,从而最终在细胞层面明确了hsa_circ_103809可促进骨肉瘤细胞的恶性生物学行为。同时,为明确其在骨肉瘤细胞系中作用的普遍性,我们选择了骨肉瘤143B和Saos-2两个细胞系进行实验,后续仍可进一步在骨肉瘤其他多个细胞系中进行验证。在本研究中,我们最终在细胞层面证实了hsa_circ_103809可作为癌基因促进骨肉瘤细胞的增殖、侵袭和迁移。研究结果同之前hsa_circ_103809在乳腺癌、胃癌等多种肿瘤中的作用相一致[8-12],表明hsa_circ_103809在多种肿瘤中均起到癌基因作用。
除了在细胞层面,我们也在临床组织标本中进行了hsa_circ_103809的检测,并根据表达水平将标本分成hsa_circ_103809高表达组和低表达组,结果证实hsa_circ_103809表达水平与骨肉瘤临床分期及远处转移呈正相关。临床标本层面的研究结果同细胞层面相一致,都表明hsa_circ_103809在骨肉瘤中起到促进作用。
研究表明,circRNA可通过海绵吸附miRNA,进而解除miRNA对下游mRNA的抑制作用。例如,高表达的circ_ARF3通过海绵吸附miR-1299,进而消除后者对于CDK6的下调,从而促进骨肉瘤的进展[18];circ_PVT1通过海绵吸附miR-526b解除miR-526b对FOXC2的抑制作用,从而促进骨肉瘤转移[19]。就hsa_circ_103809而言,其已被证实可通过海绵吸附miR-516a-5p、miR-101-3p、miR-377-3p和miR-4302等miRNA,进而促进乳腺癌、胃癌和肝细胞癌等肿瘤的进展[8-12]。但在骨肉瘤中hsa_circ_103809是否可作用于以上靶基因,还需要进一步验证。
综上所述,我们在细胞和临床标本层面证实了hsa_circ_103809在骨肉瘤中的促进作用,为后续全面地进行hsa_circ_103809在骨肉瘤中的研究打下了坚实的基础,也为骨肉瘤的临床治疗提供了新的思路和靶点。但因为骨肉瘤较其他肿瘤发病率低,使得大规模获取临床标本比较困难,因此本研究样本量比较小,后续还需要多中心大样本量进行更广泛的研究,进一步确定hsa_circ_103809在临床实践中的癌基因作用,也需要完善动物实验以及寻找hsa_circ_103809具体的下游作用通路,以更加全面地证实hsa_circ_103809在骨肉瘤中的癌基因作用。
