粪菌移植对哮喘幼鼠气道炎症的影响及其机制
2021-03-16贾媛媛李秋红
吴 诚,张 娟,贾媛媛,李秋红,孙 新
(空军军医大学第一附属医院儿科,西安 710032;*通讯作者,E-mail:sunxin6@fmmu.edu.cn)
支气管哮喘是常见的呼吸系统疾病,全球约有3亿哮喘患者,且有一定的病死率[1]。与成人相比,哮喘在儿童中发病率更高,已成为导致儿童生活质量降低的主要疾病因素[2]。据我国第三次城市儿童哮喘流行病学调查结果显示,城市儿童哮喘患病率平均为3.02%,较10年前相比增加了52.8%,而且呈逐年增长的趋势,可见儿童哮喘是目前卫生医疗领域亟待解决的难题[3]。儿童哮喘多起始于3岁前,并且年龄的增长会使哮喘治疗失败的风险增加。同时,与无喘息症状的儿童相比,哮喘患儿到成年期发展为慢性阻塞性肺疾病的风险显著升高[4]。因此在儿童期对哮喘进行有效的早期识别和防治干预是十分重要的,尤其是婴幼儿期[5]。但是,现阶段治疗方法取得的效果并不理想,副作用较明显,并且儿童患者的依从性较差[6]。研究发现,哮喘的发生发展与机体微生态的关系十分密切,尤其是肠道微生态。相对于健康人群,哮喘患者的肠道菌群丰度和优势菌群均有显著的变化[7]。前期研究表明,益生菌能通过改善胃肠道微生态和调控调节性T细胞(Tregs)有效缓解哮喘症状[8]。近年来,作为重建肠道菌群的有效手段,粪菌移植已被用于难辨梭状芽孢杆菌感染、肠道免疫缺陷、炎症性肠病、肠道过敏、顽固性便秘和代谢病等多种疾病的探索性研究和临床治疗,并取得了较好的疗效[9-12]。粪菌移植是指将健康宿主粪便中的有效菌群移植到患者胃肠道内,重建新的肠道菌群生态,以实现对肠道及肠道外疾病的治疗方法[13]。然而目前针对粪菌移植在哮喘中的作用及机制研究却鲜有报道。本研究通过建立哮喘幼鼠模型,观察粪菌移植对过敏性哮喘气道炎症的影响,并探讨其作用机制,以期为哮喘研究提供新的方向和防治策略。
1 材料与方法
1.1 实验动物
2周孕龄的BALB/c小鼠,体质量55-59 g,购自空军军医大学动物实验中心,动物生产许可证号:SCXK(陕)2019-001。孕鼠随机分为正常对照组,哮喘模型组和粪菌移植组,每组各2只。
1.2 主要试剂和仪器
卵清蛋白(ovalbumin,OVA,Grade V,美国Sigma公司);氢氧化铝[Al(OH)3]粉末(天津天士力化学试剂公司);乙酰甲胆碱(acetyl-β-methylcholinechloride,Mch,美国Sigma公司);Ⅳ型胶原酶(德国biofroxx公司);流式细胞染色缓冲液(美国eBioscience公司);小鼠IL-4、IL-5、IL-13 ELISA试剂盒(美国Sabbiotech公司);空气压缩雾化器(大连欧姆龙有限公司);超净工作台(苏州净化设备厂);小鼠肺功能仪(加拿大SCIREQ公司);自动酶标检测仪(美国Bio-Rad公司);流式细胞仪BD FACSCalibur(美国BD Biosciences)。
1.3 孕鼠饲养
BALB/c小鼠于孕2周时购入,置于动物房中适应性饲养至自然分娩,正常供给饮食饮水。孕鼠生仔后,正常对照组有13只新生鼠,模型有15只新生鼠,粪菌移植组有12只新生鼠。小鼠均饲养于动物实验中心,恒定室温(21-25 ℃),湿度50%-65%,光照12 h/d,小鼠自由进食进水,饲养过程遵循实验动物中心动物保护和使用指南,实验中遵循“3R原则”,并且所有操作均严格遵守《实验动物管理与使用指南》。
1.4 建立哮喘模型
在模型组和粪菌移植组小鼠出生后的第0天、第7天和第14天采用含10 μg OVA和1 mg Al(OH)3的生理盐水配成20 μl致敏液进行腹腔注射致敏,并于第21-28天用1%OVA雾化液雾化吸入激发,隔天1次,每次30 min。对照组采用不含OVA、仅含Al(OH)3的生理盐水进行腹腔注射,并用生理盐水雾化,其他条件不变,研究技术路线图见图1。
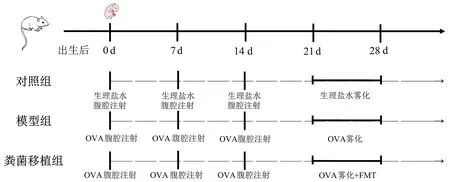
图1 研究技术路线图
1.5 粪菌移植
生后第21-28天每日08:00,取对照组幼鼠新鲜粪便,按比例(W/V=1 ∶5)溶于无菌生理盐水中,搅匀制成混悬液。悬液经20 mm孔径的尼龙过滤器过滤后,于4 ℃ 6 000g离心5 min,溶解在生理盐水中制成400 mg/ml的菌液。于10:00给予粪菌移植组幼鼠150 μl菌液灌胃,正常对照组和模型组给予等量无菌生理盐水灌胃。
1.6 雾化刺激法测定气道高反应性
小鼠在末次雾化激发24 h后,经2%戊巴比妥钠溶液(0.045 ml/g)腹腔注射麻醉进行气管插管,将其连接于小鼠肺功能仪上,依次雾化吸入浓度为0,1.5,3,6,12,25,50,100 mg/ml的乙酰甲胆碱(Mch),记录小鼠气道总阻力值(Rrs)。
1.7 光学显微镜下计数肺泡灌洗液中白细胞及分类细胞百分比
小鼠经麻醉后仰卧位固定,分离颈部组织暴露气管,进行气管插管并固定。用4 ℃预冷的无菌PBS溶液进行支气管肺泡灌洗,每次注入0.6 ml,停留20 s后回抽(回抽率>80%),重复3次,记录回收量。将收集的肺泡灌洗液(BALF)于4 ℃ 2 500 r/min离心5 min,离心后的上清保存于-80 ℃备用,沉淀则用1 ml无菌PBS溶液重悬,取100 μl重悬液涂片,进行瑞氏-吉姆萨染色,在光学显微镜下进行白细胞总数及分类计数,并计算各分类细胞百分比。
1.8 肺组织病理切片染色
支气管肺泡灌洗完毕后,解剖暴露小鼠肺部,取小鼠左肺下叶,并浸泡在4%多聚甲醛溶液中固定,经酒精脱水、石蜡包埋后切片,进行常规苏木精-伊红(HE)染色,在光学显微镜下观察肺组织结构和炎症细胞浸润。
1.9 ELISA法检测BALF中的炎性细胞因子
根据ELISA试剂盒操作说明对BALF上清中的IL-4、IL-5和IL-13细胞因子进行检测,并在450 nm处使用酶标仪测定OD值,计算转换为相应浓度。
1.10 流式检测Tregs比例
无菌操作打开胸腔,取出肺脏并用眼科剪剪碎后,加入1 ml含10%胎牛血清的1640培养基和Ⅳ型胶原酶(1 mg/ml,3 ml/只),于37 ℃恒温摇床内150 r/min消化1 h。用70 μm的滤网过滤后,4 ℃ 1 500 r/min离心15 min,收集肺组织细胞团,加入1 ml红细胞裂解液反应5 min。再次离心10 min,用PBS清洗两遍并重悬,调整细胞浓度为(2-4)×107/ml,每管100 μl,制成肺组织单细胞悬液。加入CD4-FITC(美国eBioscience公司)、CD25-APC(美国eBioscience公司),冰上避光孵育15-20 min,用流式液清洗2次,350g离心5 min,留沉淀。在每管中加入1 ml固定破膜液反应30-60 min后,再加入2 ml破膜工作液清洗2次,离心后留沉淀。100 μl破膜工作液重悬细胞,加入Foxp3-PE(美国eBioscience公司)室温避光孵育30 min。流式液清洗2次,再次离心取沉淀,用流式液重悬细胞至200 μl,上机检测。
1.11 统计学分析
2 结果
2.1 幼鼠行为学观察
在造模雾化过程中,模型组小鼠出现明显的焦躁不安、情绪激动、全身瘙痒、抓脸擦鼻、呼吸加快、打喷嚏、毛发竖起、腹肌抽搐等哮喘速发相表现,而对照组及粪菌移植组小鼠活动正常,无上述异常表现。
2.2 气道高反应性
小鼠气道阻力随着吸入Mch浓度的增加而逐渐增高。与对照组相比,模型组小鼠在25,50,100 mg/ml Mch时气道阻力显著升高(P<0.000 1);与模型组相比,粪菌移植组在25,50,100 mg/ml Mch时气道阻力显著降低(P<0.05-0.000 1,见图2)。
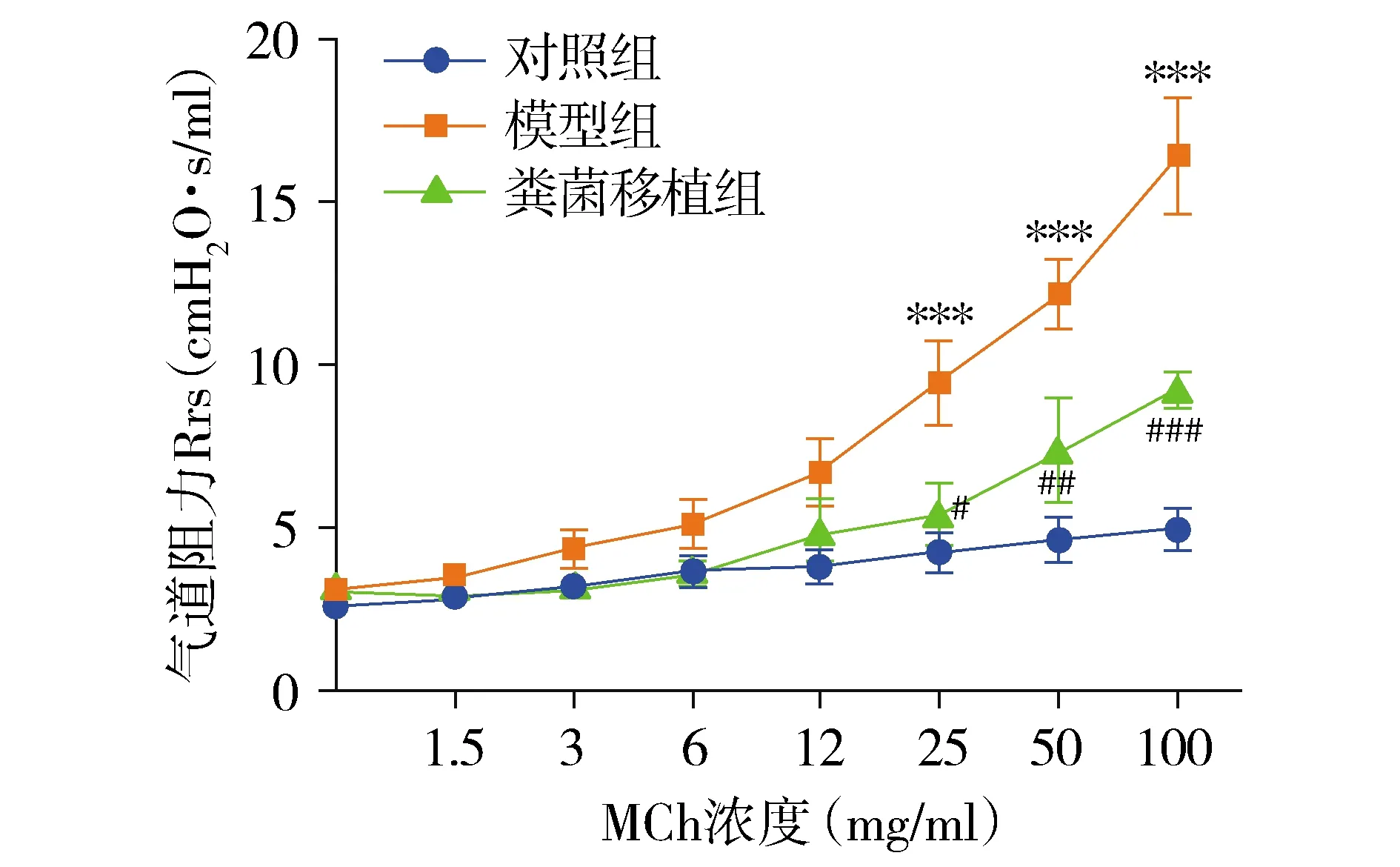
与对照组相比,*P<0.05,**P<0.01,***P<0.000 1;与模型组相比,#P<0.05,##P<0.01,###P<0.000 1
2.3 肺组织病理染色
苏木精-伊红(HE)染色法可观察到炎性细胞的浸润。通过三组小鼠肺组织染色结果的对比发现,对照组小鼠肺组织结构相对完整,气道周围无明显炎症细胞浸润;模型组小鼠肺组织结构受损,肺泡壁断裂,细小支气管周围有明显的炎性细胞浸润;粪菌移植组小鼠肺部炎症反应相对较轻,肺部炎症细胞浸润也明显较少(见图3)。

图3 小鼠肺组织HE染色(HE染色,×200)
2.4 BALF中白细胞总数及分类细胞百分比
与对照组相比,模型组小鼠BALF中白细胞总数明显增多(P<0.001),主要表现为嗜酸粒细胞(P<0.000 1)和中性粒细胞(P<0.01)增多,淋巴细胞(P<0.001)和巨噬细胞(P<0.05)降低;与模型组小鼠相比,粪菌移植组小鼠BALF中白细胞总数显著降低,其中嗜酸粒细胞和中性粒细胞显著减少(P<0.001),淋巴细胞(P<0.001)和巨噬细胞(P<0.05)明显升高(BALF中白细胞总数和分类细胞百分比分别见图4,5)。

与对照组相比,***P<0.001;与模型组相比,###P<0.001
2.5 BALF中细胞因子水平变化
与对照组相比,模型组小鼠BALF中炎性细胞因子IL-4(P<0.000 1)、IL-5(P<0.01)和IL-13(P<0.05)水平显著升高;与模型组相比,粪菌移植组BALF中IL-4(P<0.000 1)、IL-5(P<0.01)和IL-13(P<0.01)水平显著降低(见图6)。

与对照组相比,**P<0.01,***P<0.000 1;与模型组相比,##P<0.01,###P<0.001

与对照组相比,*P<0.05,**P<0.01,***P<0.000 1;与模型组相比,#P<0.05,##P<0.01,###P<0.000 1
2.6 小鼠肺组织中Tregs比例变化
与对照组相比,模型组小鼠肺组织中的Tregs在CD4+T细胞中的比例明显下降(P<0.05);与模型组相比,粪菌移植组小鼠肺组织中Tregs在CD4+T细胞中的比例显著升高(P<0.05,见图7,8)。
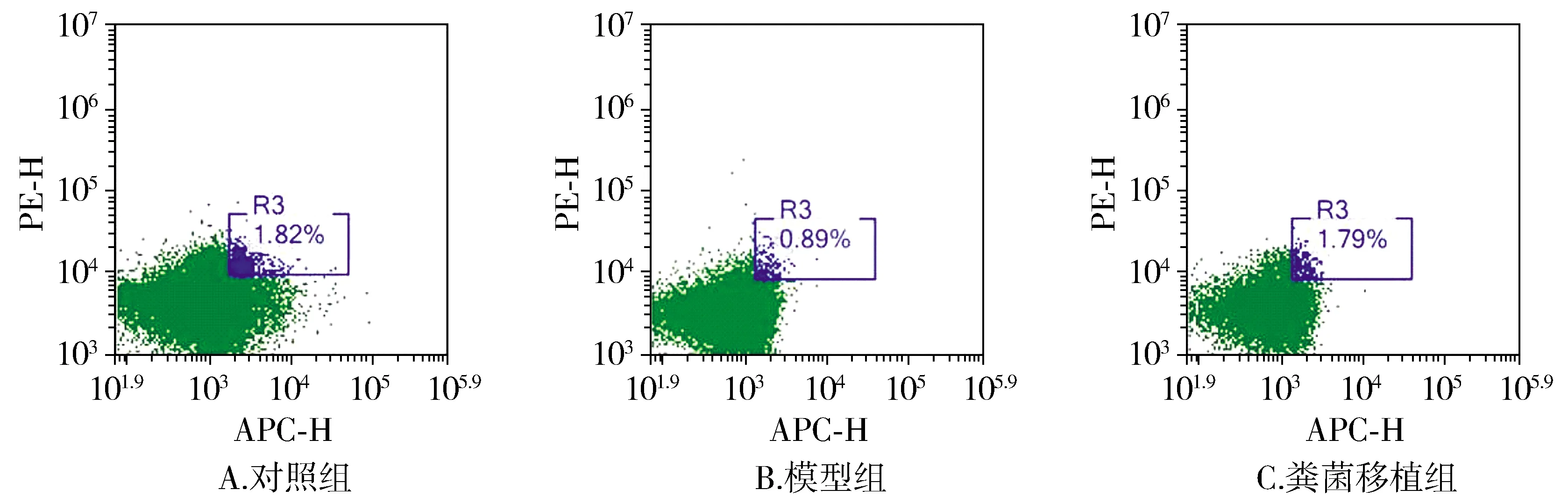
图7 小鼠肺组织中Tregs的流式图
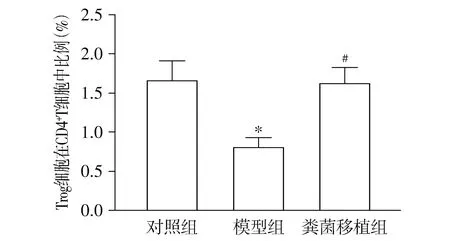
与对照组相比,*P<0.05;与模型组相比,#P<0.05
3 讨论
支气管哮喘是一种常见的慢性气道炎症性疾病,以气道高反应性、可逆性的气流受限和多种炎症细胞浸润为主要特征。目前,哮喘仅能经药物治疗以控制症状,尚不能被完全治愈,且发病机制仍未被完全阐明。因此,对儿童期哮喘的发病机制和治疗新靶点新途径的深入研究具有重大的现实意义。研究表明,过敏性哮喘患者呼吸道炎症的病理改变以嗜酸粒细胞的浸润、2型辅助性T细胞(Th2细胞)的活化和血清免疫球蛋白(IgE)的升高为主[14]。Th1/Th2细胞失衡被普遍认为是哮喘的免疫学发病基础,表现为Th2细胞功能亢进和Th1细胞功能降低,而炎性细胞因子IL-4、IL-5和IL-13则主要是由Th2细胞所分泌[15,16]。哮喘的发病因素十分多样,其中环境因素也发挥重要作用,而肠道微生物触发因子作为一个重要的环境因子,在哮喘的发生发展中起着重要作用[17]。而粪菌移植即是通过将健康供体的微生物群转移到一个紊乱的微生物生态系统中,调控胃肠道微生物群以恢复稳态,是一种相对直接的干预治疗方法[18]。粪菌移植作为近年来新兴的治疗方式,在各类菌群相关性疾病的科学研究和临床应用中起到一定的治疗作用。有文章从不同角度对粪菌移植在哮喘的控制和治疗方面的理论可行性进行了阐释,但罕有报道将其付诸具体研究[19]。本研究结果显示,相比于模型组,粪菌移植可以减轻哮喘幼鼠肺部的炎性细胞浸润,降低气道高反应性,减少BALF中白细胞总数、嗜酸粒细胞和中性粒细胞,并且BALF中的炎性因子IL-4、IL-5和IL-13水平也明显下降,提示粪菌移植能够有效抑制哮喘幼鼠的Th2型免疫反应,具有较好的治疗作用。
Tregs是一类主要发挥抑制性免疫调节功能的T淋巴细胞亚群,在维持免疫耐受、限制慢性炎症、调节淋巴细胞稳态的过程中发挥重要作用[20-22]。Tregs可通过表达膜结合性或可溶性抑制分子,或分泌抑制性细胞因子(如IL-10、IL-35和TGF-β),对过敏性炎症起到抑制作用[23]。肠道微生物可通过菌群自身或者其代谢产物影响Tregs的数量和功能,进而促进抑制性细胞因子的分泌以调控体内免疫状态,这种作用在对哮喘的保护中同样出现[24]。本研究结果表明,粪菌移植干预能有效增加肺组织中Tregs在CD4+T细胞中的比例,提示粪菌移植可通过诱导肺组织Tregs的产生,促进Tregs表达抗炎因子,抑制效应性T细胞的增殖和Th2型细胞因子的大量分泌,进而减轻肺部和气道的过敏性炎症。
综上所述,通过给予粪菌移植干预,哮喘幼鼠的气道过敏性炎症明显减轻,BALF中的炎症细胞数量和Th2型细胞因子表达显著减少,同时粪菌移植能够诱导肺组织中Tregs的产生,促进免疫负调控功能的表达并发挥抗炎作用,对过敏性哮喘具有一定的治疗效果,为哮喘的治疗提供新的思路和方法。
