热休克蛋白70 C末端反应蛋白对人小细胞肺癌细胞株的作用
2021-03-15李萌粘婧李德华
李萌,粘婧,李德华
(1.锦州医科大学人体解剖学教研室,辽宁 锦州 121000;2.抚顺市中心医院,辽宁 抚顺 113000)
间充质-上皮转化因子(mesenchymal-epitransition factor,MET)是一种由MET原癌基因编码的蛋白,MET的异常活化可触发血管生成、肿瘤生长和转移[1-3]。Maulik等人[4]报道了在SCLC中c-MET/HGF通路的功能,并认为该通路可能成为肿瘤治疗的一个新靶点。热休克蛋白70C末端反应蛋白(CHIP)是一种u-box型E3泛素连接酶,其底物包括糖皮质激素受体、c-Raf激酶、ErbB等致癌蛋白。CHIP可以诱导其底物发生泛素化以及发生蛋白酶体降解[5]。人们发现CHIP表达上调可以抑制肿瘤的生长和转移,在人乳腺癌和胃癌中CHIP表达水平与肿瘤恶性程度呈负相关[6]。然而,CHIP对抑制SCLC的确切作用机制尚不十分清楚。在本研究中,我们拟通过在SCLC细胞株中转染构建CHIP表达载体,探讨其是否发挥肿瘤抑制作用。
1 实验材料和方法
1.1 实验材料
SCLC细胞株(NCI-H69,NCI-H82,NCI-H209,NCI-H345,NCI-H526)购自上海细胞库。MG132购置于sigma公司。DNA提纯试剂盒和DNA 扩增试剂盒购置于北京天恩泽生物公司;兔抗MET、CHIP、paxillin、pAkt、ERK、FAK抗体及CCK-8试剂盒购于北京博奥森生物技术公司;pcDNA3载体、 pAcGFP1-N1载体、myc-His A载体、Taq DNA 聚合酶购于大连宝生物公司。
1.2 实验方法
1.2.1 瞬时转染
细胞按照 1×105个/孔接种到 6孔培养板中,加入完全培养基,二氧化碳培养箱中 37 ℃过夜。2 μg 的待转染的质粒(阴性对照载体CHIP(-)、CHIP表达载体CHIP(+)、对照载体pGFP:-和CHIP表达载体(pGFP-CHIP:+)。同时用 100 μL 的无血清培养基稀释 5 μL 的Lipofectamine Plus转染试剂,将以上2种溶液混匀,室温下放置 30 min 左右。细胞培养至 80%融合时加入 1 mL 的无血清培养基,并将上述混合好的溶液逐滴加入到每孔中,轻摇混匀,二氧化碳培养箱中 37 ℃培养 24 h。将转染液倒出,转染细胞用MG132或等量的二甲基亚砜(DMSO)培养 3~4 d后检测蛋白表达量。
1.2.2 质粒和小干扰RNA构建
扩增编码全长CHIP的DNA片段,并将其亚克隆至pcDNA3和pAcGFP1-N1中。同时PCR法扩增去除TPR和U-box序列的CHIP片段,并亚克隆到pAcGFP1-N1中。同样,MET亚克隆到pcDNA3和myc-His A中。基因沉默实验用阴性对照CHIPsiRNA(-)和阳性CHIPsiRNA(+)转染NCI-H69细胞。
1.2.3 免疫沉淀及免疫印迹检测
取对数生长期的细胞,于细胞裂解液中进行细胞裂解。蛋白定量试剂盒测定蛋白浓度。以50 μg/道裂解产物上样并进行SDS电泳,然后转移到聚偏二氟乙烯膜上。分别和一抗(兔抗-CHIP,MET,ERK,FAK,pERK1/2,Akt,pFAK,GFP,Myc,paxillin)进行孵育,4 ℃冰箱内过夜。HRP标记的二抗室温下孵育1 h,ECL显像,定量分析条带密度。免疫沉淀反应在细胞裂解物添加15 μL琼脂糖,并在摇床上于4 ℃孵育1 h。结合蛋白经SDS-PAGE电泳,最后用免疫印迹法检测免疫条带。
1.2.4 细胞活力试验
用pcDNA-CHIP(+)或pcDNA(-)空白载体转染的NCI-H69肺癌细胞株,然后孵育48 h。之后将10 μL CCK-8试剂直接添加到培养基中,继续在37 ℃下孵育4 h。最后测量450 nm处的吸光度值。
1.2.5 细胞凋亡检测
用CHIP表达载体转染NCI-H69细胞并孵育48 h。用PBS洗两次细胞后收集细胞。将约1×105个细胞重新悬浮在含89 μL结合缓冲液,1 μL膜联蛋白和10 μL碘化丙啶和混合溶液中,在暗室中孵育15 min。细胞悬液以5000 rpm 离心5 min,收集细胞颗粒并重新在400 μL结合缓冲液中悬浮,流式细胞术检测细胞凋亡。
1.2.6 细胞侵袭试验
1.5×105个细胞悬浮在含1%胎牛血清RPMI 1640中,并置于培养板的培养室中。在下层培养室用含有10%胎牛血清的RPMI 1640作为化学引诱剂。24 h后,用棉签将滤纸上表面的细胞擦拭。将滤池下表面的细胞用甲醇固定10 min,Giemsa染色孵育3 h后,将细胞悬浮于10%醋酸溶液中,然后将相同体积的细胞混合液转移数到96孔板中,测量560 nm处的光密度值。
1.3 统计学处理

2 结 果
2.1 SCLC细胞中MET和CHIP表达
MET在NCI-H69 SCLC细胞系中呈高表达状态,而在NCI-H526和NCI-H345细胞系中MET表达适中,NCI-H209和NCI-H82 SCLC细胞系中MET呈低表达状态。CHIP在NCI-H209细胞系中呈高表达,在NCI-H82和NCI-H345细胞系中表达适中,而在NCI-H69和NCI-H526细胞系中表达较弱。NCI-H69细胞系中MET和CHIP的表达呈相反趋势,见图1。
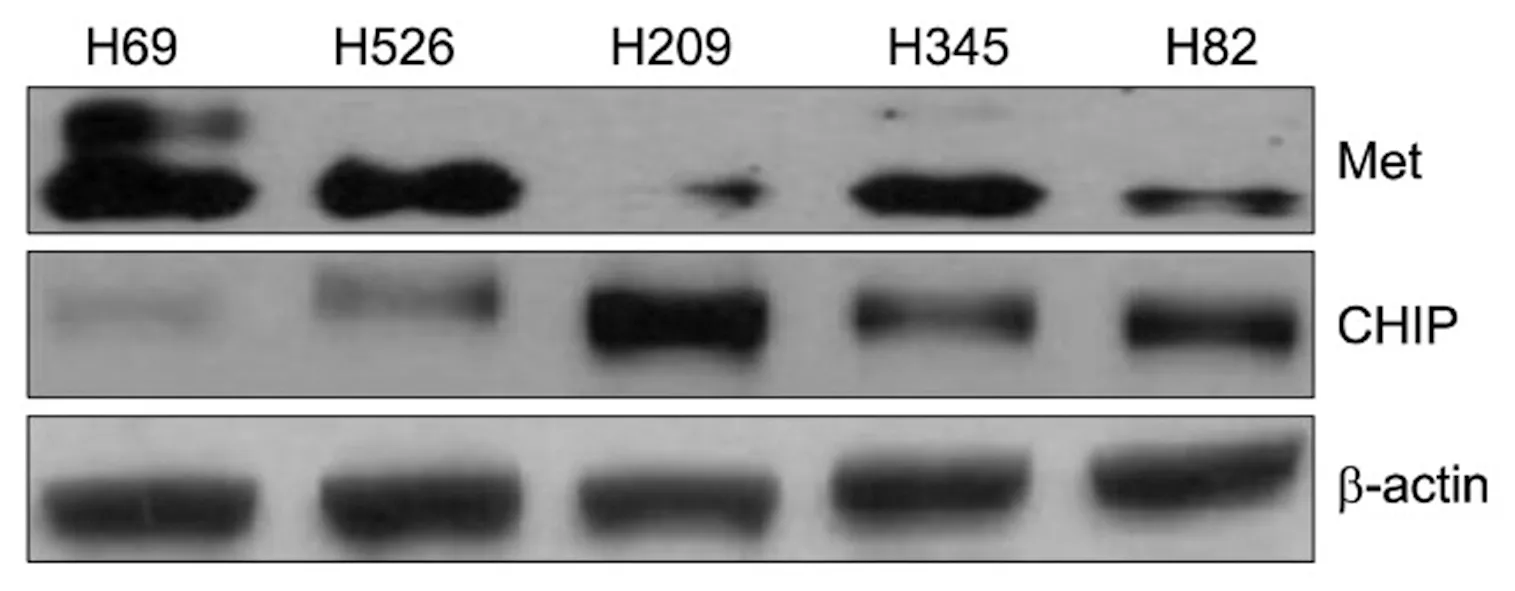
图1 MET和CHIP在SCLC细胞系中的表达
2.2 CHIP调节MET诱导的信号蛋白情况
转染pcDNA3-CHIP(+)的NCI-H69细胞株CHIP呈过表达状态,而MET表达水平降低,见图2A;同样,在检测CHIP过表达的NCI-H69中细胞骨架分子paxillin和FAK时发现,paxillin和FAK的活化程度较低,CHIP过表达导致磷酸化的paxillin和FAK水平降低,见图2B;通过对细胞的侵袭性观察,发现CHIP过表达的SCLC能够穿透基质凝胶膜的细胞的数量显著减少,见图2C。
2.3 CHIP诱导细胞凋亡,抑制细胞生长情况
CHIP有效阻止了ERK1/2和Akt1/2的活化,见图3A;CHIP对NCI-H69细胞生长和凋亡的影响:与转染pcDNA3空载体的细胞相比,转染pcDNA3CHIP的NCI-H69细胞在8 h后,NCI-H69细胞的活力明显下降,见图3B;CHIP对细胞凋亡的有显著的影响:与空白对照组转染细胞相比,转染CHIP基因的NCI-H69细胞的凋亡水平增加了3倍(P<0.001),见图3C、图3D。
2.4 CHIP与MET的相互作用免疫共沉淀结果
同时用缺少U-box域(pGFP-CHIPΔU)或缺少TPR域(pGFP-CHIPΔT)GFP标记的CHIP与Myc标记的MET(pMyc-MET)表达载体转染NCI-H69细胞,发现在析出的MET复合体中检测到U-box突变体,见图4B;未检测到TPR突变体,见图4C,这表明CHIP与MET作用需要TPR域存在。
2.5 TPR和U-box域对于CHIP介导的MET降解作用
用Myc标记MET、GFP标记CHIP或CHIP的突变体(GFP-CHIP和GFP-CHIPΔU)共转染 NCI-H69细胞,分析MET和GFP表达发现,所有构建物表达的蛋白量相似。与可降解MET的野生型CHIP(GFP-CHIP)相反,CHIP的突变体(GFP-CHIPΔT和GFP-CHIPΔU) 都未能检测到降低MET蛋白表达水平。说明U-box域和TPR域在CHIP介导的MET降解过程中二者是缺一不可的,见图5A。
2.6 CHIP与内源性MET相互作用
用对照载体(pGFP:-)或CHIP表达载体(pGFP-CHIP:+)转染NCI-H69细胞,发现细胞CHIP过表达后,MET蛋白水平恢复正常,见图5B;在转染阴性对照载体(-)或CHIP表达载体(+)的NCI-H69细胞中观察MET的聚泛素化情况,发现聚泛素化的MET表现为典型的成片条带,CHIP过表达时条带强度明显增强,提示受体聚泛素化水平升高,见图5C。
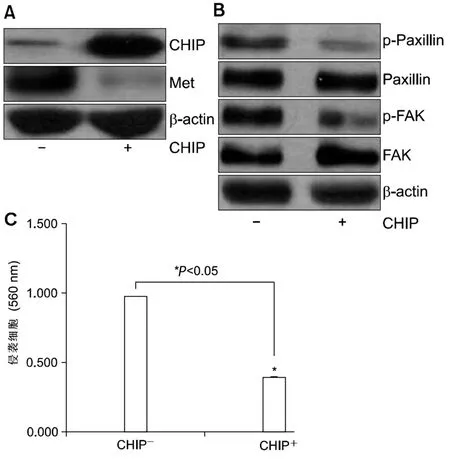
A:pcDNA3(-)空白载体和pcDNA3-CHIP转染NCI-H69细胞48 h后,CHIP和MET表达情况。β-actin为内参;B:NCI-H69细胞p-paxillin、paxillin、p-FAK、FAK免疫印结果。β-actin为内参;C:pcDNA3(-)转染与pcDNA3-CHIP(+)转染的侵袭的细胞数量对比,*P<0.05
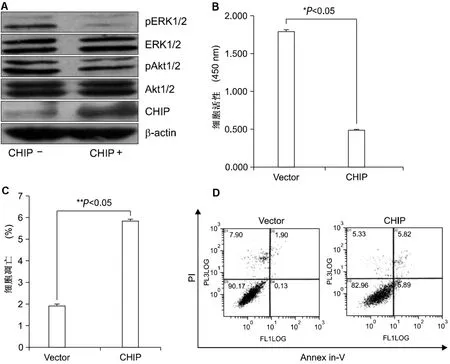
A:pAkt1/2、Akt1/2、pERK1/2、ERK1/2和CHIP免疫印迹图,β-actin为内参。“-”= pcDNA3载体,“+”=pcDNA3-CHIP载体;B:CCK-8法检测转染pcDNA3空白载体和pcDNA3-CHIP载体后细胞活力;C、D:annexin-V/PI法检测细胞凋亡
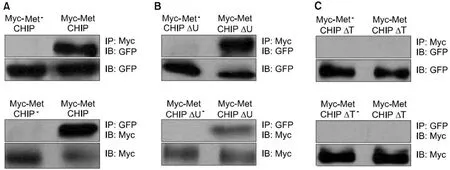
A:CHIP和MET的免疫共沉淀;B:缺乏U-box域(CHIPΔU)和MET的共免疫共沉淀;C:缺乏TPR域(CHIPΔT)和MET的免疫共沉淀。GFP:绿色荧光蛋白;IP:免疫沉淀分析;IB:免疫印迹分析
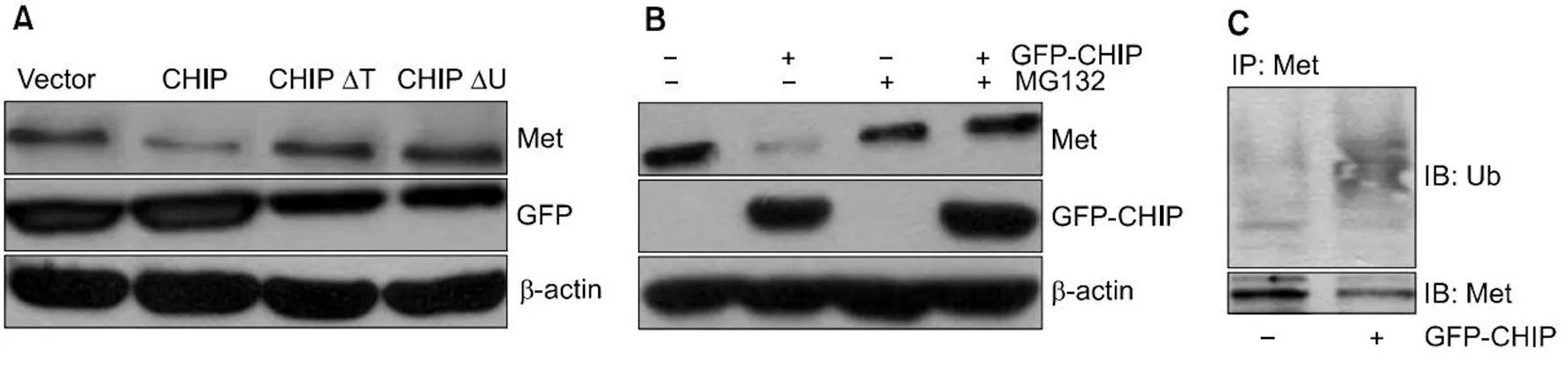
A:MET和GFP蛋白水平的免疫印迹结果;B:MG132处理细胞MET,GFP的免疫印迹结果;C:MET和泛素表达免疫印迹结果;
2.7 NCI-H69细胞内源性CHIP基因沉默后MET水平变化
阴性对照CHIPsiRNA (-)或阳性CHIPsiRNA (+)转染NCI-H69细胞后,发现CHIP和MET表达亦呈相反关系,即:CHIP表达减少,MET表达增加,见图6A;表明通过CHIP-siRNA基因沉默内源性CHIP蛋白可以增加内源性MET表达。MET和CHIP免疫沉淀分析结果显示,CHIP基因沉默可诱导MET和CHIP蛋白的分解,见图6B。
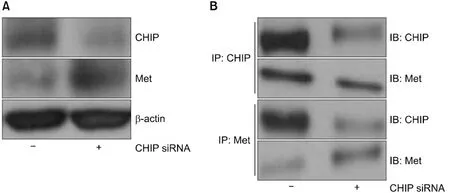
A:转染阴性对照siRNA和CHIP siRNA后48 h,CHIP和MET表达水平;B:MET和CHIP免疫共沉淀结果
3 讨 论
CHIP是一个具有U -box结构域的E3泛素连接酶,通过其TPR域可以与Hsp90和Hsp70上独立的TPR受体位点结合,介导其他Hsp90/Hsp70受体蛋白的泛素化[6]368-377。我们发现,CHIP与MET在NCI-H69细胞和其他多个SCLC细胞系中的表达都呈反比关系。为了确定CHIP过表达是否对SCLC细胞的生长和转移起作用,我们用CHIP转染细胞下调MET的表达,随后分析MET下调对SCLC细胞表型的影响。实验中CHIP能够特异性降低NCI-H69细胞中MET的表达水平。此外,我们还发现SCLC细胞的侵袭能力和迁移性能明显受到细胞骨架分子paxillin和FAK的调控,这些分子的激活又受MET的调节[7]。通过CHIP介导的MET抑制,paxillin和FAK的磷酸化水平均降低,这直接影响到肿瘤细胞的侵袭性并导致其活性降低。有报道证明,MET介导的Akt1/2和ERK1/2通路是参与SCLC细胞生存、增殖和分化的主要通路[8]。我们发现CHIP过表达降低了NCI-H69细胞中Akt1/2和ERK1/2的磷酸化水平。因此,在CHIP过表达的情况下,Akt1/2或ERK1/2磷酸化和信号传导的减少与MET诱导的降解是一致的。NCI-H69细胞中CHIP过表达导致细胞凋亡增加。
CHIP的主序列和结构显示其具有3个域:即N端的TPR域、C端的U-box域和中间的电荷域[9]。U-box结构域与锌指基因(really interesting new gene,RING)结构域有关,这两个结构域都赋予E3泛素连接酶活性[10-11]。CHIP的N端TPR域可以特异性地与Hsp70、Hsp90等多个伴侣分子相结合。由于CHIP通过TPR域与Hsp90或Hsp70相互作用,我们的结果提示在CHIP诱导的MET降解过程中可能有一种伴侣分子参与其中。促进泛素连接酶活性的C-端U-box域和N端TPR域,都是CHIP介导的MET降解过程中的必需结构域,二者缺一不可。本实验中,CHIP过表达促进了SCLC细胞株中的MET泛素化和降解。
CHIP与MET结合以及发生交互作用是需要U-box域还是TPR域。我们将GFP标记的全长CHIP(pGFP-CHIP)表达载体和Myc标记的MET (pMyc-MET)表达载体共转染给NCI-H69细胞。同时用缺乏U-box域(pGFP-CHIPΔU)或TPR域(pGFP-CHIPΔT)的GFP标记的CHIP与Myc标记的MET(pMyc-MET)表达载体转染NCI-H69细胞,结果发现在析出的MET复合体中检测到U-box突变体,而未检测到TPR突变体,这说明CHIP与MET相互作用需要TPR域的存在。我们发现CHIP的N端TPR域对MET结合和相互作用是必不可少的。
