ZIF-8原位自封装固定化脂肪酶的研究
2021-03-15梁鑫张成楠周威李秀婷万澄莹
梁鑫,张成楠*,周威,李秀婷,4,万澄莹
(1.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京100048;2.北京工商大学食品与健康学院,北京100048;3.北京工商大学理学院,北京100048;4.北京市食品添加剂工程技术研究中心,北京工商大学,北京100048)
脂肪酶(EC 3.1.1.3)是一类丝氨酸水解酶,能够催化酯键断裂和形成,参与转酯、酯化和酯交换等多种反应。在食品工业中,脂肪酶因其催化效率高、反应条件温和等优点广泛应用于酯类化合物合成、油脂改性、以及酒和其它饮料的风味改善等领域[1-4]。游离脂肪酶的化学稳定性和热稳定性差、成本高、且无法循环利用,利用物理或化学方法将游离酶结合到惰性载体上转变成固定化酶,可以有效改善酶的稳定性,提高酶的催化寿命和回收率等,并可降低成本,扩大其工业应用范围[5-6]。然而,寻找适合于脂肪酶的生物相容性载体和合适的固定化方法,在保护酶不失活且可重复回收利用的同时,还能最大程度上保证酶的催化活性,却一直是个挑战。
近年来,新型功能多孔材料的研究方兴未艾,由于金属有机框架(metal-organic frameworks,MOFs)多孔结构材料具有比表面积大、孔隙率高、孔道可调控性、易功能化及易修饰性等独特的性能优势受到了广泛的关注,利用MOFs 材料制备固定化酶已成为研究热点[7]。基于MOFs 材料,研究者通常采用表面吸附法、共价交联法、孔隙封装法和原位自封装法(也称原位封装法)4 种手段制备固定化脂肪酶[8-9]。表面吸附法和共价交联法主要通过氢键、共价键等将酶分子固定于MOFs 载体表面,这两种方法存在酶分子易于脱落,机械稳定性差或者酶的构象改变造成酶活力降低等问题。孔隙封装法和原位自封装法是将酶分子封闭在MOFs 内部,给酶分子“穿上”MOFs“盔甲”,借助MOFs材料的刚性框架,有效地提升酶的稳定性,两种方法的不同之处在于,孔隙封装法通过直接将脂肪酶分子与已合成的MOFs 载体混合,使脂肪酶分子穿过MOFs孔道进入载体内部制备固定化酶;原位自封装法是通过将酶分子加入MOFs 载体合成的反应液中,在自组装形成载体的同时,直接把酶分子封闭到了MOFs 内部[8-9]。研究表明,在穿过MOFs 表面孔道被包裹进载体内部的过程中,酶分子的构象会发生不可逆的“展开”,导致其变性失活[10]。因此,更多的研究者将目光聚焦于使用原位自封装法制备MOFs 固定化脂肪酶。目前,研究人员利用不同MOFs 材料原位封装不同来源的脂肪酶成功制备了十余种固定化脂肪酶[11-17]。
研究发现,利用原位自封装法制备的固定化酶的形貌和活性受到多种因素的影响,如金属离子和有机连接体的浓度、酶的浓度等[9]。沸石-咪唑框架-8(zeolitic imidazolate framework-8,ZIF-8)是以Zn2+和咪唑连接体通过配位键自组装形成的一种MOFs 材料[7]。Cui 等[18]研究发现通过改变硝酸锌和2-甲基咪唑的浓度和比例可以使ZIF-8 构象由菱形十二面体形状改变成十字花形状,利用十字花形状的ZIF-8 原位封装过氧化氢酶制备的固定化酶的活性比菱形十二面体形状的固定化酶提高了400%。Pitzalis 等[16]研究了硝酸锌和2-甲基咪唑摩尔比(Zn/M)不同对固定化脂肪酶的影响,结果表明,在Zn/M=1∶4 条件下制备的固定化脂肪酶比在Zn/M=1∶40 条件下制备的固定化脂肪酶具有更高的负载量和比活性。Qi 等[13]研究发现原位自封装法制备的固定化脂肪酶的水解效率随酶浓度增加而提高,然而负载率随酶浓度增加而下降。对于固定化载体MOFs 材料,金属离子的来源、反应时间等因素都会影响其形貌[19],然而这些因素对固定化脂肪酶影响的研究相对较少。
本研究采用ZIF-8 材料原位自封装皱褶假丝酵母源脂肪酶(Candida rugosa lipase,CRL)制备固定化脂肪酶(CRL@ZIF-8),探讨了金属离子来源、反应时间、金属离子浓度和有机连接体的浓度等因素对固定化酶催化活性和形貌特征的影响,并比较了游离酶与固定化酶的温度耐受性。
1 材料与方法
1.1 材料
皱褶假丝酵母脂肪酶(CRL)、硝酸锌、2-甲基咪唑、醋酸锌、对硝基苯丁酸酯(p-nitrophenylbutyrate,PNPB):美国Sigma-Aldrich 公司;正庚烷;美国Meridian Medical Technologies 公司;磷酸二氢钠、磷酸氢二钠(均为分析纯):天津市天力化学试剂有限公司。
1.2 仪器
Himac 多用途冷冻离心机(CF-RN 系列)、扫描电子显微镜(SU8010):日本Hitachi Koki 公司;高速组织匀浆机(T 10 basic):德国IKA 公司;真空冷冻干燥机(Free zone 4.5 plus):美国Labconco 公司;傅里叶变换红外光谱仪(Nicolet IS50):赛默飞世尔科技有限公司;桌面型多晶X 射线衍射仪(D2 PHASER):德国布鲁克AXS 公司。
1.3 试验方法
1.3.1 脂肪酶的固定化
参考Cui 等[18]关于固定化过氧化氢酶的制备方法并做适当修改。将20 mL 1 mol/L 2-甲基咪唑溶液与80 mg CRL 混合均匀,然后加入2 mL 0.5 mol/L 醋酸锌溶液,在300 r/min 下反应30 min。反应结束后,用去离子水洗涤沉淀物3 次,收集沉淀,冷冻干燥(-80 ℃,12 h),得到固定化脂肪酶CRL@ZIF-8。以在相同条件下不添加酶制备的ZIF-8 作为空白对照。
1.3.2 固定化脂肪酶CRL@ZIF-8 酶活力的测定
固定化脂肪酶的酶活测定方法参考QIL 等的方法并做适当修改[13]。称取0.01 g CRL@ZIF-8,加入1 mL 0.01 mol/L 的溶于正庚烷中的PNPB 溶液和1 mL 0.01 mol/L(pH 7.5)的磷酸盐缓冲液(phosphate buffer saline,PBS),在13 000 r/min 均质30 s,再在200 r/min条件下振荡反应5 min。反应结束后,加入0.5 mol/L Na2CO3终止反应,4 ℃下离心收集上清液,在405 nm下测定吸光值。一个酶活力单位定义为:每分钟释放1 μmol 对硝基苯酚(p-nitrophenol,p-NP)所需的固定化酶的酶量,以U/g 表示。
1.3.3 固定化脂肪酶CRL@ZIF-8 结构表征
称取一定量的CRL@ZIF-8 样品,研磨至均匀粉末,使用傅里叶变换衰减全反射红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析结构组成,扫描范围为400 cm-1~4 000 cm-1;使用X-射线衍射(Xray diffraction,XRD)分析晶体结构,扫描的角度范围为5°~45°,扫描时间为0.07 s;采用扫描电镜(scanning electron microscopy,SEM)分析样品形貌。
1.3.4 脂肪酶固定化条件的选择
采用1.3.1 脂肪酶CRL 的固定化方法,分别考察金属离子来源、反应时间、金属离子和有机连接体的浓度对CRL@ZIF-8 形貌结构和催化活性的影响,并以固定化酶酶活力为指标,筛选最佳的固定化条件。
1.3.5 固定化脂肪酶CRL@ZIF-8 的温度耐受性研究
称取一定量的CRL@ZIF-8,加入0.01 mol/L 的PBS 缓冲液中,在50 ℃下水浴振荡,分别在0、10、20、30、45、60 min 测定酶活力。设置0 min 的酶活力为100%,分别计算在不同时间固定化酶的剩余酶活力。
2 结果与分析
2.1 脂肪酶固定化条件的选择
2.1.1 不同金属盐对CRL@ZIF-8 的结构和催化活性的影响
ZIF-8 由Zn2+和咪唑基连接体自组装合成,目前文献中报道的用于合成固定化脂肪酶CRL@ZIF-8 的Zn2+供体主要包括硝酸锌和醋酸锌等[11-17],然而不同Zn2+供体对固定化脂肪酶的影响尚不清楚。本研究考察了利用相同浓度的硝酸锌或醋酸锌制备的CRL@ZIF-8 的差异,结果如图1、图2 和图3 所示。图1为利用硝酸锌或醋酸锌制备的CRL@ZIF-8 和CRL 的FT-IR 谱图。
由图1a 可见,CRL@ZIF-8(硝酸锌)和CRL@ZIF-8(醋酸锌)均在420 cm-1处出现ZIF-8 的Zn-N 键的伸缩振动吸收峰,在692 cm-1和758 cm-1处出现咪唑环的平面外弯曲特异吸收峰,在953 cm-1和1 308 cm-1处出现咪唑环的平面内弯曲特异吸收峰,在2 930 cm-1和3 124 cm-1处出现咪唑的脂肪族和芳香族的C-H键的伸缩振动吸收峰,这些特异吸收峰与文献中报道的ZIF-8 的特异吸收峰一致[12-13];CRL@ZIF-8(硝酸锌)、CRL@ZIF-8(醋酸锌)和CRL 均在1 600 cm-1~1 700 cm-1处出现蛋白质的酰胺键的特异吸收峰,将1 500 cm-1~2 000 cm-1位置局部放大,由图1b 可见,CRL@ZIF-8(硝酸锌)和CRL@ZIF-8(醋酸锌)的酰胺键的特异吸收峰相比于CRL 出现了轻微的偏移,这可能是因为ZIF-8 结构中的Zn2+与脂肪酶分子中的羰基间的相互作用引起酰胺键的特异吸收峰发生变化[13]。上述研究结果从官能团方面表明成功制备出了CRL@ZIF-8。
图2 为利用硝酸锌或醋酸锌制备的CRL@ZIF-8的XRD 谱图。
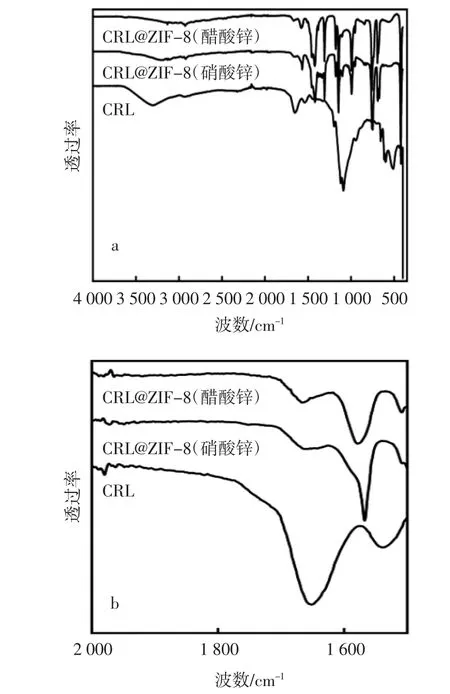
图1 不同金属盐制备的CRL@ZIF-8 的FT-IR 图Fig.1 FTIR spectra of CRL@ZIF-8 synthesized by employing different zinc salt

图2 不同金属盐制备的CRL@ZIF-8 的XRD 图Fig.2 XRD patterns of CRL@ZIF-8 synthesized by employing different zinc salt
由图2 可见,CRL@ZIF-8(醋酸锌)在2θ=7.29°、10.31°、12.66°、14.64°、16.41°、17.99°、22.08°、24.43°、25.54°、26.63°、29.61°、30.56°的位置观察到衍射峰,与ZIF-8 的标准XRD 谱图基本一致[13,15]。CRL@ZIF-8(醋酸锌)与ZIF-8 衍射峰分布规律一致,表明固定化脂肪酶CRL 对ZIF-8 的晶体结构没有显著的影响。相比较于CRL@ZIF-8(醋酸锌)和标准的ZIF-8 结构,CRL@ZIF-8(硝酸锌)的衍射峰分布规律显著不同。Biemmi 等[19]研究表明,利用硝酸锌合成的MOF-5 晶粒较大,而利用醋酸锌合成的MOF-5 晶粒较小。这可能是由于与硝酸锌相比,醋酸锌的碱性更强。相比于以硝酸锌作为Zn2+供体,以醋酸锌作为Zn2+供体合成MOF 过程中的初始成核率更高[19]。
图3 为利用硝酸锌或醋酸锌制备的CRL@ZIF-8的酶活力。

图3 不同金属盐制备的CRL@ZIF-8 的酶活Fig.3 The enzymatic activity of CRL@ZIF-8 synthesized by employing different zinc salt
固定化脂肪酶催化对硝基苯丁酸酯(PNBP)水解产生对硝基苯酚(p-NP),对硝基苯酚在405 nm 处有紫外吸收,因此可通过吸光值的变化来测定固定化脂肪酶的酶活[20]。
由图3 可见,CRL@ZIF-8(硝酸锌)比CRL@ZIF-8(醋酸锌)催化对硝基苯丁酸酯(PNPB)水解的能力更强。然而,通过对利用硝酸锌或醋酸锌制备的ZIF-8 研究发现,ZIF-8 也具有一定的催化PNPB 水解的能力,并且ZIF-8(硝酸锌)比ZIF-8(醋酸锌)催化PNPB 水解的能力更强,其原因有待探讨。除去ZIF-8 催化PNPB 的水解作用,可以观察到由醋酸锌制备的CRL@ZIF-8 催化底物水解的活性强于由硝酸锌制备的CRL@ZIF-8。综上所述,选择醋酸锌进行后续试验。
2.1.2 不同反应时间对CRL@ZIF-8 的结构和催化活性的影响
基于ZIF-8 材料利用原位自封装法合成固定化酶的反应时间对催化性能有重要影响[11-17]。本研究考察了ZIF-8 原位封装CRL 制备固定化酶CRL@ZIF-8 的反应时间对其结构和催化活性的影响,结果如图4、图5 和图6 所示。

图4 不同反应时间制备的CRL@ZIF-8 的FT-IR 图Fig.4 FTIR spectra of CRL@ZIF-8 synthesized at different reaction times
由图4 可见,当反应时间从10 min 增加到30 min时,CRL@ZIF-8 在420、692、758、953、1 308、1 651、2 930、3 124 cm-1处出现的特异吸收峰没有显著差异,从官能团方面表明反应时间对CRL@ZIF-8 的结构没有显著影响。
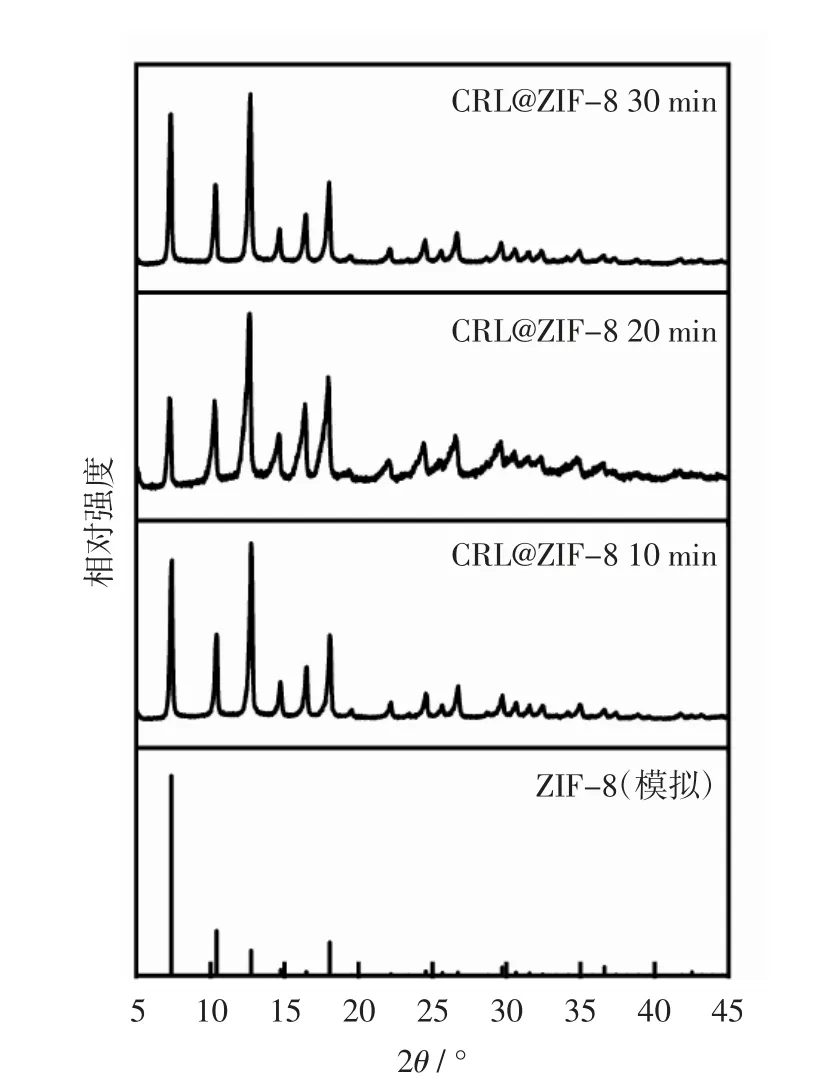
图5 不同反应时间制备的CRL@ZIF-8 的XRD 图Fig.5 XRD patterns of CRL@ZIF-8 synthesized at different reaction times
由图5 可见,当反应时间从10 min 增加到30 min时,CRL@ZIF-8 的衍射峰分布规律一致,表明反应时间对CRL@ZIF-8 的晶体结构没有显著影响。

图6 不同反应时间制备的CRL@ZIF-8 的酶活Fig.6 The enzymatic activity of CRL@ZIF-8 synthesized at different reaction times
由图6 可见,随着反应时间逐渐增加,CRL@ZIF-8 的酶活力逐渐提高,ZIF-8 原位封装CRL 30 min 制备的固定化酶的酶活力比反应10 min 制备的固定化酶的酶活力提高了260%。这可能是由于随着反应时间的增加,ZIF-8 载体的固载率上升。Biemmi 等[19]研究表明,随着反应时间增加,HKUST-1 的产率逐渐增加,而其晶体结构未发生改变。反应时间超过30 min 对CRL@ZIF-8 酶活力的影响有待于进一步的研究探讨。
2.1.3 2-甲基咪唑浓度对CRL@ZIF-8 的形貌结构和催化活性的影响
2-甲基咪唑浓度影响到ZIF-8 的形貌结构进而改变ZIF-8 的比表面积[20]。本研究考察了利用不同浓度的2-甲基咪唑制备的CRL@ZIF-8 的差异,结果如图7、图8、图9 和图10 所示。

图7 不同2-甲基咪唑浓度制备的CRL@ZIF-8 的FT-IR 图Fig.7 FTIR spectra of CRL@ZIF-8 synthesized by using different 2-methylimidazole concentrations
FT-IR 分析表明,随着2-甲基咪唑浓度的逐渐增加,ZIF-8 的特异吸收峰无显著差异,而1 600 cm-1~1 700 cm-1处出现蛋白质的酰胺键的特异吸收峰逐渐减弱(图7)。XRD 分析表明,CRL@ZIF-8 的衍射峰强度随着2-甲基咪唑浓度的增加逐渐增强(图8)。SEM分析表明,当2-甲基咪唑浓度为0.6 mol/L 时,大多数的CRL@ZIF-8 聚集成团,晶体形状不规则;随着2-甲基咪唑浓度逐渐增加,CRL@ZIF-8 逐渐分散,且形状越来越规则,结块现象消失;当2-甲基咪唑浓度为1.0 mol/L 时,CRL@ZIF-8 分散均匀,呈现标准的菱形十二面体的形态(图9)。这些研究结果表明,2-甲基咪唑浓度对CRL@ZIF-8 的形貌结构具有显著影响。Cui等[18]研究发现,通过改变2-甲基咪唑的浓度,ZIF-8 原位封装过氧化氢酶制备的固定化酶catalase@ZIF 的形貌发生改变,从标准的菱形十二面体的形态改变为十字花形态。Qi 等[13]研究表明,在ZIF-8 原位封装酶分子制备固定化酶的过程中,ZIF-8 材料并不是简单地将酶分子“包裹住”,相反,ZIF-8 材料与酶分子间发生了复杂的相互作用。本研究中未发现相似的形态改变现象,可能是因为脂肪酶CRL 与过氧化氢酶的结构不同导致的。

图8 不同2-甲基咪唑浓度制备的CRL@ZIF-8 的XRD 图Fig.8 XRD patterns of CRL@ZIF-8 synthesized by using different 2-methylimidazole concentrations

图9 不同2-甲基咪唑浓度制备的CRL@ZIF-8 的SEM 图Fig.9 The SEM images of CRL@ZIF-8 synthesized by using different 2-methylimidazole concentrations
通过对不同2-甲基咪唑浓度条件下制备的CRL@ZIF-8 的催化活力研究表明,随着2-甲基咪唑浓度从0.6 mol/L 增加到1.0 mol/L,CRL@ZIF-8 催化PNPB 水解的能力逐渐增强(图10)。CRL@ZIF-8 的酶活力增强可能是由于随着2-甲基咪唑浓度的提高,CRL@ZIF-8 的晶体形状逐渐规则,分散均匀,从而使得底物传递阻力减小,底物更容易接近酶的催化中心,从而提高了催化效率。这些研究结果证实了2-甲基咪唑浓度对CRL@ZIF-8 的形貌结构和催化活性具有重要的调控作用。
2.1.4 醋酸锌浓度对CRL@ZIF-8 的形貌结构和催化活性的影响
一般地讲,改变Zn2+供体浓度可以调控固定化酶的形貌结构和催化活性[18]。本研究考察了利用不同浓度的醋酸锌制备的CRL@ZIF-8 的差异,结果如图11、图12、图13 和图14 所示。
FT-IR 分析表明,随着醋酸锌浓度从0.5 mol/L 逐渐增加1.0 mol/L,CRL@ZIF-8 的特异吸收峰无显著差异(图11);XRD 分析表明,不同浓度的醋酸锌制备的CRL@ZIF-8 的衍射峰分布和强度基本一致(图12);SEM 分析表明,不同醋酸锌浓度条件下,CRL@ZIF-8的形状和大小没有明显的变化(图13)。这些研究结果表明,在本研究的试验条件下,醋酸锌浓度对CRL@ZIF-8 的形貌结构没有显著的调控作用。
通过对不同醋酸锌浓度条件下制备的CRL@ZIF-8 的催化活力研究发现,随着醋酸锌浓度从0.5 mol/L增加到1.0 mol/L,CRL@ZIF-8 的酶活力降低(图14)。这可能是由于在CRL@ZIF-8 的自组装过程中,高浓度的醋酸锌影响了脂肪酶分子CRL 的结构,导致了固定化酶催化活性的下降[13]。

图11 不同醋酸锌浓度制备的CRL@ZIF-8 的FT-IR 图Fig.11 FTIR spectra of CRL@ZIF-8 synthesized by using different zinc acetate concentrations
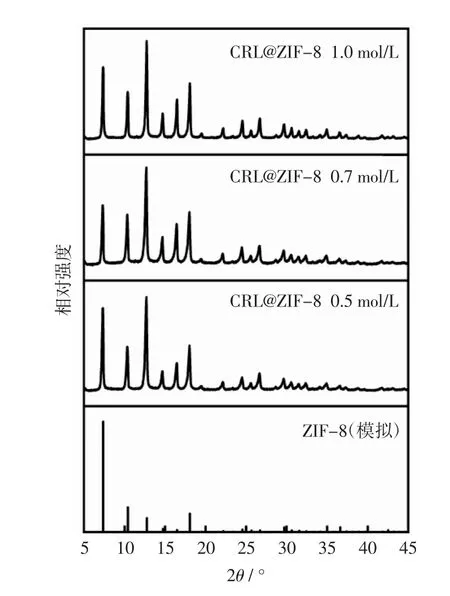
图12 不同醋酸锌浓度制备的CRL@ZIF-8 的XRD 图Fig.12 XRD patterns of CRL@ZIF-8 synthesized by using different zinc acetate concentrations

图13 不同醋酸锌浓度制备的CRL@ZIF-8 的SEM 图Fig.13 The SEM images of CRL@ZIF-8 synthesized by using different zinc acetate concentrations

图14 不同醋酸锌浓度制备的CRL@ZIF-8 的酶活Fig.14 The enzymatic activity of CRL@ZIF-8 by using different zinc acetate concentrations
综合分析上述研究结果,通过探究不同金属盐、反应时间、2-甲基咪唑和醋酸锌浓度对CRL@ZIF-8的影响,确定了合成CRL@ZIF-8 的条件:反应时间为30 min,2-甲基咪唑浓度为1.0 mol/L,醋酸锌浓度为0.5 mol/L。
2.2 CRL@ZIF-8 的温度耐受性
通过ZIF-8 载体原位自封装酶分子制备的固定化酶,可以借助ZIF-8 结构的刚性框架,有效地提升酶的稳定性[9-10]。本研究考察了CRL@ZIF-8 的温度耐受性,结果如图15 所示。
由图15 可知,分别将游离脂肪酶和固定化脂肪酶在50 ℃条件下保育30 min 后,游离脂肪酶CRL 的相对剩余酶活为48%,而CRL@ZIF-8 在30 min 时的相对剩余酶活为97%;保育60 min 后,游离脂肪酶CRL 的相对剩余酶活为43%,而CRL@ZIF-8 的相对剩余酶活为94%。因此,脂肪酶CRL 经过固定化之后,温度耐受性得到了显著提升。
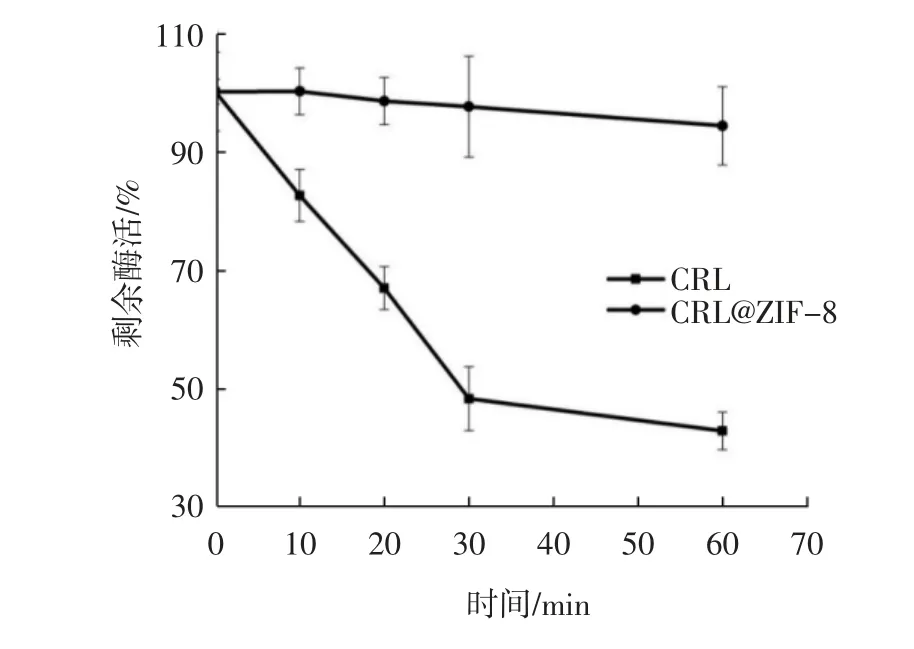
图15 游离酶CRL 和固定化酶CRL@ZIF-8 的温度耐受性Fig.15 The temperature tolerance of CRL and CRL@ZIF-8
3 结论
本研究采用ZIF-8 材料原位自封装皱褶假丝酵母源脂肪酶(CRL)制备固定化脂肪酶(CRL@ZIF-8),研究了金属离子来源、反应时间、金属离子和有机连接体的浓度等因素对固定化酶催化活性和形貌特征的影响。结果表明,在反应时间为30 min,2-甲基咪唑浓度为1.0 mol/L,醋酸锌浓度为0.5 mol/L 时,合成的CRL@ZIF-8 酶活力最高,达到9.8 U/g。通过比较游离酶和固定化酶的温度耐受性,发现固定化后的脂肪酶CRL@ZIF-8 的温度稳定性有较大提升。
