微塑料在菲降解过程中对融合菌株F14的影响
2021-03-15周昌鑫侯彬郭学涛高乔刘怡暄卢静
周昌鑫,侯彬,郭学涛,高乔,刘怡暄,卢静*
(1.中北大学环境与安全工程学院,太原030051;2.西北农林科技大学资源环境学院,陕西 杨凌712100)
塑料及其制品广泛应用于工业、农业和日常生活的各个领域,全球塑料产量在2015年就已经超过3亿t,预计到2035年塑料年产量将增加一倍[1−2]。其中,聚乙烯(PE)塑料被大规模生产,主要用于农业覆盖物、复合材料和包装用品[3]等多个方面。在农业领域,大量低密度PE薄膜被用于保护作物、抑制杂草、调节温度和保持土壤中的水分等,随着时间的推移,这些薄膜会变得易碎并被分解为微小颗粒[4],即微塑料(MPs,直径小于5 mm)[3,5]。这些微小颗粒会以空气作为载体,在土壤中富集。MPs所带来的危害不只来自于它本身(如:增塑剂长期暴露会引起生殖、呼吸、内分泌等多系统的损伤)[6−8],更严重的是,MPs可以作为其他污染物的载体,如重金属、持久性有机污染物(POPs)、疏水性有机化学品(HOC)[9−11]等。
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)作为一类持久性有机污染物广泛存在于自然界中,微生物代谢是降解环境中PAHs等有机污染物的重要手段[12]。融合菌株F14是以菲降解菌Sphingomonas sp.GY2B和芘降解菌Pseudomomas sp.GP3A为亲本,通过原生质体融合技术构建的一株高效降解PAHs的降解菌。该菌具备比亲本更广的温度(20~40℃)和pH(6.5~9)适应范围,更高效的PAHs降解性能,而且具有和亲本GY2B不同的菲降解途径,F14具有两条菲代谢途径并且在降解过程中较少积累有毒中间代谢产物。F14可以在30 d将土壤中初始浓度为10 mg·L−1和50 mg·L−1的菲降解89.9%和73%,并可以耐受100 mg·L−1的菲[13]。然而,这些数据都是在实验室条件下得到的,如果将融合菌株F14应用到实际环境中,环境中微塑料的存在是否会影响F14对PAHs的降解,是否会威胁或有助于F14的生存,这都需要进一步的研究。
目前,对环境中微塑料的研究主要集中在分布[14−15]、吸附降解[16]、生物及群落[17]的影响等方面,涉及对微生物个体影响的研究[2,18]相对较少。因此,本研究以聚乙烯微塑料(PE−MPs)为研究对象,探究受微塑料影响前后F14细胞的表面形态、胞外聚合物(Extracellular polymeric substances,EPS)化学成分变化及细胞内活性氧(Reactive oxygen species,ROS)含量,考察在降解菲过程中微塑料对F14的影响,为进一步评价融合菌株F14在实际PAHs土壤污染场地修复中的潜在应用提供科学依据和理论基础。
1 材料与方法
1.1 试验材料
研究所使用的菲(98%)、甲醇(色谱纯)、正己烷(分析纯)、PE−MPs(粒径为500μm和1 mm)等试剂,均购自上海阿拉丁生化科技股份有限公司;营养肉汤购自广东环凯微生物科技有限公司。每次试验前须将PE−MPs置于超净台中进行紫外灭菌处理。无机盐基础培养液(MSM):分别取5 mL磷酸盐缓冲液(KH2PO48.5 g·L−1,K2HPO4·H2O 21.75 g·L−1,Na2HPO4·12H2O 33.4 g·L−1,NH4Cl 5.0 g·L−1,3 mL MgSO4水溶液22.5 g·L−1,1 mL CaCl2水溶液36.4 g·L−1,1 mL FeCl3水溶液0.25 g·L−1)和1 mL微量元素[MnSO4·H2O 39.9 mg·L−1,ZnSO4·H2O 42.8 mg·L−1,(NH4)6Mo7O24·4H2O 34.7 mg·L−1]并定容至1 L,调节pH为6.8~7.0,灭菌20 min后备用。
含有菲的无机盐培养液(100 mg·L−1):在灭菌的三角瓶中加入适量的菲标准储备液(5 g·L−1,正己烷为溶剂配制),待正己烷挥发完毕,加入灭菌后的MSM。
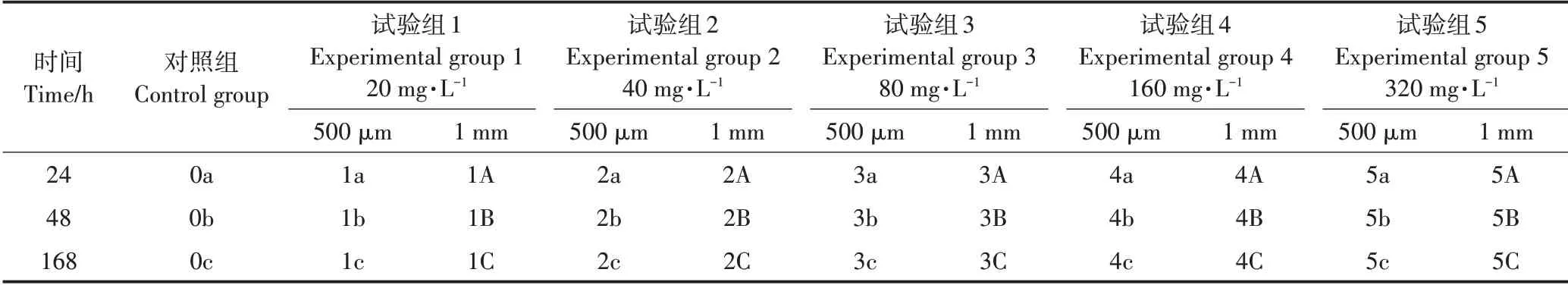
表1 对照组及主要试验组编号Table 1 Number of control groups and experimental groups
1.2 PE−MPs对F14降解菲的影响
在含有菲的MSM培养基(20 mL)中仅加入菌液,不添加PE−MPs,设为对照组。在对照组的基础上分别加入粒径为500μm、1 mm,浓度为20、40、80、160、320 mg·L−1的PE−MPs,设为试验组,如表1所示。每个试验组均对应设置空白组(仅含有对应浓度和粒径的微塑料,不含菌株)。所有样品30℃避光振荡培养。添加不同质量浓度的PE−MPs,分别在第3、6、9、12、15、18、21、24、48、168 h取样测定菲的降解率,每组试验设置3个平行样。
1.3 菲降解率的测定
在待测样品中加入适量的甲醇,超声处理整瓶萃取,用甲醇定容至50 mL。取1.5 mL溶液过0.22μm有机滤膜后移入色谱瓶中,使用岛津(20A)高效液相色谱(HPLC)测定菲的剩余量,计算菲的降解率,计算公式如下:
式中:A0表示相应空白组对应的峰面积;A表示对照组和试验组样品对应的峰面积。
1.4 扫描电镜(SEM)分析
利用扫描电镜(SU8010,日立)观察PE−MPs存在情况下菌株细胞表面形态变化。离心收集(10 000 r·min−1,10 min)对照组、3c、3C、5c和5C试验组细胞样品,并将PE−MPs颗粒分出,单独观察PE−MPs表面生物膜的形成情况。剩余菌体则用于分析游离在培养基中的菌株的细胞形态变化。样品使用2.5%戊二醛完全浸没固定12 h后,用磷酸缓冲液漂洗,再用1%的锇酸溶液固定样品2 h,漂洗,接着用梯度浓度的乙醇溶液(30%、50%、70%、80%、90%和95%)对样品进行脱水处理,最后用乙醇与醋酸异戊酯混合液(V/V=1/1)处理样品30 min,再用醋酸异戊酯处理样品1 h,干燥,镀膜,观察。不含菌株的PE−MPs颗粒直接干燥,镀膜,观察。
1.5 傅里叶变换光谱(FTIR)分析
离心收集(10 000 r·min−1,10 min)试验组4、试验组5和对照组细胞样品,冻干(−80℃),使用红外光谱仪(Nicolet Is10,Thermo Fisher)进行测试(KBr压片),分析F14细胞表面的主要成分变化。
1.6 细胞活性氧(ROS)测定
离心收集(10 000 r·min−1,10 min)对照组和试验组24、48 h和168 h的细胞,采用ROS酶联免疫分析试剂盒进行测试。450 nm波长下用酶标仪测定吸光度(OD值)。通过标准曲线,计算样品中ROS浓度。
2 结果与讨论
2.1 PE−MPs对F14降解菲过程的影响
添加不同粒径和不同质量浓度的PE−MPs后F14对菲的降解效果如图1所示。从图中可以看出,在添加了不同浓度的500μm和1 mm微塑料后F14对菲的降解趋势大体一致。24 h内,添加微塑料后F14对菲的降解率明显增高,且随着微塑料浓度增大,F14对菲的降解率也逐渐升高;48 h后,试验组和对照组的菲降解率均基本达到100%;168 h后,对照组和试验组中菲的降解率均达到100%。这表明PE−MPs在一定程度上促进了F14对菲的降解,可能是由于PE−MPs为F14提供了载体,有利于其发挥更高的生理活性,同时也增加了F14和菲的接触机会[19]。此外,PE−MPs表面分子的疏水性使得其与环境中的水分子之间存在界面,这种界面也可能为F14生物膜的形成提供了空间[20]。
2.2 PE−MPs对F14菌株化学成分的影响
通过FTIR对添加PE−MPs前后培养体系中的F14菌株化学成分进行分析鉴定,结果如图2所示。3 700~3 050 cm−1区间出现的峰是由羟基、羧基、酚羟基等O—H键和酰胺的N—H振动引起。位于2 930 cm−1处的峰是由C—H振动(脂质或蛋白质的CH2和CH3官能团)引起[21]。FTIR光谱中蛋白质特征峰主要是:位于1 640 cm−1处的酰胺Ⅰ带(1 700~1 600 cm−1),为CO伸缩振动;位于1 540 cm−1处的酰胺Ⅱ带(1 600~1 500 cm−1),是N—H弯曲振动和C—N拉伸振动的耦合产生[22];1 450 cm−1处为蛋白质中的C—N键的吸收峰,且氨基在1 450~1 250 cm−1区域存在面内摇摆振动和面外摇摆振动两个峰。由图可以看出,对照组和试验组红外吸收的相对强度存在明显变化。图2A至图2D显示,培养的第24 h和48 h试验组对应的蛋白质的特征峰相对强度增强,这说明PE−MPs存在时F14菌株的生长代谢过程更加旺盛[23]。1 080 cm−1处吸收峰归属于核酸中PO2基团的特征峰[22],试验组培养第24 h和48 h时,该吸收峰的相对强度增加,这说明PE−MPs的存在促进了F14菌株的核酸转录等过程,促进了F14的生长繁殖[24]。1 150~750 cm−1的峰归属于多糖[25],多糖和蛋白质是EPS的关键成分,其源于细菌的分泌和表面黏附,细胞聚集和裂解等多种微生物生理过程[26−27]。第24 h和48 h测试结果显示,试验组多糖的相关特征峰相对强度明显增强,表明PE−MPs的存在会影响F14细胞EPS的分泌。
在培养的第24 h和48 h,试验组的蛋白质、核酸、多糖的相对含量明显增加,且320 mg·L−1试验组略高于80 mg·L−1;在第48 h,500μm试验组相对含量略高于1 mm试验组。第168 h(图2E和图2F)的测试结果显示,试验组与对照组具有相当的蛋白质、核酸、多糖水平。这可能是由于在第24 h和48 h时,F14在PE−MPs存在的环境下,应激产生了更多的EPS,在第48 h之后,由于培养基中的菲基本都被降解,同时,F14对PE−MPs的环境基本适应,致使试验组F14菌株的生长代谢过程放缓,保持正常水平,因此,第168 h时,试验组和对照组的红外测试结果基本相似。
2.3 PE−MPs对F14表面形态的影响
添加PE−MPs前后F14表面形态的变化及PE−MPs表面变化见图3。结果显示,与对照组相比(图3A),添加PE−MPs后细胞出现了凹陷现象,这可能是由于添加PE−MPs引起了细胞内外渗透压的变化[28],进而造成了细胞表面形态的变化。同时也观察到细胞出现了丝状物。与未添加微生物的PE−MPs(图3G)相比,添加了微生物的PE−MPs表面细胞分泌出更多的丝状物,结合FTIR结果推测其可能为微生物分泌的EPS,这些EPS将菌团聚在一起(图3I),也将菌和微塑料连接在一起,使菌能够附着在微塑料上,这可能有利于微生物降解微塑料表面的菲。另外,从图中可以看到生物膜中丝状的生物膜基质,生物膜能为微生物生长提供一系列的有利条件,如有利于微生物对营养物质的吸收,并且能够帮助微生物抵御有毒物质和干燥环境[29−30]
2.4 PE−MPs对F14细胞ROS的影响
细胞中过量ROS的产生会降低细胞的生理活性,甚至导致细胞死亡[31]。因此,大量ROS产生是细胞氧化损伤的重要标志[32]。然而,少量的ROS会激发细胞的防御体系,减少损伤[33]。在不同浓度和粒径的PE−MPs存在下,F14在对菲降解过程中细胞内ROS的生成量结果如图4所示。结果表明,在培养24、48 h和168 h后,试验组细胞内ROS水平均低于对照组。对于粒径为500μm和1 mm的PE−MPs,随着其浓度的增加,F14细胞内ROS产生量基本呈降低趋势。随着培养时间的延长,试验组细胞ROS的产生量也有所下降。试验组细胞ROS的产生量主要与PE−MPs的浓度有关,粒径对细胞ROS的产生量没有明显的影响。PE−MPs的存在使得F14细胞ROS保持在较低水平,从而减弱了细胞自身的氧化损伤,使其能够保持较高的生理活性,促进其对菲的降解。同时,SEM与FTIR测试表明,EPS分泌量受PE−MPs的影响而增加。EPS是微生物正常生理过程产生的分泌物,可以形成细胞保护层[34−35]。当生存环境发生变化时,微生物的自我保护和生存机制将发挥作用,进而引起微生物EPS分泌量的波动[36−37]。因此,PE−MPs的存在可能对F14细胞产生了刺激作用,使其应激产生了更多的EPS,这有利于F14黏附于PE−MPs表面而生长。因此,F14菌株对于PE−MPs存在的环境具有较强的适应性。
3 结论
(1)试验粒径和浓度范围内PE−MPs的存在并没有抑制F14对菲的降解,反而促进了对菲的降解。PE−MPs的存在可能会使F14分泌更多的EPS并形成生物膜,进而有利于F14对菲的降解。
(2)PE−MPs的存在使F14菌株细胞ROS保持较低水平。随着PE−MPs浓度的增加和培养时间的延长,细胞ROS产生量逐渐降低。说明PE−MPs的存在可能会激发F14细胞的防御体系,减少F14细胞的氧化损伤,使其可以保持更高的生理活性,进而有利于对菲的降解。
