土壤微塑料和农药污染及其对土壤动物毒性效应的研究进展
2021-03-15薛颖昊黄宏坤靳拓陈思徐湘博李少华宝哲居学海习斌
薛颖昊,黄宏坤,靳拓,陈思,徐湘博,李少华*,宝哲,居学海,习斌
(1.农业农村部农业生态与资源保护总站,北京100125;2.深圳大学生命与海洋科学学院,深圳大学海洋生物资源与生态环境重点实验室,广东 深圳518061;3.中国科学院地理科学与资源研究所,生态系统网络观测与模拟重点实验室,CERN综合研究中心,北京100101)
塑料因其耐用性、可塑性和成本低等特点,被人们广泛应用于日常生产生活中。2018年,全球塑料产品产量已达3.59亿t[1];但是,塑料垃圾的不当处理则会对环境造成严重污染。截至2015年,全球已累计产生超过60亿t的塑料垃圾,其中约有80%被填埋或排放到环境中[2]。在物理、化学和生物等因素的作用下,塑料垃圾可进一步分解成细小碎片,而小于5 mm的塑料碎片统称为微塑料(Microplastics)[3−4]。此外,具有特定尺寸的塑料微珠(个人护理产品和牙膏中的微珠)也是微塑料的重要来源[5]。与较大的塑料颗粒相比,微塑料更易转移和扩散,从而导致大量的微塑料颗粒分布在土壤、海洋和空气中。近年来,微塑料污染引起了全球公众和科学界的广泛关注。目前,人们在陆地、海洋和大气中发现了大量的微塑料,并且在无脊椎动物、鱼类和鸟类等生物体内也有发现[6−10]。更重要的是,人类也可以通过呼吸和食物链摄入微塑料[11]。研究表明,微塑料可能会引起生物体氧化应激、细胞毒性和慢性炎症,增加罹患癌症的风险[12−13]。
农药是一种特殊的化合物,用于杀死包括昆虫和啮齿动物在内的各种害虫以及杂草,可用来提高农作物的产量和质量。全球连年不断的虫害经常破坏农作物,给农民带来巨大的经济损失,造成了农药需求的成倍增长[14]。但是,农业生产中只有0.1%的农药达到了施药目标,剩下的农药则会造成环境污染[15−16]。根据《斯德哥尔摩公约》,有机氯农药(如滴滴涕)已被归类为持久性有机污染物。农药的活性物质会造成土壤环境污染、影响土壤微生物的生存、扰乱植物根系微生物群落和破坏土壤酶活性[17−18]。不仅如此,农药被认为是对人类健康具有潜在危害的化学品。个人短时间内接触大量农药会导致皮肤灼伤、水疱、皮疹、失明、腹痛腹泻和呕吐等[19];而长期接触农药则会导致癌症、出生缺陷、生殖异常、神经毒性甚至死亡[20]。由于农药的持久性和生物不可降解性,它们已成为生态系统的重要威胁之一。
研究表明,微塑料可吸附土壤中的农药和其他有害化学物质[21],并起到浓缩的作用。被吸附的污染物可能会通过生物体的误食而进入食物链[22]。近年来,人们开始关注土壤中农药与微塑料之间的相互作用、相关的转运过程以及二者对生物的毒性作用。本文综述了微塑料和农药对环境的影响、微塑料对农药的吸附作用以及对土壤动物的生态毒理效应,对评估微塑料和农药对土壤生态安全的影响具有重要意义。
1 微塑料对土壤环境的污染
1.1 土壤微塑料污染现状
由于中国是全球最大的塑料生产国,世界上绝大多数土壤微塑料检测研究主要在中国开展(表1)。在毗邻渤海和黄海的中国沿海地区土壤中,微塑料丰度较高,达到1.3~14 712.5个·kg−1[23]。在黄土高原,微塑料在不同类型的土壤(农业土、果园土和温室土)中均有检出[24];上海郊区稻鱼共培生态系统和菜园中微塑料浓度分别为10.3~2.2个·kg−1和78.0~12.9个·kg−1[25−26];而在云南,微塑料在滇池周边区域的土壤中 高 达7 100~42 960个·kg−1,平均约18 760个·kg−1[27]。世界上其他地区的土壤也有被微塑料污染的报道。在澳大利亚悉尼工业区,当地土壤中的微塑料浓度在300~67 500 mg·kg−1之间[28];瑞士洪泛区90%的土壤中存在微塑料污染[29]。在智利,施用污泥的农业土壤中存在大量微塑料污染,约为0.6~10.4个·g−1,研究发现土壤微塑料浓度主要取决于污泥的施用量[30]。
微塑料一旦进入土壤,其在地表径流、农业耕作、农作物收获和生物扰动的作用下很容易扩散[31]。微塑料密度通常小于土壤颗粒,从而可改变土壤容重[32]。微塑料与土壤基质结合会改变土壤孔隙度,影响土壤水分动力学和土壤聚集性。研究发现,聚乙烯(PE)微塑料污染会增大土壤的比表面积,加速土壤水分蒸发[33];在盆栽和田间试验中,将超细聚酯纤维加入黏性土中会显著增加大团聚体(>2 mm)的数量和孔隙(>30μm)的体积[34]。微塑料还会破坏土壤结构的完整性,导致土壤表面干燥龟裂。Liu等[35]研究了微塑料对土壤溶解性有机质的影响,发现在中国黄土土壤中加入聚丙烯(PP)微塑料(28%m/m)显著提高了其溶解性有机碳、氮和磷的水平,表明微塑料的积累可能会影响土壤生态系统的养分循环过程。然而,微塑料参与这些土壤生态循环过程的潜在机制尚未阐明。
1.2 微塑料对土壤动物的毒性效应
微塑料对土壤动物的毒性影响见表2。微塑料暴露对鼠妇(Porcellio scaber)的摄食率、排便率、体质量、死亡率和能量存储等生物指标均无显著影响[37];但暴露于5 mg·m−2的微塑料2 d后,秀丽隐杆线虫(Caenorhabditiselegans)的存活率、体长和繁殖被显著抑制[38]。蚯蚓作为土壤食物链中的主要动物之一,在土壤肥力、新陈代谢和维持土壤生态系统结构与功能等方面发挥着重要作用。PE在农业中应用广泛,导致形成的PE微塑料在土壤中占主导地位[39]。研究表明,低密度聚乙烯(LDPE)微塑料会引起蚯蚓(Eisenia fetida)体壁损伤和氧化应激反应[40];聚苯乙烯(PS)微塑料在肠道积累会引起蚯蚓肠细胞变化和DNA损伤[41]。Prendergast−Miller等[42]发现,暴露和摄入聚酯纤维(Polyester)对正蚓(Lumbricusterrestris)没有致死性,但蛀洞量降低,与生物应激标志物有关的金属硫蛋白−2(mt−2)的表达增加了24.3倍,热休克蛋白(hsp70)的表达降低。
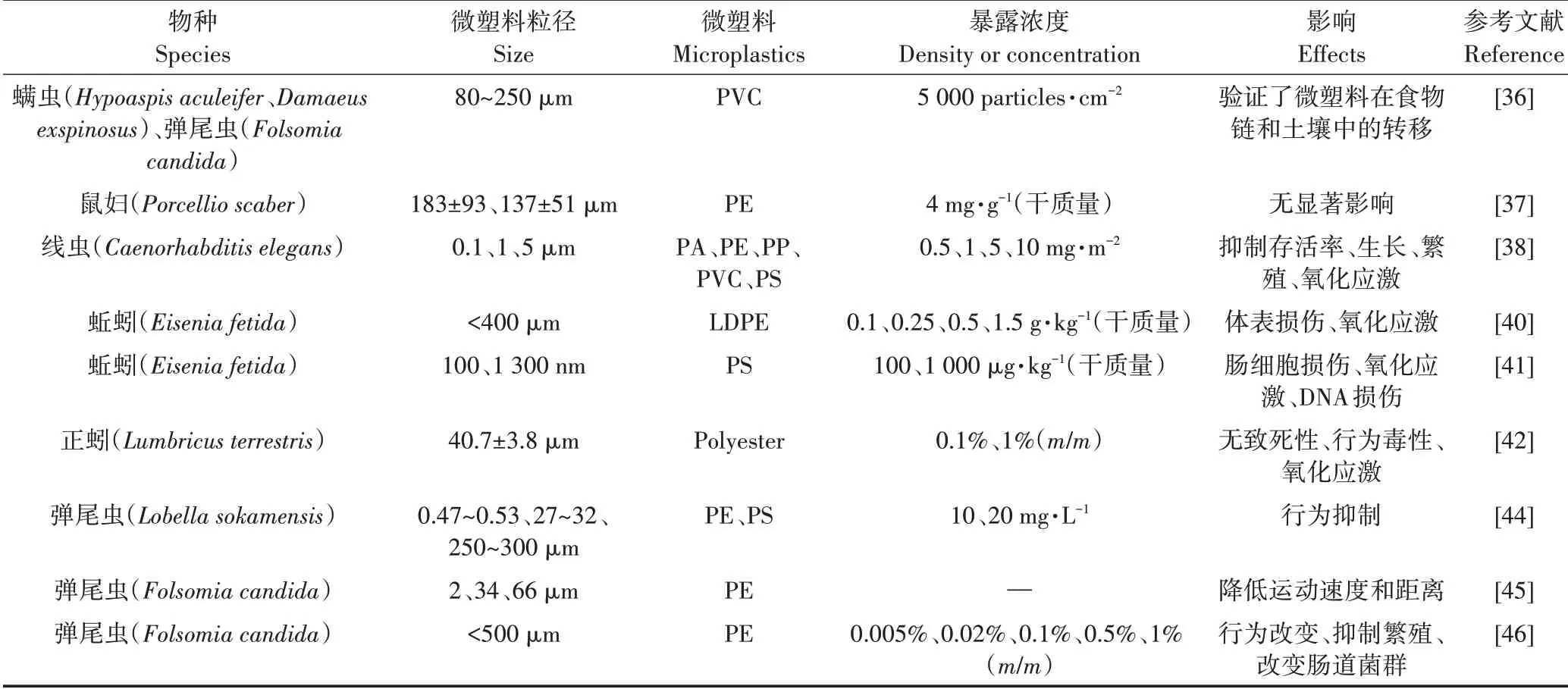
表2 微塑料对土壤动物的毒性效应Table 2 Toxicological effects of microplastics on soil animals
由于土壤特性与土壤生物体的行为直接相关,因此确定生物体行为与土壤污染物之间的关系有助于了解其生态风险。Zhu等[36]报道,当存在捕食关系时,微节肢动物对土壤中微塑料的运输和分布能力显著增强。弹尾虫对化学物质高度敏感,是常用于评估生态毒性的模式生物之一[43]。Kim等[44]观察到土壤微塑料污染会干扰弹尾虫(Folsomia candida)的运动。进一步研究表明,弹尾虫可摄入尺寸小于(66.0±10.9)μm的微塑料;与对照组相比,摄入小于该尺寸的微塑料导致弹尾虫的运动速度和距离显著降低了74%±38%[45]。Ju等[46]发现,暴露于0.5%和1%(m/m)浓度微塑料下的弹尾虫表现出躲避行为,躲避率分别为59%和69%;与对照组相比,1%浓度微塑料使其繁殖率降低了70.2%;微塑料显著降低了弹尾虫肠道微生物多样性,具有明显的毒性作用。
2 农药对土壤环境的影响
2.1 农药对土壤健康的影响
农业生产中过度使用农药会导致土壤环境的污染,并且农药会随着地表径流、土壤渗透、地下径流等方式进入地表水,污染水环境(图1)。土壤微生物与土壤有机碳含量密切相关,能及时反映或预示土壤的变化,常作为土壤质量的生物指示指标[48]。农药会影响土壤中微生物的多样性和活性,引起微生物基因突变,产生耐药性。在大多数情况下,施用农药会杀死部分种类微生物,随后具有耐药性的微生物会占据死亡微生物的生态位,进而改变微生物群落结构[49]。Chen等[50]研究发现,苯菌灵、克菌丹和百菌清等杀真菌剂能够破坏土壤中某些真菌的活性,导致细菌活性泛滥;类似地,在使用戊菌隆、二氰蒽醌或咪鲜胺等杀菌剂后,土壤中非病原性腐生真菌的数量明显减少[49]。White等[51]发现,向土壤中加入百菌清杀真菌剂后,土壤中某些除草剂的稳定性反而提高,如莫多草和异丙隆的稳定性分别提高了2倍和4倍,表明某些农药的混合使用不会影响其他农药的药效和特征。农药还会引起细菌代谢紊乱,导致土壤酶活性降低,破坏氮循环和平衡[52]。少数种类细菌,如Arthrobacter sp.、Achromobacter sp.和Streptomyces sp.,可以降解并利用农药来促进生长、维持活性,这说明土壤微生物可进化出独特机制以适应被农药污染的新环境[53]。然而,目前生活在土壤中的大多数微生物物种尚未得到充分研究,人们对它们在土壤生态系统中的作用和功能知之甚少,农药影响土壤微生物活性的研究依然不足。
土壤酶主要由土壤微生物、植物根系和土壤动物分泌并合成,可提供有关土壤健康和生物群落功能的有用信息,是反映土壤健康的另一个生物指标[54−55]。研究发现,固定在蒙脱石上的磷酸酯酶比游离磷酸酶、有机磷酸酶和有机−矿物−复合磷酸酶受到农药(西维因和莠去津)的影响更小,说明某些土壤可以保护酶免受农药的抑制作用[56]。Dilly等[57]研究表明,特定化合物的存在可以诱导或抑制酶的活性,而不会改变微生物的生物量。一些杀虫剂,如喹硫磷、久效磷和氯氰菊酯,在单次或联合剂量的最高浓度下会降低脱氢酶的活性,而在较低的浓度下则会刺激其活性[58];氟乐灵、狄氏剂和西马津的使用会降低土壤中脱氢酶的活性[59],而二嗪农则会刺激其活性[60]。类似地,使用草甘膦后,土壤中脲酶活性增加,而磷酸酶的作用则受到抑制[53]。Cycoń等[61]认为,造成不同农药与土壤酶活性之间的差异可能与土壤性质和微生物组成有关。
2.2 农药对土壤动物的毒性效应
蚯蚓是土壤生态系统的关键物种,在环境中与土壤固相和水相自然接触,因此经常能接触到农药,可用于评估农药的生态风险[62]。农药被证明对蚯蚓具有神经毒性、氧化应激、引起组织病变、减少肠道菌群,甚至死亡(表3)[63−65]。Rico等[64]发现,多菌灵对蚯蚓具有较高毒性(LC50=2 mg·kg−1),乐果对蚯蚓表现出中度急性毒性(LC50=28 mg·kg−1),而敌百虫、戊唑醇和咪鲜胺的毒性最低(LC50>100 mg·kg−1)。蚯蚓在暴露期间,其生物利用度和生物积累受土壤和农药性质的影响,比如黏土含有较多的吸附位,与农药结合后导致蚯蚓额外摄入更多农药[66]。目前,自然界土壤中常含有多种农药污染物,由于存在复杂的协同和拮抗反应,单从作用方式评估农药的综合毒性效应较为困难[67]。
由于物种、代谢、个体和其他特性等差异,不同生物体对农药的敏感性大不相同。Jegede等[68]报道,在螨类试验中,28℃时乐果和毒死蜱对螨虫繁殖率的毒性作用比20℃时减少104~105(EC5028℃=1.42 mg·kg−1和2.52 mg·kg−1,EC5020℃=6.18 mg·kg−1和10.09 mg·kg−1);在弹尾虫试验中,26℃时乐果和毒死蜱对弹尾虫繁殖率的毒性作用低于20℃(EC5026℃=0.11 mg·kg−1和0.018 mg·kg−1,EC5020℃=0.29 mg·kg−1和0.031 mg·kg−1),而溴氰菊酯的情况则相反(EC5026℃=12.85 mg·kg−1,EC5020℃=2.77 mg·kg−1);说明不同温度下暴露于相同浓度的农药会导致生物体不同的毒性反应[69]。Alves等[70]通过模拟农药环境预估浓度试验,发现芬普尼和吡虫啉会显著降低弹尾虫的繁殖率,而噻虫嗪、克菌丹、萎锈灵+福美双则无影响。此外,农药还会诱导弹尾虫Cyp6、ABC和GABA基因表达,尤其是在低浓度下,基因表达先于生物反应发生[71],这说明基因终点可作为农药毒性评估的新方法。

表3 农药对土壤动物的毒性效应Table 3 Toxicological effects of pesticides on soil animals
3 微塑料与农药的联合作用
3.1 微塑料吸附农药研究进展
农业PE膜由于具有蓄水、保湿、改善土壤水热条件和提高作物产量的功能,在农业生产中具有广泛的应用[72]。但这些塑料制品的回收率不到60%,除了分解形成微塑料,还会吸附农药,形成二次污染。农药缓慢吸附在地膜上的同时,地膜还提高了农药的稳定性,使其不会自行降解[73−74]。相较于菲(Phenanthrene),滴滴涕对PE和聚氯乙烯(PVC)微塑料的亲和力更高,表明微塑料易富集环境中有机氯农药,增加环境污染[75]。Wang等[76]研究了PE微塑料对多菌灵、敌百虫、除虫脲、马拉硫磷和苯醚甲环唑的吸附能力;热力学研究表明5种农药的吸附均为自发放热的过程;所有农药主要通过疏水相互作用吸附在微塑料上,其吸附动力学和等温线分别与伪二级模型和Freundlich模型相符,说明吸附过程除了吸附在微塑料表面外,还涉及到质量传递和粒内扩散,吸附过程主要受物理和化学作用的控制;各农药在PE微塑料上的吸附量依次为除虫脲>苯醚甲环唑>马拉硫磷>多菌灵>敌百虫。较高的温度有利于微塑料对农药的吸附[77]。农药在微塑料上的吸附还取决于其辛醇/水分配系数,疏水性较强的农药通常吸附作用更显著;微塑料的存在使农药在土壤中的残留比例从4%提高到了15%,富集农药的微塑料会通过土壤系统迁移至地下水,造成水源污染[78]。
微塑料与化学物质之间的相互作用不仅受到化学物质性质和溶液化学性质的影响,还受到微塑料理化性质的影响[79−80]。因此,可降解微塑料和不可降解微塑料对农药的吸附特性可能存在较大差异。Gong等[81]报道了不可降解微塑料(PE、PS、PVC、PP)和生物可降解微塑料(聚乳酸PLA、聚丁二酸丁二醇酯PBS)对芬普尼的吸附行为,结果表明,PLA和PBS的吸附速率远高于PE、PP、PVC和PS,芬普尼在微塑料上的吸附量依次为PBS>PLA>PP>PE>PS>PVC;等温线结果表明,芬普尼在PE、PS、PVC和PP上的吸附符合Langmuir模型,而Freundlich模型则是PLA和PBS的最适模型。杀菌剂在PBS上的吸附不受环境因素(盐度、pH值和溶解有机质)的影响,但这些因素显著降低了其在PE和PVC上的吸附,说明可降解微塑料在不同环境下吸附农药的相对稳定性更高[82]。Li等[83]发现丙硫菌唑能促进塑料降解,与PE相比,聚对苯二甲酸丁二醇-己二酸丁二醇共聚酯(PBAT)降解速度更快,丙硫菌唑还影响了土壤中微塑料对重金属的吸附/释放特性。
3.2 微塑料吸附农药的机理
吸附过程与被吸附物和吸附剂的物理化学性质有关,其机理取决于两者之间的相互作用,可以由特定的相互作用所主导,也可以是不同相互作用的联合结果。其中,疏水和静电相互作用是许多化学污染物吸附的主要机制[86−88]。疏水相互作用涉及非极性(或微极性)分子对非极性微塑料表面的吸引力,是控制微塑料吸附疏水性有机化学物质的主要机制之一[89−91]。静电相互作用则是由带相反电荷的分子相互吸引或带相似电荷分子相互排斥引起的。通常,微塑料零点电荷的pH值低于周围环境pH值,导致微塑料表面带负电[92−94]。那么,微塑料表面的负电荷(例如PE、PP、PS、PVC)可能会吸引带正电荷的物质[95]。但是,对于主要以阴离子形式存在的化学物质,微塑料表面的静电排斥力则会降低吸附作用[96]。因此,是否发生静电相吸或排斥,取决于介质的pH值、聚合物的零点电荷和农药成分的酸解离常数等因素。
氢键是一种以氢离子为媒介的特殊弱静电相互作用。当涉及到质子给体和质子受体之间的相互作用时,氢键会影响聚合物的吸附[92]。范德华力是分子之间发生的弱相互作用,与共价键或离子键无关;而π−π相互作用是芳香族分子之间的相互吸引;范德华力和π−π相互作用都有可能会促进化学物质在微塑料表面的吸附。PE和PVC属于脂肪族聚合物,会产生范德华力;而PS是芳香族聚合物,会发生π−π相互作用[97−98]。由于π−π相互作用力更强,与PE、聚酰胺(PA)和PVC相比,PS对芳香族化合物的吸附值更高[91]。
3.3 微塑料与农药对土壤动物的联合毒性效应
农业地膜和农药在农业中的广泛使用,必然导致这两种残留物在农业土壤中长期共存[99−100]。因此,有必要研究微塑料和农药对土壤动物的复合影响。研究表明,蚯蚓会通过掘洞将微塑料从土壤表面转运至深层土中[101]。Yang等[102]研究了蚯蚓对LDPE微塑料/草甘膦在土壤中转移的影响,在与地表相连接的蚯蚓洞中检测到较高浓度的草甘膦,表明蚯蚓可作为载体将污染物从地上转移到地下;微塑料和草甘膦的联合作用影响了洞穴体积和蚯蚓活性,减少了向坑道内引入污染物的数量。Cheng等[103]发现,相比单独暴露于莠去津或LDPE微塑料,联合暴露导致蚯蚓产生更大的氧化应激反应,同时引起Hsp70、ANN、TCTP和CRT基因的表达异常,这表明微塑料有增强莠去津在生物体内毒性的潜力。生物积累分析表明,微塑料显著增加了毒氟磷在蚯蚓体内的生物积累,暴露14 d后可观察到氧化损伤;代谢组学结果表明,微塑料与毒氟磷的联合暴露显著改变了蚯蚓体内14种代谢产物和2种代谢途径的相对丰度,但微塑料增强毒氟磷在蚯蚓体内积累和毒性机理尚不清楚[104]。目前,微塑料与农药对土壤动物联合毒性效应的研究仍处于起步阶段;微塑料吸附农药以及微塑料是否会增强土壤中农药毒性、微塑料吸附农药后对土壤动物的联合毒性等相关研究仍然匮乏。
4 存在问题和展望
目前,微塑料联合污染物的研究主要集中在海洋和陆地水环境污染方面,主要涉及多环芳烃、多氯联苯和金属对水生生物的复合影响。然而,与污染物单一毒性相比,微塑料是否会增强水生环境中污染物毒性仍存在争议。土壤是一个包含多种介质的复杂生态系统,其介质特性对微塑料吸附农药的影响有待进一步研究。微塑料和农药都有可能会对生物行为产生影响,但有关微塑料联合农药对土壤动物的研究依然有限,关于这方面的研究仍需加强。同时,评估微塑料吸附农药的环境风险不仅需要测定不同类型塑料的实际吸附能力,还需要研究不同环境因素(如温度、pH值、盐度、溶解有机物以及其他共存离子)对吸附过程的影响,这些因素会通过改变微塑料的表面特性或农药的理化性质进而干扰吸附作用。为解决地膜残留引起的农田“白色污染”问题,全生物可降解地膜替代技术已成为农业生产的新趋势。而大多数研究涉及的是不可降解塑料(如PE、PVC、PP、PS)对农药的吸附行为,农药和生物可降解微塑料之间的相互作用以及环境因素的影响仍不清楚。由于生物可降解微塑料和常规微塑料的结构不同,环境因素对其吸附行为的影响很可能存在差异,需对它们的吸附行为进行系统比较。
