磺酸基配体单核钴配合物的合成、晶体结构及性质
2021-03-15侯明志王昌赫
关 磊,侯明志,霍 鹏,王 莹,王昌赫
(辽宁石油化工大学石油化工学院,辽宁抚顺113001)
以往研究者认为磺酸基是弱配位官能团,但经过深入研究发现,其包含3个氧原子,具有灵活的配位方式和较强的氢键形成能力[1⁃3]。磺酸基的配位能力是可以调节的,在芳香磺酸基配体上引入其他官能团(-OH、-COOH或-NH2)或者有其他氮杂环化合物辅助均可以提高其配位能力[4⁃6]。近年来,磺酸基配合物的合成及性质研究已经引起研究者们的广泛关注。金属的多种配位构型以及磺酸基团多样的配位形式相互配合,可以构筑独特的框架结构。在燃料气体存储、荧光标记、二阶非线性光学材料和温室气体吸附等领域具有潜在的应用价值[7⁃9]。研究者们选用单磺酸基配体、双磺酸基配体、含氮杂环磺酸基配体和其他官能团辅助的磺酸基配体合成了多种磺酸基配合物,并研究了他们的性质[10⁃11]。虽然在磺酸基配合物上已经取得了一定的研究进展,但是对合成配合物的结构调控还有待进一步提高。研究者们通常采用两种方式设计及合成结构独特的配合物:一方面,选用多官能团的配体来拓展配合物的拓扑结构,发挥各官能团的空间配位形式多样的优点[12⁃16];另一方面,选择含氮原子的辅助配体来促进金属与磺酸配体的配位作用,构筑单核或多核的低维配合物[17⁃20]。然而,对于选用羟基辅助的磺酸基芳香配体合成配合物的研究比较鲜见。本文以Na2H2L、phen以及Co(NO3)2·6H2O为原料,通过水热法合成单核配合物[Co(H2L)(phen)2(H2O)]·4H2O,并对其结构、组成、热稳定性和荧光性质进行研究。
1 实验部分
1.1 仪器与试剂
利用德国Bruker公司SMART Apex⁃ⅡCCD单晶X射线衍射仪测试样品的结构;利用PerkinElmer公司2400型元素分析仪测试样品的元素组成;利用美国TA公司Q50型热重分析仪测试样品的热稳定性;利用日立公司F⁃4500型荧光光谱仪测试样品的荧光发射性质。Co(NO3)2·6H2O、Na2H2L、phen和乙醇,分析纯,国药集团化学试剂有限公司。
1.2 [Co(H2 L)(phen)2(H2 O)]·4H2 O的合成
将1 mmol(0.291 g)Co(NO3)2·6H2O、1 mmol(0.314 g)Na2H2L和1 mmol(0.198 g)phen溶于20 mL乙醇和水(体积比为1∶1)的混合溶剂中,搅拌24 h。将溶液缓慢转移至反应釜中,在140℃加热72 h后,缓慢降至室温,经过滤、水和乙醇洗涤后用干燥箱烘干,得到红色块状单晶,产率为89%。元素分析,分子式C30H30Co N4O13S2,测量值(理论值):C46.52(46.33),H3.92(3.86),N7.35(7.20),数值均为质量分数。
1.3 晶体结构的测定
在298 K下,将选取的单晶颗粒利用单晶衍射仪测试其空间结构。利用单色化的Mo⁃Kα辐射,φ⁃ω扫描方式,收集晶体衍射数据,数据均经过吸收校正。温度因子均采用全矩阵最小二乘法进行修正。利用SHELTXL程序包进行晶体结构解析及精修[21]。配合物[Co(H2L)(phen)2(H2O)]·4H2O主要晶体学数据、键长和键角分别见表1、2和表3。

表1 配合物[Co(H2 L)(phen)2(H2 O)]·4H2O主要晶体学数据
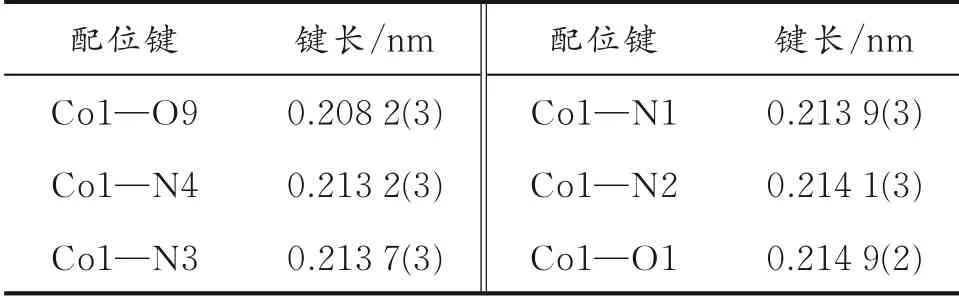
表2 配合物[Co(H2 L)(phen)2(H2 O)]·4H2O主要键长

表3 配合物[Co(H2 L)(phen)2(H2 O)]·4H2O主要键角
2 结果与讨论
2.1 晶体结构
配合物的分子结构如图1所示。

图1 配合物[Co(H2 L)(phen)2(H2O)]·4H2 O的分子结构
该配合物为单核,中心离子Co2+为六配位,呈扭曲的八面体配位构型。八面体的顶点分别被2个phen分子的4个氮原子(N1、N2、N3、N4)、水分子的氧原子(O9)和磺酸基氧原子(O1)占据,如图2所示。在H2L2-中,2个邻位的酚羟基没有与金属配位,且氢离子没有解离,不带电荷;苯环上2个磺酸基显-2价,所以H2L2-配体显-2价。

图2 钴离子的八面体配位构型
Co2+带2个正电荷,因此在不对称结构单元中化合价为0。N2和O9处于八面体轴向位置,N1、N3、N4和O1处于赤道平面。Co-N以及Co-O之间的距离分别在0.213 2(3)~0.214 1(3)nm和0.208 2(3)~0.214 9(2)nm(见表2)。在不对称结构单元中,phen分子与H2L2-配体的苯环中心之间的距离为0.337 0 nm,存在芳环堆砌作用。
表4为配合物氢键的键长和键角。配位水分子与磺酸基氧原子、自由水分子形成氢键,分别为O9-H9C…O6和O9-H9D…O10;酚羟基氧与磺酸基氧原子形成氢键,分别为O7-H7A…O3、O7-H7A…O1和O8-H8…O5。自由水分子之间以及与磺酸基氧、酚羟基氧原子形成氢键,分别为O10-H10C…O2、O10-H10D…O3、O11-H11C…O5、O11-H11D…O6、O12-H12C…O7A、O12-H12D…O13A、O12-H12D…O14A、O13-H13C…O4、O13-H13D…O10、O14-H14C…O4和O14-H14D…O12。

表4 配合物[Co(H2 L)(phen)2(H2 O)]·4H2 O氢键的键长和键角
2.2 热重分析
图3为配合物[Co(H2L)(phen)2(H2O)]·4H2O的热重曲线。从图3可以看出,在25~205℃有2个连续的失重,失重率为11.78%,相当于失去自由的水分子和配位水分子(理论值为11.57%);在205~566℃出现了1个明显的失重,是phen分子部分分解所致;phen分子还没有完全分解,H2L2-开始分解,当反应温度升高到900℃时,热重曲线还有下降趋势,此时表明配合物尚未完全分解[11,22⁃23]。

图3 配合物[Co(H2 L)(phen)2(H2O)]·4H2O的热重曲线
2.3 荧光光谱
图4为配合物和配体的固态荧光发射光谱。从图4可以看出,配体和配合物的最大荧光发射峰分别位于439 nm和380 nm。配合物的荧光发射峰相比于配体发生蓝移,蓝移了59 nm。配合物中的H2L2-配体具有共轭的苯环结构以及苯环上的取代-OH基,phen配体具有苯环和氮杂环的共轭体系[15]。配合物的荧光发射归因于价电子在H2L2-配体和phen分子的共轭体系的能级间跃迁。配体与Co2+的配位作用是导致配合物荧光发射峰蓝移的主要原因[24]。
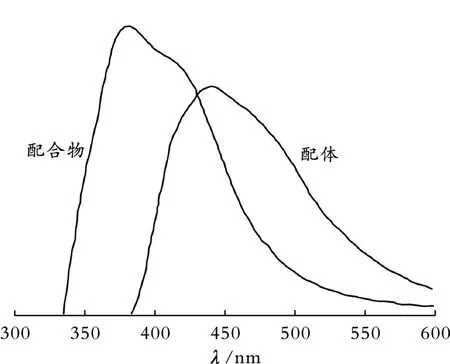
图4 配合物[Co(H2 L)(phen)2(H2 O)]·4H2O和配体的固态荧光发射光谱
3 结 论
利用水热法合成了1个单核的钴配合物[Co(H2L)(phen)2(H2O)]·4H2O。Co2+是六配位的,呈八面体配位构型,其顶点被phen的氮原子以及磺酸基、水分子的氧原子占据。配合物分四个阶段发生热分解。配合物荧光发射峰在380 nm,主要归因于配体的荧光发射,其发射峰发生蓝移是配体与Co2+的配位作用造成的。
