安徽省蚌埠地区某医院妇科病人HPV感染及亚型分布
2021-03-15姚利利
梅 娟,姚利利
宫颈癌是女性最常见的恶性肿瘤之一,我国每年新发宫颈癌13万余例[1]。人乳头状瘤病毒(HPV)感染是导致宫颈上皮内瘤变及宫颈癌发生的重要原因[2]。流行病学研究[3]证实高危型HPV感染的检测是宫颈癌预防的关键。安徽蚌埠地区经济发展相对落后,卫生医疗条件相对匮乏,目前相关HPV感染流行病学调查的报道较少。本研究通过分析我院妇科4 773例就诊病人HPV检测结果,旨在积累本地区妇科病人HPV感染的流行病学资料,以供预防和临床工作参考。
1 资料与方法
1.1 研究对象 收集2016-2017年在我院妇科进行HPV分型检测的4 773例病人作为研究对象,年龄16~68岁。所有标本采集和检测过程均经病人本人同意。
1.2 仪器与试剂 核酸提取液试剂盒、HPV分型检测PCR试剂盒及HPV分型检测杂交试剂盒均购自亚能生物技术(深圳)有限公司;PCR扩增仪器(杭州博日科技有限公司);自动杂交仪器(亚能生物技术深圳有限公司)。
1.3 方法
1.3.1 样本采集 由专业妇科医生用扩阴器暴露宫颈口,用无菌棉拭子擦拭宫颈口可见的分泌物,将宫颈刷置于宫颈口,轻柔旋转宫颈刷使其顺时针旋转4~5圈,然后将宫颈刷放入加有专用细胞保存液的取样管中保存。样本采集后立即送检病理科。4 ℃保存,3 d内检测。
1.3.2 DNA分离提取与PCR扩增 取保存有宫颈细胞的细胞保存液1.0 mL,以14 000 r/min离心5 min,弃去上清液,采用核酸提取试剂盒提取DNA。取5 μL DNA提取液,加入PCR扩增体系,扩增条件:95 ℃预变性10 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,40个循环;72 ℃延伸3 min。
1.3.2 PCR产物杂交 按照试剂说明书及仪器操作指南进行操作。加入25 μL PCR扩增产物预热至45 ℃的杂交液,开启自动杂交程序。杂交结束后用镊子取出杂交膜放在吸水纸上,1 h内分析结果。
1.4 结果判定 检测结果阳性点为清晰可见的蓝色圆点;根据膜条HPV分型分布图,判断阳性点为HPV哪种类型;Biotin对照点,反映酶与显色底物反应,在检测中应为阳性。内对照点(IC)为质控模板DNA 探针,若扩增反应体系中没有抑制因素,IC点出现;以上两对照点为阳性,其他点为阴性,应判定该样本检测结果为阴性,如果有一个HPV分型点为阳性,表示该样本为单重HPV感染,一个以上分型点为阳性表示多重HPV感染。
1.5 统计学方法 采用χ2检验。
2 结果
2.1 总体感染情况 在接受HPV检测的4 773名妇科病人中,一共检出1 069例HPV阳性病例,阳性率为22.40%;其中高危感染(h-HPV)率为19.76%(943/1 069),低危感染(l-HPV)率为1.84%(88/1 069),混合感染(h+lHPV)率为0.80%(38/1 069),分别占HPV感染的88.21%、8.23%和3.55%。
2.2 不同年龄段病人HPV感染状况 ≥55岁年龄组感染率为31.96%,高于其他4个年龄组感染率(P<0.01);其他4个年龄组感染率之间差异无统计学意义(P>0.05)(见表1)。

表1 各年龄段病人HPV感染情况(n)
2.3 HPV单一及多重感染情况 在检测的4 773例样本中既有单一型HPV感染,也有两种及以上基因型的混合感染。样本的阳性例数为1 069例,其中单一感染阳性数为868例,阳性率为81.20%;多重感染阳性数为201例,阳性率为4.21%。在多重感染中以二重感染最为常见,占多重感染的78.61%(158/201),三重及以上感染少见(见表2)。
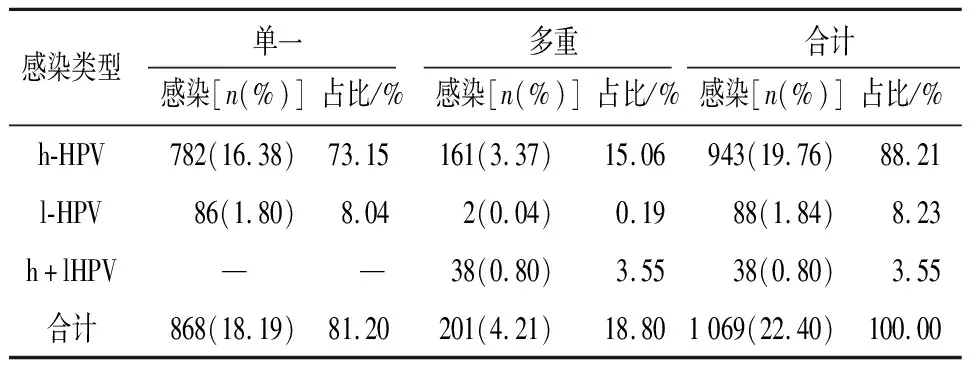
表2 HPV单一和多重感染情况
2.4 HPV感染亚型分布 23种基因亚型在检测中均出现,高危HPV亚型感染以HPV16亚型为最高,其次是HPV52、HPV58,低危HPV亚型感染以HPV6亚型为最高,其次为HPV11、HPV42。1069例阳性标本由于有多重感染的标本共检出1 320例HPV亚型,其中高危型1 192例,低危型128例,占受检人数比例分别为24.97%、2.68%,占总检出亚型的比例分别为90.30%、9.70%(见表3)。

表3 HPV感染的检出情况
3 讨论
近年来研究[4]发现,我国宫颈癌的发病率明显升高,严重影响妇女的心身健康。HPV感染类型不同,其致病风险差别亦较大。有研究[5]证实HPV基因分型结果可以预测患高级别鳞状上皮内瘤变及以上病变的风险,有助于宫颈病变病人的分层管理,具有较高的临床应用价值。所以,对HPV的检测及分型有着重要意义。不同地域HPV感染阳性率和型别存在差异[6]。关于安徽省蚌埠地区妇女HPV感染情况的研究报道极少,因此有必要对该地区妇科病人HPV感染情况及亚型分布特点进行研究,以期对该地区宫颈癌的防治进行指导。
本研究对安徽蚌埠地区4 773例受检妇科病人进行HPV检查,共检出HPV阳性样本1 069例,阳性率为22.40%。高危感染(h-HPV)率为19.76%。与许晓红等[7]报道的安徽合肥地区高危型HPV感染率为18.62%的结果相似,与金夏等[8]报道的安徽合肥地区HPV感染率为12.43%相比偏高,与田斌等[9]报道的安徽铜陵地区宫颈炎女性HPV检出率为35.3%相比偏低,这些差异存在可能与报道时间不同或者与地区差异有关,需进一步调查研究分析。与国内相关报道比较,丁雪晴等[10]报道的泰州地区阳性率为25.57%,本研究结果与之相近。与靳大川等[11-12]报道相比,本研究结果HPV感染率偏高,这与他们的研究对象是普通人群,而本研究是妇科病人,可能本身存在宫颈病变有关,所以感染率偏高,这也证实了宫颈病变与HPV感染存在关系。
本研究结果显示,HPV感染率在各年龄组间存在差异,≥55岁年龄组感染率为31.96%,高于其他4个年龄组感染率(P<0.01);其他4个年龄组感染率之间差异无统计学意义(P>0.05)。本研究类似于先前的报道[10-11],但也与其他地区HPV感染相关文献[8-9,12-14]报道明显不同。这充分说明HPV感染具有明显地域差异性。本研究结果中≥55岁年龄组感染率明显较高的原因可能为绝经期妇女卵巢功能下降造成激素水平不稳,衰老导致免疫功能下降以及老年人就诊意识差等因素提高了HPV的感染率。因此,本研究结果提示安徽蚌埠地区应该更多地关注年龄≥55岁女性妇科病人的HPV基因分型和宫颈癌的筛查。
HPV感染分高危型和低危型感染。HPV基因型的分布在不同地域显示出多样性,这种多样性特点对未来针对特定地区人群设计有效预防HPV疫苗至关重要。西方国家HPV16和HPV18是两个主要的基因型,与70%的宫颈癌发生相关[15]。本研究中1 069例HPV感染病例共检测出17种高危HPV基因型,其中排名前五位基因型为HPV16、HPV52、HPV58、HPV33、HPV56型。这与李军等[12]报道的高危HPV基因型排列顺序前三位一致,这与其他报道[11,14]存在一定的差异,但排列前三位的基因型是一样的,此差异的存在尚需进一步的研究。
HPV感染分为单重感染和多重感染。HPV多重感染可能对宫颈癌的发生、发展具有协同作用[16-17]。有研究[18]表明,HPV多重感染引起的宫颈癌比单重感染在治疗中更具有耐药性,治疗失败率是单重感染的5倍。本研究4 773例样本中,单重感染868例,占81.20%;多重感染201例,占18.80%,与研究[12]报道相近。多重感染中主要为二重感染,占多重感染的78.61%(158/201),这与相关报道[11-12]一致。本研究存在一定局限性,研究中使用的HPV试剂盒只能检测出已知HPV基因型中的23种类型,导致检测出的多重感染的例数可能比实际要低。
总之,我院妇科病人HPV感染检测共发现15个高危基因型,以单一高危感染为多见,HPV16、HPV52、HPV58、HPV33、HPV56为排列前五位的基因型;各年龄段中以≥55岁年龄组HPV感染率最高,因此,该地区需更加关注此年龄段妇科病人的HPV基因分型和宫颈癌的筛查。
