浓缩配制BPW增菌液对沙门氏菌检测效果的影响
2021-03-14梁煜拓韩佳悯何嘉明马健聪
梁煜拓,韩佳悯,何嘉明,马健聪
(佛山市食品药品检验检测中心,广东佛山 528000)
沙门氏菌引起的中毒病例在世界各地的食物中毒病例中所占数量比例非常高[1-2]。资料统计显示,我国70%~80%细菌性食物中毒事件是由沙门氏菌引起[3]。根据国家标准《预包装食品中致病菌限量》 (GB 29921—2021),要求对易受沙门氏菌污染的食品进行分类管理,以使大多数食品不含沙门氏菌,从而有效地预防沙门氏菌食物中毒事件[4]。为此,各实验室非常重视沙门氏菌的检测工作,目前检测方法有传统分离鉴定法、免疫抗体法(Enzyme-Linked Immunosorbnent Assay ,ELISA)、分子生物学法(Polymerase Chain Reaction,PCR)等。
由于食品在生产加工过程中,经过蒸煮、烘烤、腌制、冷冻和防腐等因素的作用,其中的沙门氏菌会受到非致命性损伤,在含量低且分布不均的情况下,很难直接从食品中检测出来,极易出现假阴性漏检情况。为防止带有致病菌食品的漏检,人们建立了一种简单的微生物增殖步骤,修复损伤菌并提高菌的数量后,再进行检测就能有效地提高检出率,因此不管是烦琐的传统分离法,还是快捷的免疫法、灵敏的PCR法中都缺少不了前增菌步骤。在《食品安全国家标准 食品微生物学检验 沙门氏菌检验》 (GB 4789.4—2016)中要求使用传统分离法进行沙门氏菌检验:取25 g/mL样品置于225 mL BPW中(36±1)℃培养8~18 h进行非选择性前增菌后再经二次选择性增菌,最后进行分离检测[5]。因此,需要提前配制大量BPW增菌液并每份分装225 mL,经121 ℃,15 min灭菌处理后备用,如先大量配制经灭菌后再分装会导致因容量过大而造成灭菌不彻底,直接购买成品分装好的增菌液则会增加成本,且量多时也不便放置冰箱冷藏保存。随着我国与其他国家之间的国际贸易的不断深入,我国的沙门氏菌限量标准也与国际标准进行了接轨。钟立霞等通过对主要国际组织和贸易国家食品检验标准中沙门氏菌限量的比较,发现除美国外,其他国家和组织关于沙门氏菌限量标准均要求不得检出,但采样量却各不相同,各个国家普遍的采样件数n都大于或等于5,有的国家甚至达60[6]。我国国家标准也将以往要求的采样件数n=1修改为n=5,在检测程序不变的情况下,工作量相当于直接增至原来的5倍。另外,基于大多食品依据产品标准要求检测致病菌沙门氏菌外,还需要检测菌落总数、大肠菌群等卫生指标,然而在菌落总数、大肠菌群(n=5)等项目检测时也需同样取25 g/mL样品于225 mL灭菌生理盐水稀释液中均质后,仅吸取几毫升样品液进行检测,剩下的样品液便丢弃。此时把浓缩配制的BPW增菌液直接加到剩下的样品液中摇匀,进行沙门氏菌前增菌后再检测,减少了重复取样。在工作量大,且不能有效地提高自动化检测程度时,通过合理地改良配制方法,既避免重复取样工作,又便于增菌液配制、使用和保存,能有效减轻工作量,提高检测效率,实用性意义显著。
本文选择4株沙门氏菌,包括1株标准菌株和3株常见的实验室分离株[7-8],按照GB 4789.4—2016对两种不同配制方式的BPW增菌液进行均匀度、增菌效果、检测灵敏度测试,以及在13类杂菌污染程度较高的预包装食品中人工污染3种常见沙门氏菌分离株,比较其在不同的样品环境和严重杂菌干扰影响下的检测效果差异,评价BPW先浓缩配制后再添加使用的可行性。
1 材料与方法
1.1 试剂与仪器
胰蛋白胨大豆琼 脂(Tryptone soya agar,TSA)、脑心浸萃液态培养基(Brain heart infusion medium,BHI)、缓冲蛋白胨 水(Buffer peptone water,BPW)、四硫磺酸钠煌绿增菌液(Tetrathionate broth base,TTB),北京陆桥技术有限责任公司;沙门显色培养基(科玛嘉)、VIDAS SLM试剂盒,法国生物梅里埃公司;沙门氏菌诊断血清,宁波天润生物药业有限公司。
常规BPW配制:按商品使用说明书把培养基按配方20 g/L比例称取溶解均匀后分装225 mL/瓶,经121 ℃,15 min灭菌后备用,每瓶含培养基成分4.5 g。
浓缩BPW配制:把培养基按45 g/100 mL的配方比例配制100 mL/瓶,121 ℃,15 min灭菌后备用,每瓶含培养基成分45 g(以下简称浓缩BPW);使用时吸取10 mL浓缩BPW加入215 mL灭菌生理盐水中稀释均匀,得到225 mL增菌液,含培养基成分 4.5 g备用(以下简称SBPW)
mini-Vidas全自动免疫荧光分析仪,梅里埃公司。
1.2 试验菌株
鼠伤寒沙门氏菌标准菌株,CMCC(B)50115,中国医学微生物菌种保藏管理中心;鼠伤寒沙门氏菌分离株、肠炎沙门氏菌分离株、德尔卑沙门氏菌分离株,由佛山市食品药品检验检测中心食品检测中分离。
1.3 检测样品
经佛山市食品药品检验检测中心食品检测后余样,选取13个食品类别中杂菌含量较高的样品代表各1份。具体样品情况如表1所示。

表1 检测样品情况
1.4 方法
1.4.1 配制成分均匀度测试
(1)pH缓冲体系。取225 mL BPW和225mL SBPW分别倒入烧杯中,放置磁力搅拌器上,插入pH计,滴定1 mol/L NaOH,使pH计显示8.0,记录滴定量;再取225 mL BPW和225 mL SBPW分别倒入烧杯中,放置磁力搅拌器上,插入pH计,滴定 1 mol/L HCL,使pH计显示6.0,记录滴定量。平行测试2组,比较两种增菌液对酸碱的缓冲能力。
(2)蛋白质含量。充分混匀BPW和SBPW,分别吸取10 mL至消化管中,再加入0.4 g CuSO4、6 g K2SO4及20 mL H2SO4于消化炉进行消化,取出冷却后加入50 mL水,于自动凯氏定氮仪上自动加液、蒸馏、滴定和记录滴定数据。平行测试4组,比较两种增菌液主要蛋白质成分的配制均匀性差异。
1.4.2 增菌效果比较
将鼠伤寒沙门氏菌标准菌株接种到BHI肉汤培养过夜,进行10倍系列稀释至10-7(菌落计数为 97 CFU/mL),分别吸1 mL加入100 mL BPW增菌液和100 mL SBPW增菌液中,于36 ℃培养箱培养,涡旋仪振荡1 min充分均匀,取0 h 、4 h、6 h、8 h、10 h、12 h、14 h、16 h、18 h、20 h、24 h、36 h和48 h的培养物1 mL于平板中倾注TSA,36 ℃培养18 h,进行菌落计数。
1.4.3 检测灵敏度比较
将鼠伤寒沙门氏菌标准菌株接种到BHI肉汤培养过夜,进行10倍系列稀释至10-10菌液备用,取10-7、10-8、10-9、10-10菌液1 mL分别接种到225 mL BPW增菌液和225 mL SBPW增菌液中,每组稀释度接种3个平行,36 ℃,18 h培养,接种1 mL于TTB增菌液中培养24 h后分离划线于沙门氏菌显色平板上进行培养,通过观察显色平板上的生长情况对检测灵敏度作出评价。
1.4.4 人工污染样品检测比较
(1)菌液制备。将鼠伤寒沙门氏菌分离株、肠炎沙门氏菌分离株、德尔卑沙门氏菌分离株分别接种到BHI肉汤培养过夜,进行10倍梯度稀释至10-8菌液备用,并同时各取1 mL备用菌液倾注TSA平板36 ℃培养,进行菌落计数,得到备用菌液的浓度分别为7 CFU/mL、3 CFU/mL、6 CFU/mL。
(2)样品处理及增菌、快筛。分别取25 g/mL样品于225 mL BPW和215 mL灭菌生理盐水稀释液中,用均质器均质1min,液体样品振荡混匀,往215 mL灭菌生理盐水样品液中加入10mL浓缩BPW混匀,再往样品匀液中分别加入1 mL 鼠伤寒沙门氏菌、肠炎沙门氏菌、德尔卑沙门氏菌10-8备用菌液,具体添加情况如表2所示,另每组设置两个样品空白对照,一并于36 ℃前增菌培养18 h,各取1 mL增菌培养物于10 mL TTB培养基中,42 ℃二次增菌 24 h。同时取2 mL前增菌培养物于空试管中沸水浴5 min,进行mini-Vidas全自动免疫荧光分析仪快速筛选检测。
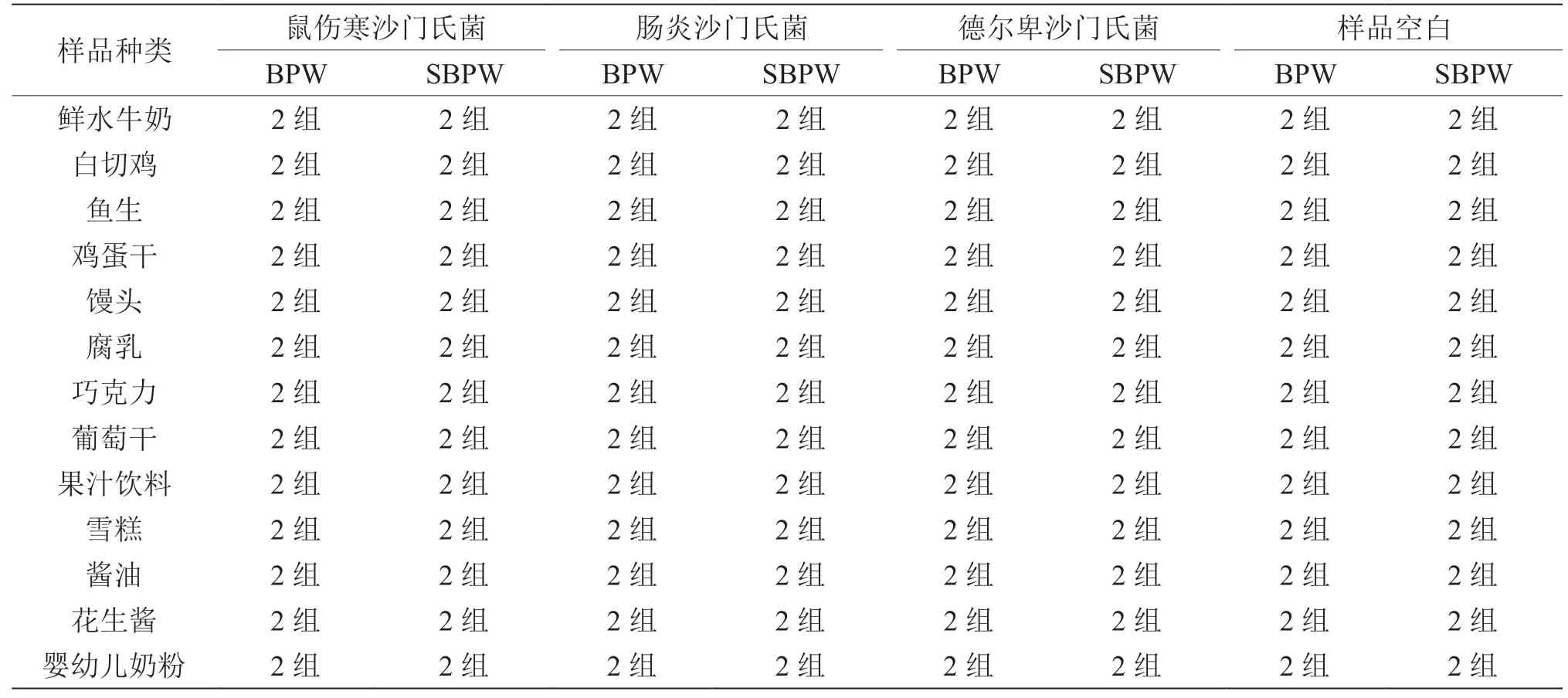
表2 人工污染样品检测实验组设置
(3)分离及鉴定。取二次增菌液分别划线接种于沙门氏菌显色平板中,36 ℃培养18 h,观察平板上是否有紫红色可疑菌落生长,将分离到的可疑沙门氏菌纯化培养后,进行诊断血清凝集实验,凝集A-F多价血清;如有O4、HI、H2凝集,鉴定为鼠伤寒沙门氏菌;O9、O12、Hg、Hm凝集,鉴定为肠炎型沙门氏菌;O4、Hf、Hg、H[1,2]凝集,鉴定为德尔卑沙门氏菌。比较相同增菌液不同配制使用方式对沙门氏菌检测效果的影响。
2 结果与分析
2.1 两种增菌液对酸碱的缓冲能力
由表3可知,两种不同配制方式的增菌液对酸碱的缓冲能力没有显著性差异(P>0.05)。
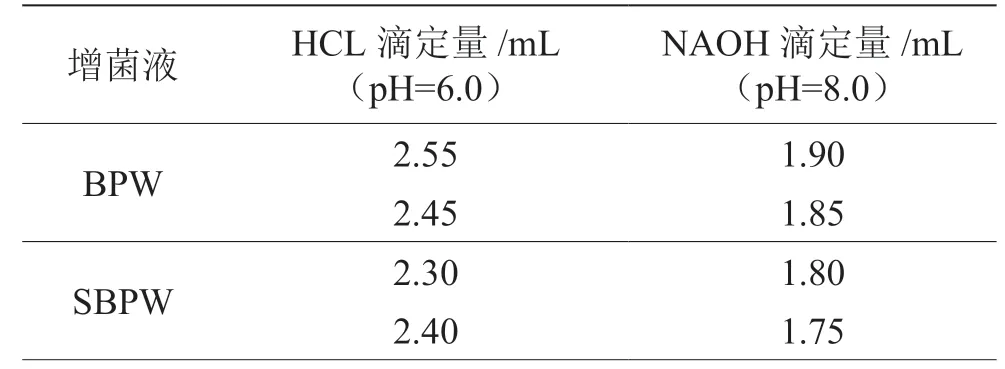
表3 两种增菌液对酸碱的缓冲能力
2.2 两种增菌液蛋白质成分含量
由表4可知,在两种不同配制方式的增菌液中主要营养成分蛋白质含量没有显著性差异 (P>0.05)。

表4 增菌液中蛋白质成分含量(单位:g/100 mL)
2.3 沙门氏菌在两种增菌液中的增菌效果
由图1可知,两种增菌液的生长曲线大致相同。沙门氏菌的数量随时间延长不断上升,0~4 h为调整期,6~16 h为对数增长期,18 h后进入稳定期。对数期细菌的数量增长最快,活力最好,最适宜进行接种培养实验,符合《食品安全国家标准 食品微生物学检验 沙门氏菌检验》(GB 4789.4—2016)中规定的预增菌时间为8~18 h要求。
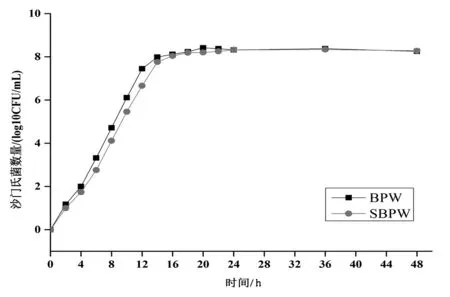
图1 沙门氏菌标准株在两种增菌液中的增菌效果
2.4 检测敏感度结果
由表5可知,两种增菌液对沙门氏菌最低检出限均可达到10-9(1 CFU/225 mL),表明在检测沙门氏菌时,SBPW增菌液的灵敏度与BPW增菌液的灵敏度相当。

表5 两种增菌液对沙门氏菌标准株的最低检出限
2.5 人工污染样品结果
由表6、表7可知,在13个食品类别的样品中分别少量污染3种常见沙门氏菌分离株,在不同样品环境和杂菌干扰下,进行竞争性增菌、选择性分离检测,BPW增菌液和SBPW增菌液都能全部检出目标沙门氏菌,检测效果良好无差异性;但直接取18 h增菌培养物进行mini-Vidas快速筛选检测,出现个别食品假阴性漏检情况。
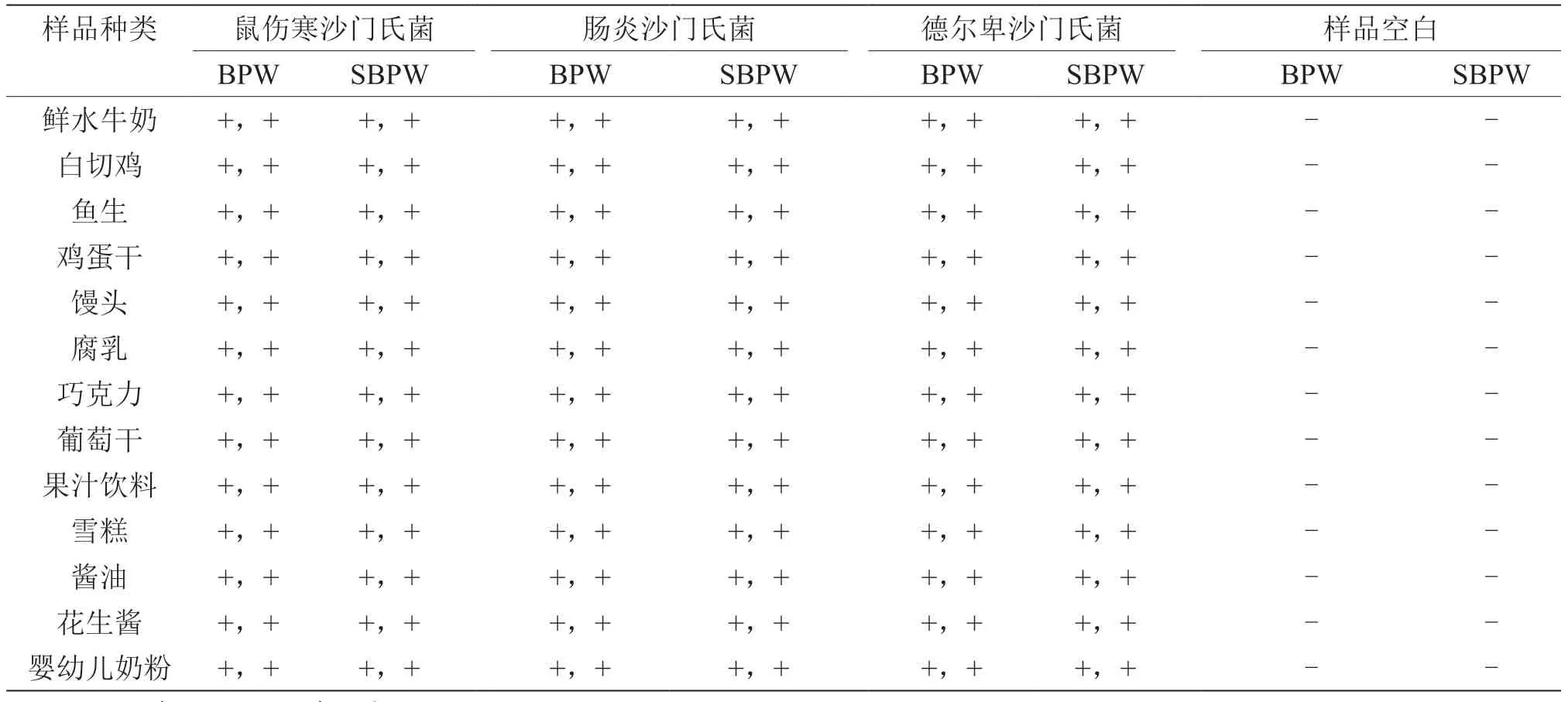
表6 两种增菌液检测沙门氏菌分离株人工污染样品结果比较

表7 mini-Vidas快筛检测假阴性漏检情况
3 结论与讨论
BPW缓冲蛋白胨水配方依据是ISO 6579,用在GB 4789.4—2016、SN 0170—1992、ISO 6579-1:2017等标准中作为沙门氏菌非选择性的预增菌培养基。由于很多食品在加工过程中会对沙门氏菌细胞造成非致命性伤害,然而BPW的作用可以修复那些受损的沙门氏菌细胞,提高沙门氏菌的活力和含量;同时食品中的防腐剂也会对沙门氏菌检测造成不利影响,BPW还具有稀释毒性物质的作用。其成分中蛋白胨为细菌的生长提供氮源和碳源,能提供微生物生长所必需的核酸、蛋白质合成原料,是不可缺少的营养物质。磷酸盐缓冲对可以维持pH稳定性,使多数细菌在合适pH=6.0~8.0的环境下利于生长繁殖。鉴于此培养基成分中蛋白胨和磷酸盐缓冲对的重要性,如在配制过程中分装不均匀导致营养不足,就会影响增菌效果,通过对两种不同配制方式的BPW进行蛋白质含量和酸碱缓冲能力的测试,结果显示无明显的差异性,表明配制的均匀性良好,但SBPW在低温冷藏下长期保存,底部会出现结晶现象,因此在使用前要先拿出放置室温或热水浴后充分摇荡再使用,避免营养成分不均匀,影响增菌效果。通过增菌效果和检测灵敏度比较,得出在两种不同配制方式的BPW中沙门氏菌增菌生长曲线良好,均符合标准规定的预增菌时间在8~ 18 h内达到最佳生长状态要求,且沙门氏菌最低检出限均可达到10-9(1 CFU/225 mL)水平,检测灵敏度较高。通过对多类食品人工污染少量沙门氏菌,在复杂的样品环境条件和严重的杂菌干扰下(最高杂菌与沙门菌比例为105∶1),进行竞争性增菌培养,再选择性分离检测,实验结果表明经过BPW和SBPW预增菌后都能完全检测出目标沙门氏菌,没有出现漏检现象。但在两种预增菌液中直接进行mini-Vidas快速筛选检测,有个别食品出现假阴性情况,此类样品经选择性增菌后筛选检测呈阳性。因此,在时间允许条件下,经选择性增菌后再进行筛选检测,能提高检测效率。综合实验结果得出BPW先浓缩配制后再添加使用的方式可以应用于沙门氏菌日常检测工作中,既方便配制、使用、储存,又减轻了重复取样的工作量,如能生产一次性浓缩BPW管,使用时直接添加使用,更能提高实验室的工作效率。
