基于微波辅助水浴法的双孢蘑菇多糖的提取、 分离及纯化研究
2021-03-14白海娜
白海娜
(吉林化工学院,吉林吉林 132022)
双孢菇也被称为圆蘑菇、白蘑菇或者洋蘑菇,为低温性的菇类,因同时生长出两个孢子而被命名。双孢菇是目前世界范围内栽培规模最大、总产量最大、单位栽培面积产量最高、栽培技术现代化程度最高的食用菌种,也是我国目前栽培最广泛、产量最大的食用菌种。真菌是营养成分较为丰富的物质,一直深受人们的喜爱。真菌多糖能够增强人体的免疫功能、延缓衰老、抗癌、美容,因此受到人们的一致好评,具有较为广阔的市场发展前景。
1 材料与方法
1.1 材料与试剂
材料:市售双孢菇,烘干粉碎,过80目筛,备用。试剂:糖样品、蒸馏水、氯化钠溶液、氢氧化钠溶液、浓硫酸和重蒸酚。
1.2 仪器与设备
FW100型高速粉碎机、TGL-16C型离心机、WD800G型微波炉、HH-4型恒温水浴锅、AR1530/C型电子天平、RE-52AA型旋转蒸发仪、电热恒温鼓风干燥箱、DS型循环水式真空泵、TU-1810DS型紫外可见分光光度计、冷冻干燥机及离子交换柱、变色硅胶干燥器、容量瓶、烧杯、比色管和通风橱等[4]。
1.3 实验方法
1.3.1 单因素实验
(1)多糖提取。双孢菇干粉适量,按照料液比均匀混合,进行微波辅助水浴法处理,微波功率设置为560 W,提取液上离心机以4 000 r/min为条件离心15 min,对上清液多糖含量进行测定[1]。浓缩上清液后加入浓缩液3倍体积的C2H5O(乙醇)溶液,常温条件下析出棕色絮状的粗多糖,上离心机以 4 000 r/min为条件离心15 min,收集沉淀,冷冻干燥后得到粗多糖。
(2)多糖含量测定。取2 g双孢菇多糖,按照上述提取实验操作提取双孢菇多糖提取液,取上清液0.5 mL,分别加入5%的苯酚溶液1 mL、浓硫酸 5 mL,摇匀后置于40 ℃的水浴中,经过30 min的加热和10 min的冷却,测定波长490 nm处的吸光度,采用葡萄糖标准曲线回归方程式来计算提取液中的多糖含量[2]。计算公式为:

式中:m1为多糖的质量,g;m2为双孢菇的干粉质量,g。
(3)单因素实验设计。取双孢菇样品,磨成粉末并按照不同配比(1∶10、1∶20、1∶30、1∶40)(1∶50和1∶60)制成料液,进行单因素实验。本次实验共测定不同料液比、微波时间、提取时间对双孢菇多糖得率的影响。
1.3.2 双孢菇多糖分离纯化
(1)DEAE Sephadex A-25分 离 纯 化。DEAE Sephadex A-25经预处理后装柱,取适量多糖样品放入容器,并加入蒸馏水,配成4 mg/mL多糖溶液,取3 mL上柱。收集洗脱液共160管,每管5 mL,其中蒸馏水40管、氯化钠溶液(0.1 mol/L)40管、氯化钠溶液(0.3 mol/L)40管、氢氧化钠溶液(0.1 mol/L)40管。并利用苯酚-硫酸法测定多糖吸光值[5]。
(2)多糖纯度测定。①紫外光谱扫描。取适量多糖样品制成水溶液,并在200~400 nm下进行扫描。②多糖纯度鉴定。将洗脱后的多糖溶液稀释成2 mg/mL溶液,取2 mL上Sephadex G-200柱,以氯化钠溶液(0.1 mol/L)为流动相,流速每分钟 0.5 mL,对多糖纯度进行检测。
2 结果分析
2.1 单因素分析
2.1.1 微波时间对双孢菇多糖得率的影响
取相同配比料液6份,以相同功率进行超声处理,时间分为为10 s、20 s、30 s、40 s、50 s和60 s,并在相同温度下提取相同时间后,经离心处理后提取6份上清液,测定多糖得率结果如图1所示。由图1可知,多糖得率随着微波时间的增加而先升后降。微波时间处于40 s时能够获得最多的多糖,随着时间的增加,双孢菇的细胞会加剧破碎,释放更多的多糖。
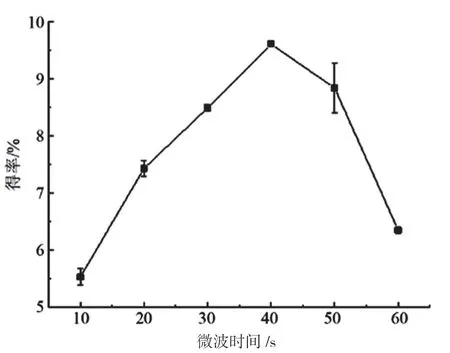
图1 微波时间对多糖得率的影响
2.1.2 料液比对双孢菇多糖得率的影响
取不同配比料液共6份,料液比(g/mL)分别为1∶10、1∶20、1∶30、1∶40、1∶50和1∶60。所有料液以相同功率进行相同时间的超声处理,并在相同温度下提取相同时间后,经离心处理后提取6份上清液,测定多糖得率结果如图2所示。由图2可知,多糖得率随着溶剂的用量增多而出现先上升后下降趋势。料液比在1∶40(g/mL)时能够获得最多的多糖。料液比过大会导致体系的流动性降低,无法进行多糖提取。料液比过小会降低体系的反应速率[3]。因此最佳料液比是1∶40(g/mL)。

图2 料液比对多糖得率的影响
2.1.3 提取时间对双孢菇多糖得率的影响
取相同配比料液6份,以相同功率进行相同时间的超声处理,并在同一提取温度下分别提取1.5 h、2 h、2.5 h、3 h、3.5 h和4 h后,经离心处理后提取6份上清液,测定多糖得率结果如图3所示。由图3可知,多糖得率随着提取时间的增加而先增后减。提取时间在3 h时能够获得的多糖最多。

图3 提取时间对多糖得率的影响
2.2 双孢菇多糖的分离纯化
2.2.1 DEAE-Sephadex A-25柱层析纯化
通过DEAE-Sephadex A-25对双孢菇多糖溶液样品进行分离纯化,并利用自动收集器分部收集,采用苯酚-硫酸法对所有样品进行逐一检测,洗脱结果如图4所示。

图4 双孢菇多糖DEAEDEAE-SephadexA-25柱层析洗脱曲线
由图4可知,利用蒸馏水、氯化钠溶液 (0.1 mol/L)、氯化钠溶液(0.3 mol/L)和氢氧化钠溶液(0.1 mol/L)洗脱过程中,均存在吸收峰值,且相较于氢氧化钠溶液(0.1 mol/L)、氯化钠溶液 (0.3 mol/L),蒸馏水、氯化钠溶液(0.1 mol/L)洗脱物质量更大。因此,本研究以这两组样品为主要研究对象,将这两个洗脱组分分别收集,并进行醇沉处理,最后通过离心沉淀及冷冻干燥处理,得到两种产物:①A-25-1为淡黄色粉末;②A-25-2为浅褐色粉末。
2.2.2 双孢菇菇柄多糖纯度鉴定
取A-25-1、A-25-2样品各10 mg,分别融于含10 mL蒸馏水的容器中,并将其置于紫外-可见分光光度计下进行扫描,结果如图5所示。

图5 A-25-1、A-25-2紫外可见光扫描结果
由图5可知,在260 nm、280 nm处,A-25-1、A-25-2紫外扫描均为发现峰值,这表明双孢菇多糖经分离纯化后已没有蛋白质、核酸等杂质。
3 结论
(1)本次研究以微波辅助水浴法进行双孢菇多糖提取实验,并通过单因素实验测定了料液比、微波时间、提取时间对双孢菇多糖提取的影响,结果表明双孢菇多糖最佳提取时间为3 h,最佳料液比为1∶40,最佳微波时间为40 s。
(2)双孢菇多糖经DEAE-SephadexA-25柱层析纯化后,蒸馏水、氯化钠溶液(0.1 mol/L)洗脱物质量更大,且利用紫外光扫描后发现并无蛋白质、核酸等杂质。
