多孔MnO@C立方体的制备及电化学性能研究
2021-03-14魏义永訾振发庞良伟马小航
魏义永,傅 强,訾振发,庞良伟,马小航
(1.合肥师范学院物理与材料工程学院,安徽合肥230601;2.中国科学技术大学化学与材料科学学院,安徽合肥230026)
发展绿色能源对实现人类可持续发展具有重要意义。考虑到便携式电动装置、电动汽车、混合动力汽车、插电式混合动力汽车和电网储能系统的需求不断增加,可充电锂离子电池(LIBs)凭借其安全性好、功率和能量密度大、循环寿命长、环境友好和无记忆效应等优势而备受关注[1-3]。纯石墨负极因其理论比容量(372 mAh·g-1)相对较低而受到限制[4],所以,该领域的研究人员迫切希望构建具有高容量的先进负极材料以改善电化学性能。纳米结构过渡金属氧化物(TMOs)因其理论容量大、原料丰富、安全性高等优点而备受关注[5-8]。氧化亚锰(MnO)具有较高的理论容量(756 mAh·g-1)、弱电压滞后(<0.7 V)、低环境影响和相对较低的成本的优点,被认为是下一代LIBs最有前途的负极材料之一[9-10]。然而,MnO在锂化/去锂化过程中,其固有的电导率较小和体积变化较大,因此其循环稳定性差,倍率特性也不令人满意[9-11]。到目前为止,有两种策略显示出潜力:一是掺入高导电性材料,例如多孔碳或石墨烯等,增强电导率并改善MnO表面介导的电化学反应动力学[12-13];二是将MnO粒径减小至纳米级,如纳米片和纳米线等[14-15]。这些方法促进了MnO成为LIBs负极材料的发展,但仍有必要开发有效的碳涂层方法来制备MnO@C纳米复合材料,以期获得高性能LIBs的负极材料。
本文研究在均匀分散的葡萄糖颗粒存在下,通过简单的水热法,合成原位包覆碳的前驱物,然后退火制备出介孔MnO@C中空微米立方体复合材料。结果发现适量葡萄糖原位包覆碳有利于离子和电子的传输,微纳结构能够适应充放电过程中的体积变化,从而明显提高该材料的电化学储能特性。
1 实验
1.1 MnO@C的制备过程
葡萄糖原位包覆MnO样品是通过水热法制备前驱物、再退火处理而成。先将6 mmol MnCl2·4H2O、9 mmol尿素和0.1 g葡萄糖溶于45 mL去离子水中,搅拌50 min后获得透明溶液。再将溶液转移到衬有聚四氟乙烯内胆的不锈钢高压釜中,密封。高压釜在烘箱中加热至200℃并保温20 h。将产物依次用去离子水和无水乙醇在8 000转/分下离心后,分别洗涤三次,以除去水热反应后残留的杂质。收集的前驱物粉末(MnO@C前驱物)在75℃下干燥15 h。为了比较,在相同水热条件下合成了无葡萄糖MnO前驱物。将两个前驱物在N2/H2(5 vol%H2)气氛中以3℃每分钟的升温速率至500°C烧结6 h,分别标记为对应的MnO和MnO@C的样品。
1.2 MnO@C的物性表征
通过粉末X射线衍射仪(XRD,Philips X’pert PRO)来表征材料的晶体结构信息,测试角度范围是10°≤2θ≤80°。用场发射扫描电子显微镜(FE-SEM,SU8020,HITACHI)检测样品的形貌。在40℃~700℃温度范围内,在N2气氛中以5℃每分钟的速率进行热重分析(TGA,Shimadzu DTG-60H)。利用透射电子显微镜(TEM,JEM-2010 JEOL)和高分辨率透射电子显微镜(HRTEM)研究材料的微观结构、晶格条纹信息、局域电子衍射(SAED)图像,用能量色散谱仪(EDS)进行能谱分析,观察元素分布。利用Oishop 100CX系列比表面积分析仪在77 K下用氮吸附/解吸等温线测量比表面积,利用Barret-Joyner-Halenda(BJH)方法获得材料孔径分布图。
1.3 MnO@C的电化学测试
MnO和MnO@C样品的电极片制作过程中所用样品粉末(活性物质)占比70 wt%,Super P炭黑(导电剂)占比20 wt%,羧甲基纤维素钠(CMC粘结剂)占比10 wt%。在超纯水中充分混合搅拌成浆料,紧接着将浆料均匀地涂敷在铜箔集流体上,并在110℃真空干燥箱中干燥18 h。然后用辊压机辊压后,再用冲片机将辊压后的膜冲压成直径为12 mm的电极片,该极片活性物质负载质量约1.25 mg·cm-2。在充满氩气的手套箱(MBraun Labmaster 130)中、水和氧气的含量小于0.1 ppm条件下组装纽扣电池,使用生产的电极、多孔隔膜(Celgard 3501)和锂箔对电极。电解液由1.0 m LiPF6溶液在碳酸二甲酯和碳酸乙烯酯(V/V,1∶1)中组成。在多通道LAND电池循环测试系统上进行(0.01~3.0)V的恒流放电/充电循环。
2 结果与讨论
2.1 MnO@C的结构和形貌
图1为MnO和MnO@C的前驱物及其退火后MnO和MnO@C复合材料的室温X射线衍射图谱。从图1中曲线(a)(b)可以看出,在2θ为24.3°、31.4°、37.6°、41.5°、45.3°、49.8°、51.8°、60.4°、64.0°时均出现了明显的衍射峰。这些峰分别对应着MnCO3的(012)、(104)、(110)、(113)、(202)、(024)、(116)、(122)、(214)晶面,与MnCO3的标准XRD图谱(JCPDS卡:44-1472)完全一致,表明MnO和MnO@C的前驱物MnCO3为纯相的R-3c空间群菱方结构。如图1中曲线(c)(d)所示,MnO和MnO@C复合材料一系列尖锐而强烈的峰集中在35.0°、40.6°、58.8°、70.2°和73.9°处,对应于密勒指数(111)、(200)、(220)、(311)和(222)衍射平面,这些明显的衍射峰和编号07-0230的PDF卡的衍射峰全部吻合,表明制备了具有Fm-3m空间群的立方体纯相MnO,而且即使存在碳,两个样品的结晶度也很高。MnO@C复合材料中没有检测到碳相,可能是因为C的主反射峰与MnO的反射峰重叠。

图1 样品的XRD图谱。
图2所示为MnO和MnO@C前驱物在N2下的热重(TGA)曲线。两个样品的前驱物在40℃~473℃范围内质量损失约1.5%,这与吸收的水被除去相关。在473℃~516℃范围内,MnO和MnO@C前驱物分别对应质量损失大约为31.2%和32.6%,主要归因于MnCO3转变成MnO和CO2,还有少量葡萄糖分子经过碳化并进一步氧化成CO2,反应方程式[16]为:MnCO3→MnO+CO2↑,C+O2→CO2↑。
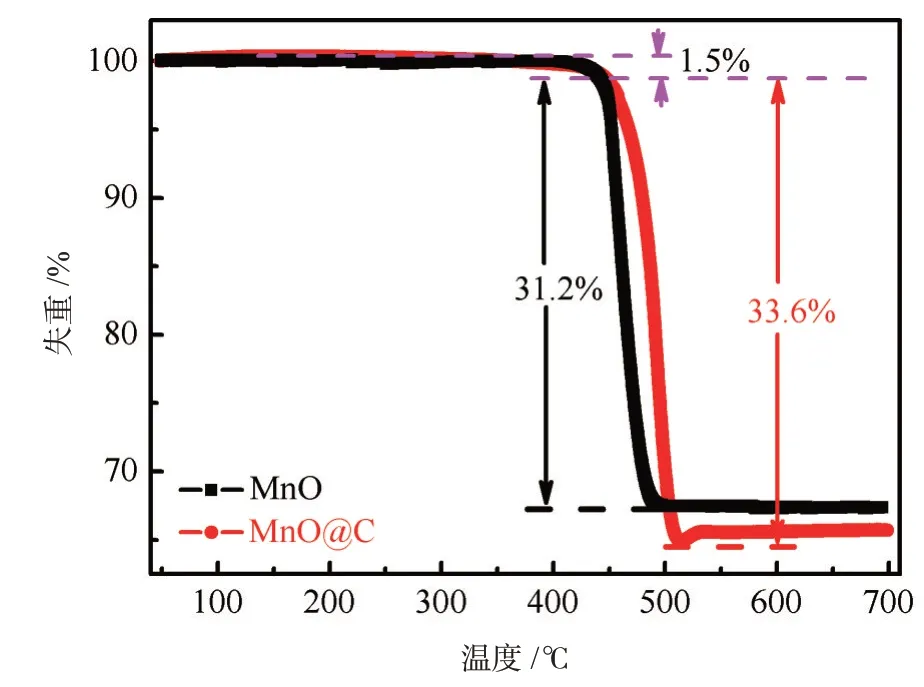
图2 MnO和MnO@C的前驱物热重曲线
为了确定样品MnO和MnO@C的三维结构及其表面形貌,利用扫描电子显微镜(SEM)对该样品进行显微结构分析。图3为纯MnO和MnO@C复合材料的SEM图,从中可见,已经形成了多孔立方体结构,平均边长约6μm(图3(a)),在高放大倍数图像(图3(b))中发现,MnO立方体是由许多纳米颗粒相互连接而成,颗粒大小约28 nm且颗粒间存在明显的介孔,这可能有利于电化学过程中电解液的渗透。因此,这种微纳结构被认为有利于提高MnO的电化学性能。加入葡萄糖(图3(c)(d))后,MnO@C复合物的形貌与纯MnO相似,只是立方体稍大,边长约为8μm,但是小颗粒变得更小了,大约为20 nm,同时介孔中空洞也变小了。葡萄糖分布在小颗粒表面,这可以抑制粒子的生长,提高电极的导电性。

图3 不同放大倍率下样品的SEM图。
图4为样品的TEM、HRTEM、SAED和EDS图像。图4(a)显示了MnO@C材料的内部同样存在大量的介孔中空立方结构,与SEM结果基本吻合。然后通过高分辨透射电子显微镜(HRTEM)分析相应的选区电子衍射(SAED)图,研究立方体的晶体结构和生长方向。如图4(b)所示,MnO@C样品晶格条纹间距为0.26 nm,这可以被指定为(111)面间的距离。因此,介孔立方体的晶体沿(111)方向生长。图4(c)显示SAED图谱是由很多衍射斑点组成的衍射圆环花样,这表明MnO@C样品是多晶的。为了进一步理解MnO@C样品的组成,利用能量色散谱仪(EDS)进行能谱分析,如图4(d)所示,元素Mn、O和C分布均匀,因此,获得了介孔MnO@C中空微观形貌结构。这些形貌结构与正常的纳米颗粒相比,具有较高的振实密度,也有利于锂离子传输。

图4 MnO@C复合材料的
为了进一步探究MnO和MnO@C样品的比表面积和孔径分布,利用BET分析了该材料的微观结构。图5(a)所示为MnO和MnO@C样品的N2吸附/解吸等温线,可以看出这两个样品都表现出典型的IV型,具有H3型磁滞回线,这是介孔尺度孔隙结构特征[17-18]。由吸附/解吸等温线可得,MnO@C的比表面积(17.738 m2·g-1)明显大于MnO的比表面积(11.231 m2·g-1)。这既有利于电解液的浸润,又改善了接触面积。图5(b)为孔径分布曲线,经计算,MnO@C的孔体积(0.162 cm3·g-1)明显大于MnO对应的孔体积(0.119 cm3·g-1)。根据BJH理论,MnO和MnO@C样品的孔径分布图说明两个样品平均孔径都集中在21.1 nm处,证实样品存在介孔结构。可见,MnO@C的BET值和孔体积都大于MnO的对应值。介孔结构的形成主要是由于水热原位包覆葡萄糖的前驱物在退火过程中释放出大量的CO2气体所致。此外,疏松的介孔结构更有利于锂离子的插入和脱出,有效提高了锂离子的存储性能。

图5 MnO和MnO@C样品的(a)N2吸附/解吸等温线和(b)孔径分布曲线
2.2 MnO@C的电化学特性
MnO和MnO@C复合材料放/充电电压分布曲线如图6所示。这两个样品的初始放电比容量分别为1 057.1 mAh·g-1和1 207 mAh·g-1,首次库伦效率分别为74.0%和78.2%。较低的库伦效率主要归因于首次放电过程中的不可逆相变和SEI膜的形成。从前两次循环可以看出,MnO@C电极表现出典型的MnO电极放/充电特性,相对于Li+/Li,MnO电极的电位相对较低。在首次放电过程中,在约0.3 V的长放电平台对应于Mn2+还原成Mn0。而在首次充电过程中,在约1.2 V的充电平台对应于Mn0氧化成Mn2+。在电化学循环过程中,转化反应方程式如下:
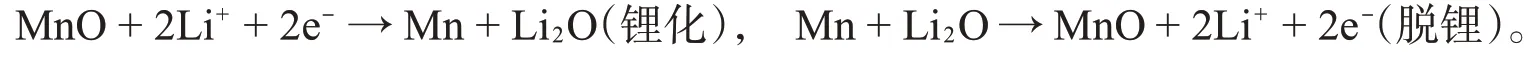
在随后的脱锂化过程中,第1次锂化形成的Mn不能完全氧化回MnO。第2次放电中,长放电电压平台增加到约0.55 V,而在第2次充电中,电压平台轻微增大,这表明电化学极化增大,在第200次放电中,放电电压平台下降,表明MnO纳米晶的形成,电化学极化降低。然而在第200次充电中,充电电压平台略增大,值得注意的是随着循环次数增加,充放电电压平台长度变短了。相比之下,在200次循环之后,MnO@C电极化强度比MnO小。
为了进一步探究MnO@C复合电极和纯MnO电极的循环稳定性和倍率性能,在1 C电流密度下进行了200次循环测试,结果如图7(a)所示。可见所有电极均显示出开始几次比容量下降,这可能是因为在最初的3个循环中电极的活化造成的。随后在1 C的电流密度下比容量均呈现出波包状的循环特性,这可能是由于电化学过程中高氧化态锰氧化物的形成以及颗粒的逐渐细化而提高了转化反应可逆性所致,高价态Mn氧化物在电荷转移中可能会导致更高的比容量,此过程伴随着颗粒的逐渐细化,比表面积增大以及颗粒表面形成更多的电解质界面膜,导致容量出现先降后逐渐上升,最后趋于稳定的趋势[12,19-20]。经过120次循环后,发现容量有明显的增加趋势,这是MnO@C负极的一个典型现象。在第200次循环时放电比容量为883.7 mAh·g-1,相对于二次放电比容量保持率达95.1%。MnO材料负极在初始衰落之后容量变得稳定,但是,经过100次循环后,可以发现放电比容量有轻微减小趋势。在第200个循环时仅保持了591.8 mAh·g-1的放电比容量,仅保留其第二次放电比容量的75.9%。MnO@C电极较好的循环性能应该与其复合材料的特殊微观结构密切相关,它不仅提供了良好的电子碳涂层的传导途径,而且纳米粒子缩短了锂离子的传输距离。

图6 (a)MnO@C复合材料和(b)纯MnO在电流密度为1 C时的电极放/充电曲线
进一步研究MnO@C和MnO电池8次循环的倍率性能,如图7(b)所示,在0.1、0.25、0.5、1、2、4和8 C电流密度下,MnO@C可逆放电比容量分别表现为992.6、958.4、867.9、728.4、572.3、442.3和284.9 mAh·g-1,而纯MnO可逆放电比容量分别为905.5、796.8、649.7、536.0、421.6、315.6和165.7 mAh·g-1,这表明MnO@C的倍率性能明显优于纯MnO。良好的电化学性能表明,MnO具有良好的动力学性能和良好的锂离子存储能力。引入葡萄糖原位包覆碳后,MnO的电子电导率得到提高,从而获得了更好的动力学性能。烧结过程中颗粒的生长受到限制,导致锂离子扩散路径变短。

图7 MnO@C复合材料和纯MnO的(a)长循环性能和(b)倍率性能曲线
3 结论
在均匀分散的葡萄糖颗粒存在下,通过水热法合成原位包覆葡萄糖前驱物,随后,在H2/N2(5 vol%H2)气氛中退火制备出多孔MnO@C微米立方体复合材料,该材料由边长很小的纳米微晶组装形成。高导电性的碳分散在MnO纳米颗粒表面,增加了材料的电子导电性,同时降低了结晶度。与无葡萄糖原位包覆相比,所得的MnO@C复合材料表现出明显改善的电化学特性。在电流密度为1 C时,经过200次循环后,可逆放电比容量为883.7 mAh·g-1,容量保持率高达95.1%。即使当电流密度增加到8 C时,其放电比容量也可达236.3 mAh·g-1。循环性能相对稳定和倍率性能提高都归因于葡萄糖原位包覆和介孔中空立方体结构的结合。
