毛竹TIP基因成员鉴定及其响应胁迫的表达分析
2021-03-13朱成磊杨克彬高志民
朱成磊 杨克彬 高志民
(国际竹藤中心竹藤资源基因科学与基因产业化研究所 国家林业和草原局/北京市共建竹藤科学与技术重点实验室 北京 100102)
水通道蛋白(AQPs) 是一类膜蛋白,对调节水和小分子溶质通过生物膜至关重要。尽管第一个植物AQP在1987年从大豆(Glycine max) 中分离得到[1],但第一个被证实具有功能的植物AQPs是1993年在拟南芥(Arabidopsis thaliana)中发现的γ 液泡膜内在水通道蛋白(AtTIP1)[2],之后又在多种植物中分离出不同类型的AQPs,如拟南芥、水稻(Oryza sativa)、玉米(Zea mays)、高粱 (Sorghum bicolor) 和柳枝稷 (Panicum virgatum) 等植物分别有35、39、36、68和38个AQPs[3]。基于系统发育分析和亚细胞定位,将维管植物AQPs分为5个亚家族,每个亚家族又可分为多个亚组。根据10个不同单子叶植物和双子叶植物中共100个TIPs的进化分析,TIPs分为5个不同的亚组 (TIP1、TI2、TIP3、TIP4和TIP5)[4]。TIPs定位于液泡膜上,TIPs调控液泡膜水分出入,实现细胞的迅速膨胀或紧缩,液泡膜对水具有极高的渗透性,其渗透率比质膜高100倍[5]。除转运水分外,TIPs还兼有运输甘油[6]、H2O2[7]、NH3[8]、尿素[9]和硼[10]以及砷[11]吸收等方面的功能。因此,TIPs在响应干旱、盐等非生物胁迫[12]以及冷适应能力[13],维持植物正常生理活动方面均具有重要的调节作用。
AQPs广泛存在于植物中,有的在特定组织发挥作用,许多与生物胁迫和非生物胁迫密切相关,尤其是对干旱、盐分以及富含重金属的土壤的耐受性[14]。基因在植物不同组织中、同一组织的不同发育阶段以及胁迫条件下的表达差异,反映了基因功能方面的差异。拟南芥、水稻和玉米不同发育时期TIPs基因的表达,以及在干旱和盐胁迫条件下的表达变化均证明了这一点[15]。毛竹基因组草图[16]发布后,人们开始了对毛竹AQPs的研究,发现TIP同源基因的5个亚组(TIP1、TIP2、TIP3、TIP4和TIP5) 在不同组织中表达存在一定的差异[17],且干旱、水淹和NaCl处理均能引起部分毛竹TIPs基因表达的显著变化[18],但尚缺乏对毛竹TIPs基因的更全面分析。随着染色体水平毛竹基因组的发布[19],使人们能够对其中TIPs成员的分子特征、系统进化进行深入分析。低温、干旱、光照等多种胁迫处理下的毛竹转录组数据[20-21],便于对其中TIPs基因的表达模式进行系统了解,预测其功能。在此基础上,采用qPCR技术对不同胁迫条件下PeTIPs的表达进行了验证,以期为深入研究TIPs基因的功能提供参考依据。
1 材料与方法
1.1 毛竹TIP基因查找
以水稻和拟南芥的TIP序列为诱饵,通过同源比对的方法在毛竹新版本基因组数据[19]中进行比对分析,对所获得的序列利用在线软件HMMER (https://www.ebi.ac.uk/Tools/hmmer/)和SMART (http://smart.embl-heidelberg.de/) 进行保守结构域分析,保留具有完整TIP保守结构域的序列。最终获得毛竹TIP基因成员,并根据它们与其他近缘物种的亲缘关系进行命名。
1.2 毛竹TIP基因生物信息学分析
利用 ProtParam (http://web.expasy.org/protparam/) 网站对所获得的毛竹TIP蛋白的理化性质进行分析。运用在线软件MEME (http://meme.nbcr.-net/meme/intro.html) 对毛竹TIP蛋白的保守基序进行分析,使用Plant-mPLoc网站(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/) 和TMHMM Server v.2.0软件(http://www.cbs.dtu.dk/services/TMHMM/) 分别预测其亚细胞定位和跨膜结构域。对毛竹TIP基因上游启动子序列(2 000 bp) 中的调控元件,利用在线软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/) 进行预测[22]。
利用TBtools[23]内置的BLASTP程序对毛竹和水稻TIP氨基酸序列进行多向比对,根据文献设定参数[24],鉴定出具有共线性关系的基因,通过TBtools内置的MCScanX程序[25]进行做图。另外,对所有TIP同源基因对之间的同义(Ks) 和非同义(Ka) 核苷酸替换率进行计算。利用MEGA 7.0内置的Clustal W程序,对毛竹、拟南芥、水稻、高粱、玉米和二穗短柄草(Brachypodium distachyon)等植物的TIP氨基酸序列进行多重比对分析,根据文献设置参数构建系统进化树[26-27]。
1.3 非生物胁迫条件下毛竹RNA-seq数据中TIP基因的表达分析
根据文献报道,从NCBI Short Read Archive(https://www.ncbi.nlm.nih.gov/sra/) 下载低温、干旱和强光胁迫处理毛竹的RNA-seq数据[20-21],包括低温或者干旱处理2 h和8 h后叶片及对照的RNA-seq数据 (登录号为SRS1759772),强光[1 200 μmol/ (m2·s) ]处理0.5 h和8.0 h的毛竹幼苗叶片及对照的RNA-seq数据(登录号为SRS942689)。根据基因注释进行比对查找,筛选其中TIP基因的FPKM (fragments per kilobase of exon model per million mapped fragments,每千个碱基的转录每百万映射读取的片段值),并对获得FPKM进行标准化处理,取以2为底的对数 [Log2(FPKM+1)]的值作为基因的表达量,用TBtools软件绘制表达谱热图,分析不同基因的表达情况。
1.4 不同胁迫条件下毛竹TIP基因的定量表达分析
在实验室条件下(温度25 ℃左右,光16 h/暗8 h,相对湿度80%左右) 培养毛竹实生幼苗,选择2个月生长较一致的幼苗,随机分成4组分别进行处理。向A组基质中添加250 mmol/L NaCl溶液至饱和状态,B组基质中添加20% PEG 6 000溶液至饱和状态,C组放入4 ℃的光照培养箱中,D组置于1 200 μmol/ (m2·s) 的强光培养箱中。每个处理至少20株幼苗,每个处理均包含3次重复。分别在处理后0、1、2、4、8 h后分别收集A、B和C组根系样品以及A、B、C和D组的叶片样品,液氮速冻后存于-80 ℃冰箱备用。选用试剂盒(Takara RNA) 提取样品总RNA并反转录成cDNA,存于-20 ℃冰箱用于后续试验。
根据毛竹TIP序列设计特异的定量引物(表1),由北京博迈德基因技术有限公司合成。10.0 μL的qPCR反应体系:2 × SYBRⅡGreen I Master 5.0 μL,模板cDNA 1.0 μL,正/反向引物0.3 μL,ddH2O 3.4 μL。扩增程序:95 ℃预变性5 min;95 ℃变性10 s,61 ℃退火10 s,循环42次。以PeNTB为内参基因[28],定量结果采用2-ΔΔCT法[29]分析,基于TBtools软件取以2为底的对数[Log2(FPKM+1) ]进行归一化后绘制表达量图。

表1 实时荧光定量PCR引物Tab.1 Primer sequences of qPCR
2 结果与分析
2.1 毛竹TIP基因鉴定与蛋白理化性质分析
在毛竹新版本基因组数据中,共鉴定具有编码完整TIP保守结构域的基因19个,根据其他物种中TIP基因的命名规则,将它们分别命名为PeTIP1-1~ PeTIP1-3、PeTIP2-1~ PeTIP2-4、PeTIP3-1~ PeTIP3-2、PeTIP4-1~ PeTIP4-7和PeTIP5-1~PeTIP5-3(表2)。PeTIPs编码蛋白氨基酸序列最短的为238 aa (PeTIP3-2),最长为434 aa (PeTIP5-2),分子量介于25.06~44.03 kDa之间;理论等电点介于5.54~9.88之间,除PeTIP3-2亲水性较低之外,所有PeTIPs均为稳定的亲水性蛋白;大多数PeTIPs有6个跨膜结构。亚细胞定位预测显示所有PeTIPs均定位于液泡膜上,其中PeTIP3-2还被定位在细胞质膜上。
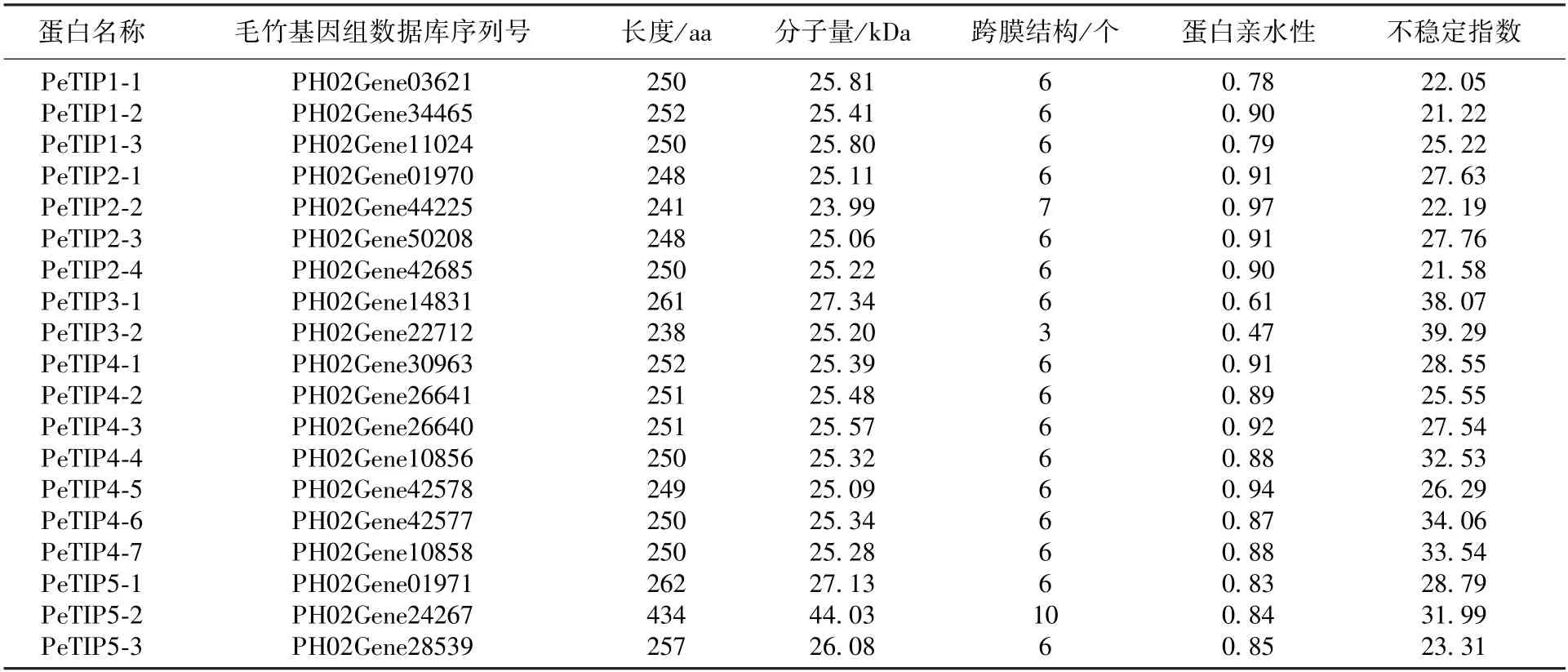
表2 PeTIPs蛋白的理化性质分析Tab.2 Putative basic physical and chemical characteristics analyses of PeTIPs
2.2 PeTIPs氨基酸的保守性分析
氨基酸保守基序分析表明,在PeTIPs序列中共鉴定获得7个保守基序,其中基序1、2、3和6为共有基序;PeTIP3-2缺少基序4;PeTIP5-1和PeTIP5-3缺少基序 5;PeTIP2-2、PeTIP2-3、PeTIP4-6、PeTIP4-7和PeTIP5-3均缺少基序7 (图1A)。每个保守基序中氨基酸序列的偏好性在PeTIPs不同成员间存在着一定的差异,但大多数是比较保守的,尤其是含有跨膜区(TM 1-TM 6) 和Loop-Half螺旋区(Loop B和Loop E) 的基序更为保守(图1B)。同一个亚组大多数成员具有相同的保守基序,说明这些成员可能存在相似的功能。
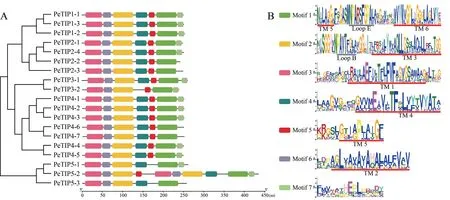
图1 PeTIPs氨基酸保守基序分析Fig.1 Analysis of conserved motifs in PeTIPs
AQPs运输底物具有选择透过性,位于Loop B和Loop E处高度保守的NPA (Asn-Pro-Ala) 结构域对水分亲疏性具有重要作用。对PeTIPs保守位点分析表明,所有序列均含有2个高度保守的NPA结构域,除PeTIP3-2缺少TM 2的Ar/R选择性过滤器之外,其余序列均含有Ar/R选择性过滤器(TM 1-TM 6) 和Froger's残基(表3)。在底物运输时,Ar/R选择性过滤器是一种重要的选择通过结构,PeTIPs 5个亚组的Ar/R选择性过滤器组合形式均不相同,其中PeTIP1s、PeTIP2s和PeTIP5s的分别为H-I-A-V、H-I-G-R和Q-V-A-R,而PeTIP3s和PeTIP4s的Ar/R选择性过滤器则具有多种组合形式,分别为H-M/V-A-R和Q/H-T/I-A-R等形式。氨基酸Froger's残基在底物运输过程同样发挥着重要作用,PeTIPs的Froger's残基保守性相对较高,主要为T/S-S-A-Y-W 2种形式。Ar/R选择性过滤器的多态性和Froger's残基的保守性预示着PeTIPs在毛竹生长发育过程中发挥着不同的功能。
2.3 PeTIPs的系统进化分析
为深入了解PeTIPs的功能,通过对毛竹、水稻、拟南芥、玉米、高粱和二穗短柄草6个物种的71条TIP氨基酸序列进行多重比对,基于MEGA 7.0的邻接法构建了系统进化树。结果表明,所有PeTIPs被聚类到5个分支(I-V),且每个分支中的成员数量不等,其中I和V中均含有3个成员,II、III中分别含有4个和2个成员,IV中成员最多,为7个(图2)。进一步分析发现,超过一半(11/19) 的PeTIPs成员被聚类在分支II和IV中,而水稻和拟南芥在这2个分支的成员分别只有5个和4个,且PeTIP4-2/PeTIP4-3、PeTIP4-4/PeTIP4-5和PeTIP4-6/PeTIP4-7均成对地聚类在1个分支上,这可能与毛竹进化中经历了基因组复制事件有关[16]。另外,在分支V中毛竹有3个成员,而其他物种只含有1个成员,这可能是毛竹进化中经历成员扩张。另外,PeTIPs总是优先与水稻或二穗短柄草TIP成员聚类在一起,说明PeTIPs与水稻等单子叶植物的同源蛋白的功能更相似。
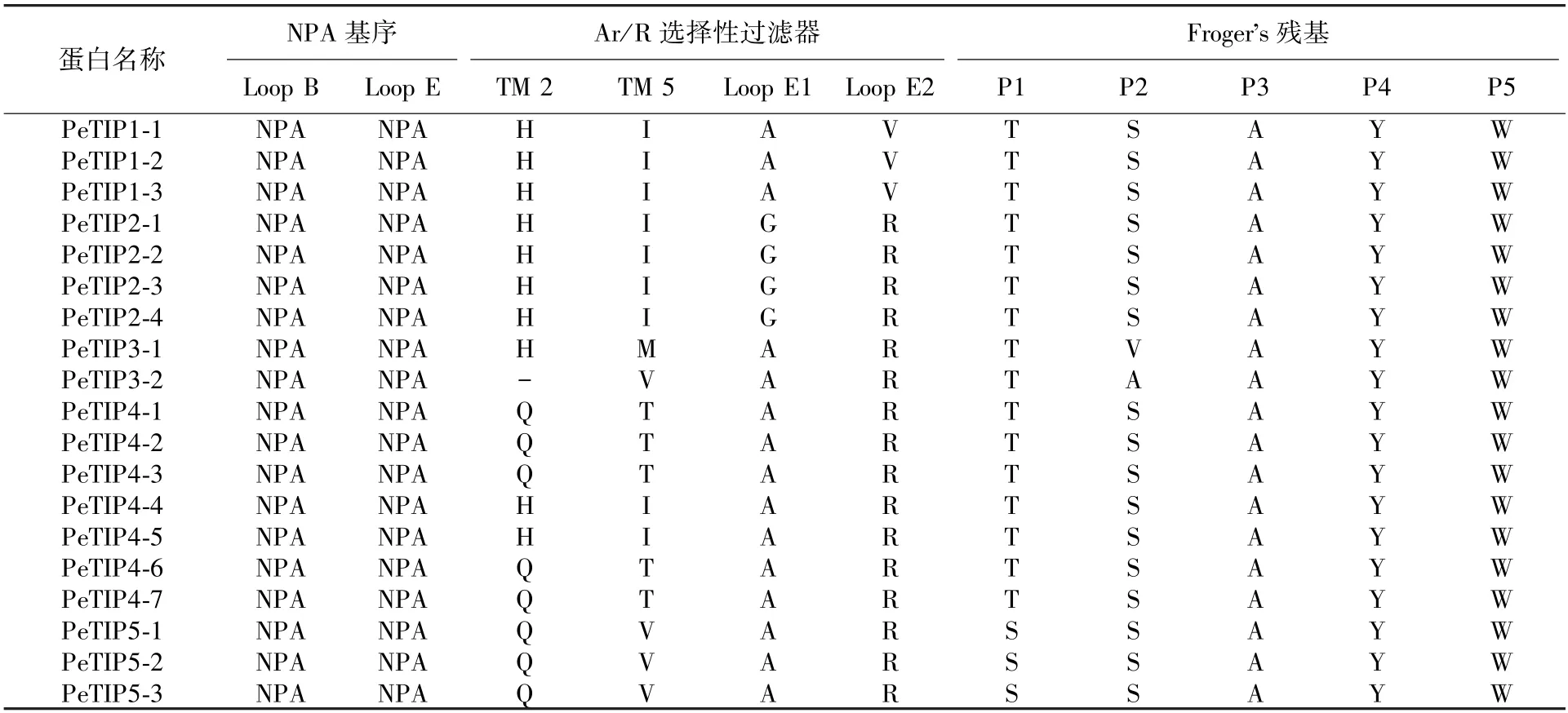
表3 PeTIPs氨基酸保守位点分析Tab.3 The amino acid conserved site analysis of PeTIPs
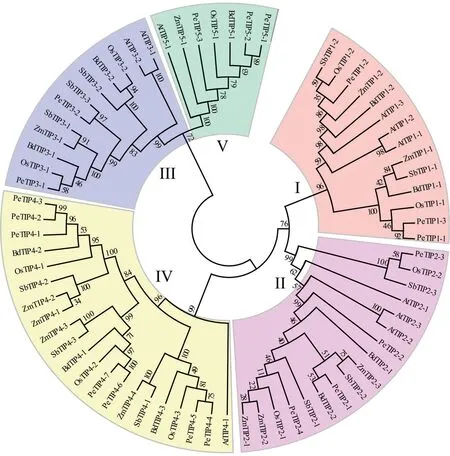
图2 基于不同植物TIP家族成员构建的系统进化树Fig.2 Phylogenetic tree constructed on the base of TIP family members in different plant species
2.4 PeTIPs基因片段复制和共线性分析
基因复制在基因家族扩张过程和功能演化中均发挥重要作用,而毛竹在进化过程中也经历了基因组复制和基因家族扩张事件[16]。相对于其他二倍体物种,毛竹TIP成员也出现了成员增多的现象(图2)。对毛竹和水稻中TIP成员的共线性关系进行分析结果表明,共有15个PeTIPs检测到共线性关系,其中在PeTIPs间存在10对片段重复;另外,12个PeTIPs与水稻8个TIP基因存在18对片段重复,没有发现串联重复以及其他重复类型的基因(图3A)。进一步分析发现,这28对重复片段中有11对发生在PeTIP4s分支中,另外还有9对重复片段发生在PeTIP5s分支中,这些结果支持了这2个分支发生过家族扩张的推测。此外,非同义对同义取代比(Ka/Ks) 是判断基因功能分化的重要指标,对所有具有片段重复的基因进行Ka/Ks分析结果显示,28对TIP基因的Ka/Ks均小于1.0 (图3B)。由此表明,PeTIPs在发生片段复制后,经历了较强的纯化选择,功能分化差异不大。
2.5 PeTIPs启动子序列调控元件分析
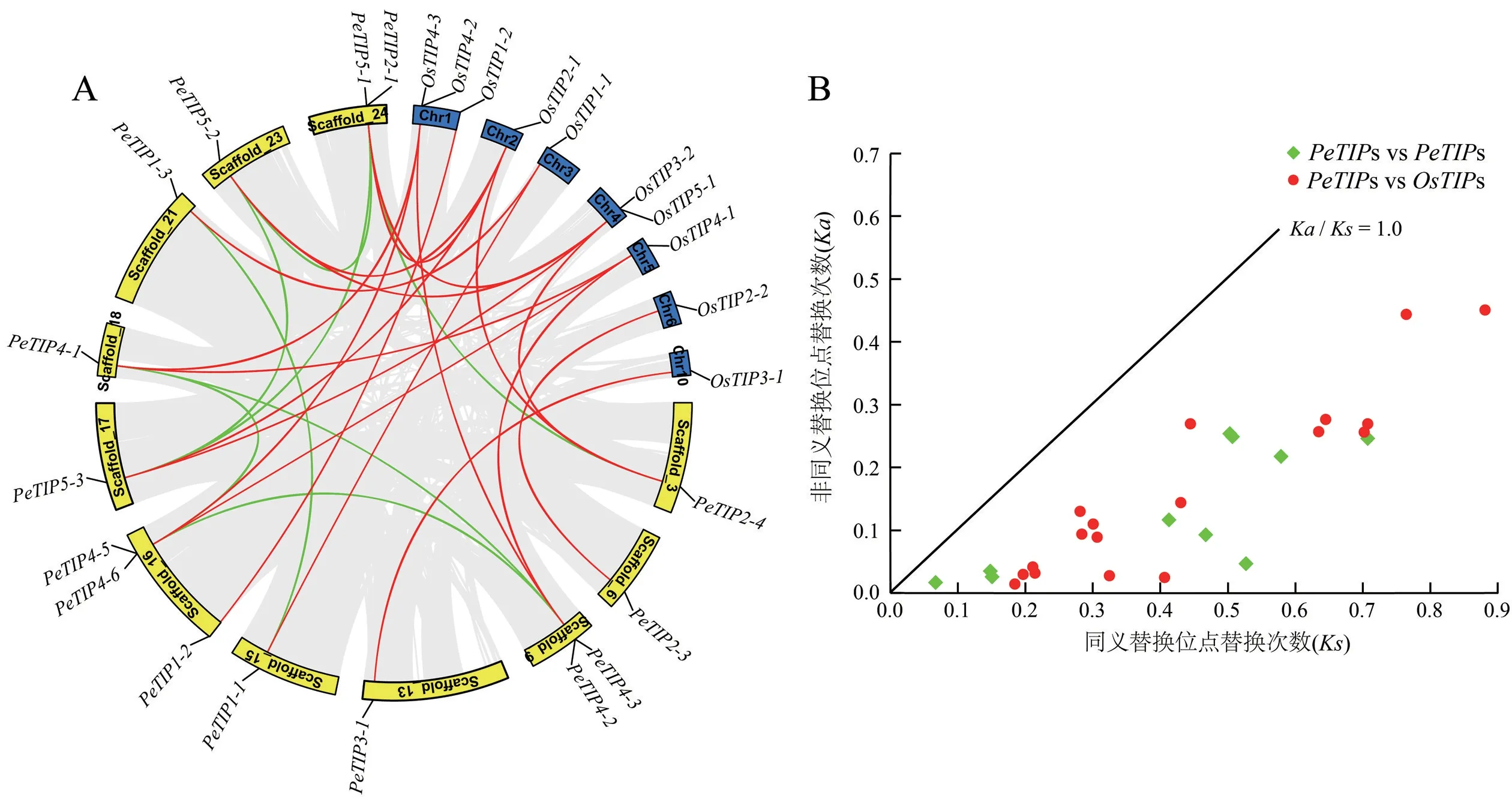
图3 毛竹和水稻TIP基因共线性和Ka/Ks 分析Fig.3 Collinearity and Ka/Ks analyses of TIP genes in moso bamboo and rice
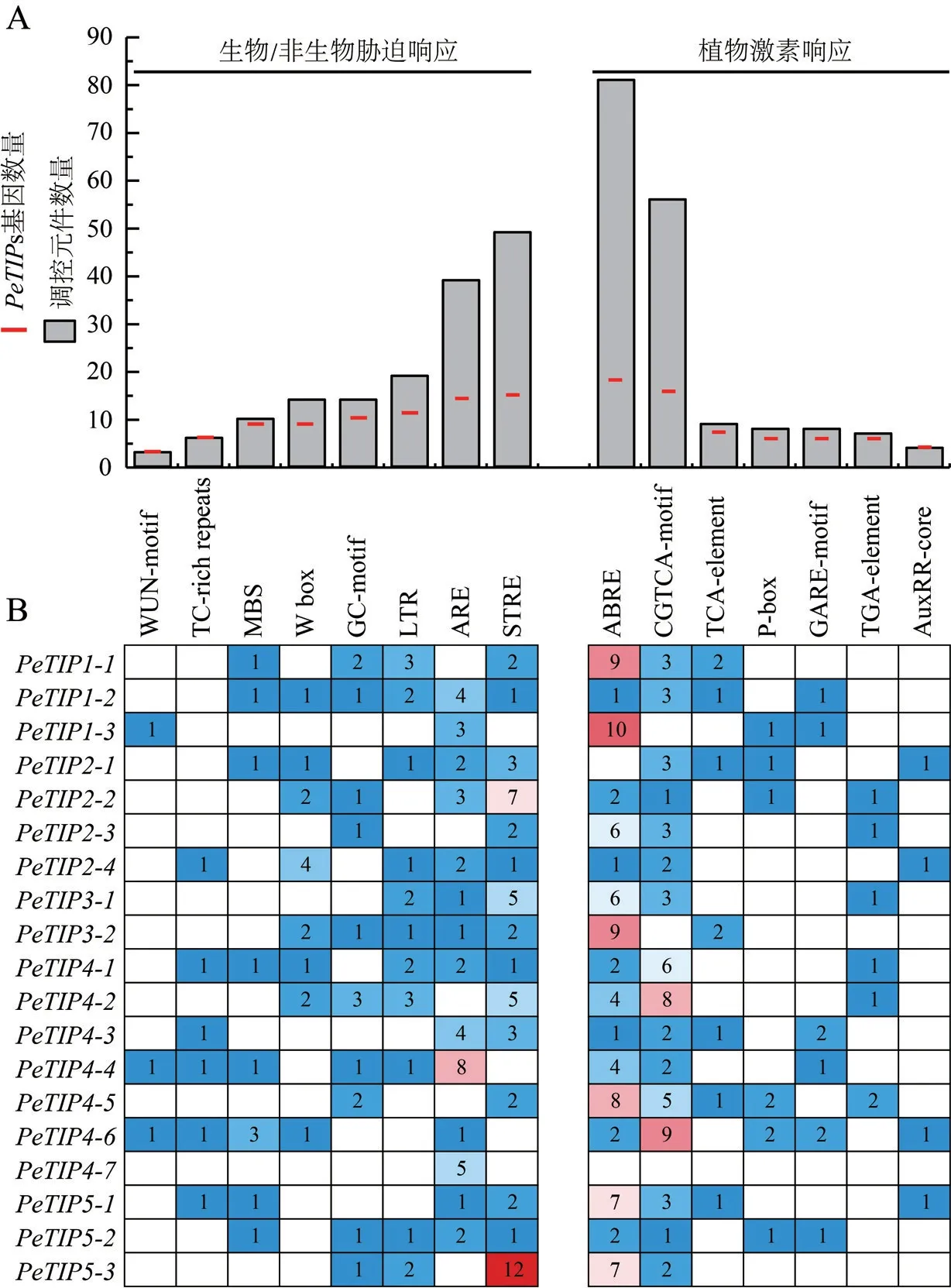
图4 PeTIPs基因启动子调控元件分析Fig.4 Analysis of regulatory elements in promoter sequences of PeTIPs
为更好地了解PeTIPs对不同逆境胁迫和植物激素的响应,对基因转录起始位点上游2 000 bp基因组区域内的调控元件进行了分析。结果显示,有8类作用元件参与胁迫和防御相关反应,7类作用元件与植物激素响应相关(图4A)。有15个基因的启动子中包含防御相关元件(STRE),14个基因中包含厌氧诱导响应元素(ARE);在这些启动子序列中还发现其他与胁迫相关的调控元件,如低氧特异增强元件(GC-motif)、低温响应元件(LTR)、真菌诱导响应元件(W box) 和MYB转录因子结合元件(MBS) (图4B)。响应植物激素的作用元件一直是人们关注的焦点,在17个和16个基因的启动子中分别发现了脱落酸响应元件(ABRE) 和茉莉酸甲酯(MeJA) 响应元件(CGTCA motif),在12个基因中鉴定出GA响应元件(GARE-motif和TGA-element),而生长素响应元件(AuxRR-core) 则较少富集于PeTIPs中(图4B)。这些结果表明,PeTIPs可能参与调节多种逆境胁迫和植物激素的应激反应。
2.6 基于非生物胁迫毛竹RNA-seq分析PeTIPs的表达模式
根据PeTIPs启动子中调控元件分析的结果,利用已发表的毛竹RNA-seq数据,对逆境胁迫条件下叶片中PeTIPs的表达模式进行了分析。结果表明,在低温、干旱和强光处理的毛竹叶片中,能检测到大部分PeTIP1s和PeTIP4s的基因的表达,PeTIP2s中仅有PeTIP2-3有表达,几乎检测不到PeTIP3s和PeTIP5s的表达(图5)。与处理前相比(0 h) 相比,低温胁迫2 h后5个PeTIPs (PeTIP1-1、PeTIP1-2、PeTIP4-1、PeTIP4-2和PeTIP4-3) 表达上调,至8 h时各基因的表达量又有所下调(图5A);干旱胁迫下的PeTIP1-2和PeTIP4-2也表现出相似趋势(图5B)。在强光处理0.5 h后,PeTIP4-1、PeTIP4-2和PeTIP4-3呈现出上调表达趋势,且至8 h时依然保持较高的表达量 (图5C)。由此表明,PeTIP1-1、PeTIP1-2、PeTIP4-1、PeTIP4-2和PeTIP4-3可能在参与毛竹叶片响应逆境胁迫中发挥着重要作用。
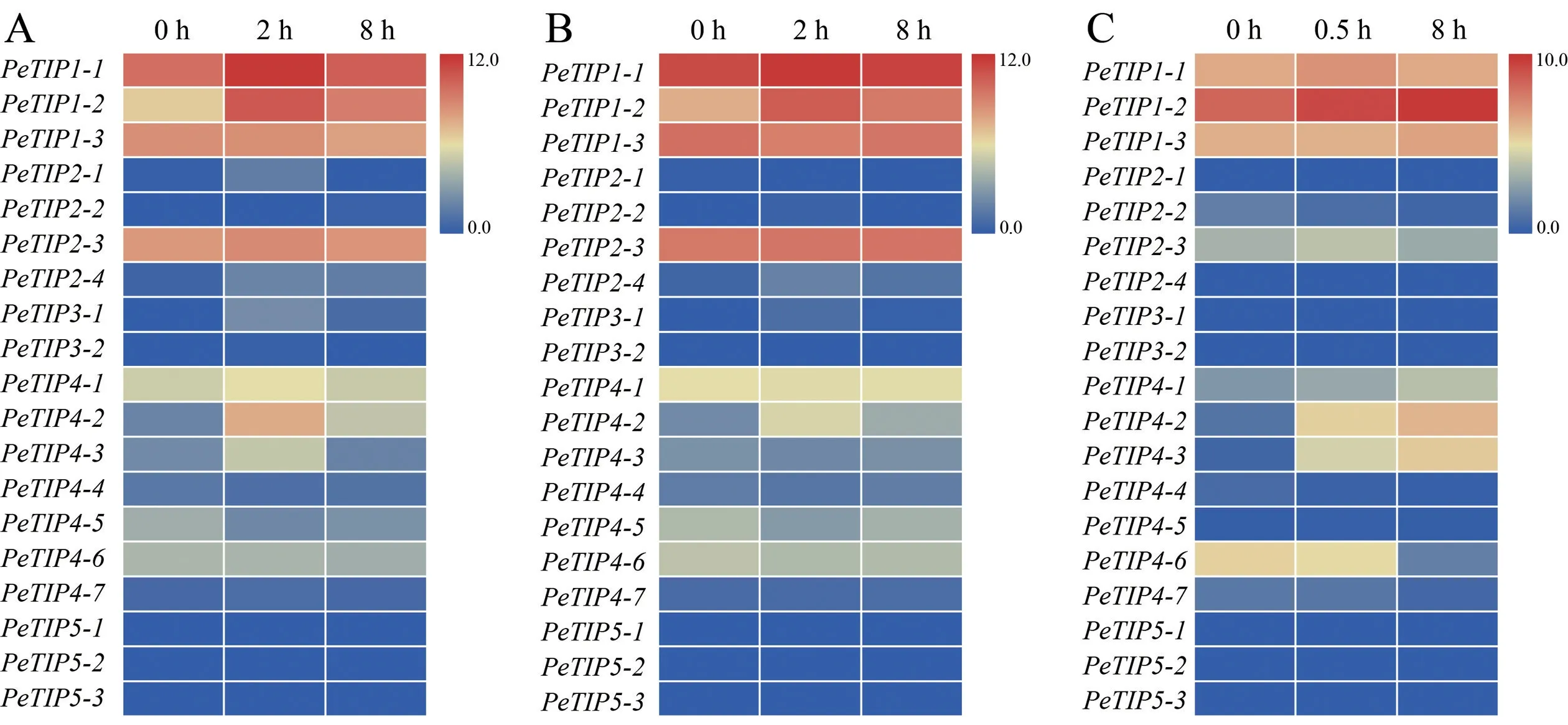
图5 不同非生物胁迫条件下毛竹叶片中PeTIPs的表达模式Fig.5 Expression profiles of PeTIPs in leaves of moso bamboo under different abiotic stresses
2.7 基于qPCR技术分析非生物胁迫下PeTIPs的表达模式
为进一步证实PeTIPs的表达模式,根据非生物胁迫的RNA-seq分析结果,选取6个(PeTIP1-1、PeTIP1-2、PeTIP1-3、PeTIP4-1、PeTIP4-2和PeTIP4-3) 在胁迫条件下叶片中表达变化的基因,采用qPCR技术进行了验证。结果表明,随着胁迫时间的延长,叶片中6个PeTIPs的表达呈现出一定的差异。在低温、干旱、高盐和强光胁迫处理下分别有2个(PeTIP4-1和PeTIP4-3)、3个(PeTIP1-3、PeTIP4-1和PeTIP4-3)、2个(PeTIP1-2和PeTIP4-2) 和1个(PeTIP4-3) 基因表现为不同程度的持续上调表达,且在胁迫处理中后期(4 h或8 h) 的表达量均显著高于对照组(0 h);在高盐胁迫下的2个基因(PeTIP1-1和PeTIP1-3) 则表现为先上升后下降的趋势,在胁迫处理4 h时表达量达到最高;此外,PeTIP4-2在干旱和高盐胁迫下表达量均显著高于对照组(0 h),但表达呈波动变化(图6A)。
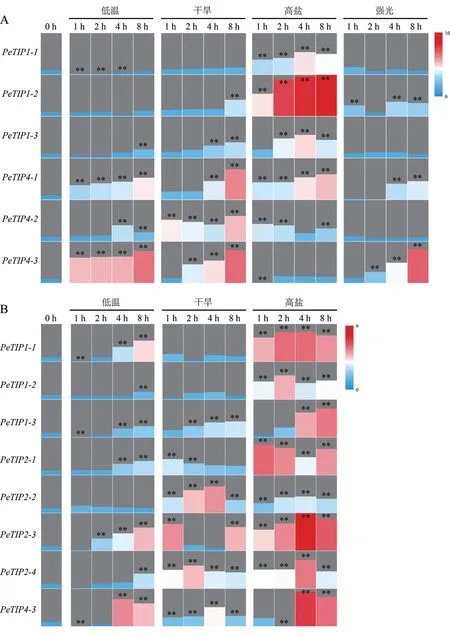
图6 不同胁迫条件下PeTIPs的表达分析Fig.6 Expression analysis of PeTIPs under different stresses
另外,根据PeTIPs在胁迫条件下叶片中的qPCR结果,同时结合RNA-seq数据中PeTIPs的组织表达情况[17],选取8个在根中表达的PeTIPs(PeTIP1-1、PeTIP1-2、PeTIP1-3、PeTIP2-1、PeTIP2-2、PeTIP2-3、PeTIP2-4和PeTIP4-3),分析它们在低温、干旱和高盐处理后毛竹幼苗根中的表达变化。结果表明,低温处理下,除PeTIP2-2之外,其余7个PeTIPs在处理前期(1 h或2 h) 的表达量均较低,在处理中后期(4 h或8 h) 的表达量显著上升。干旱胁迫下的8个基因变化趋势各异,其中PeTIP1-3的表达量随干旱处理时间延长而增加,而PeTIP2-1表现出相反的表达趋势;PeTIP2-2在干旱处理2 h和4 h表达量较高,而PeTIP2-3则在处理1 h和8 h的表达量较高。在高盐处理条件下6个基因(PeTIP1-1、PeTIP1-2、PeTIP2-1、PeTIP2-2、PeTIP2-3和PeTIP2-4) 的表达量均显著高于对照组,2个基因(PeTIP1-3和PeTIP4-3)在处理前期(1 h或2 h) 的表达量均较低,在处理中后期(4 h或8 h) 的表达量上升,与对照组(0 h) 达到差异显著水平(图6B)。
3 讨论
与动物相比,植物具有更多的AQPs亚家族和多样的异构体,其中有些是植物所特有的。研究表明,毛竹在进化过程中经历了全基因组复制事件和多数基因簇的分化[16],PeTIPs存在成员增多的现象。与其他植物相似,PeTIPs亚家族的19个成员被分为5个亚组(图2)[4,30-31],且所有亚组成员均含有保守的NPA基序和Froger's残基以及差异的Ar/R选择性过滤器 (图1和表3)。NPA基序是运输活动中必不可少的组成部分,在动物、植物、原生动物、真菌、真细菌和古细菌等多种MIPs中都比较保守[32-33],而Ar/R选择性过滤器则具有多样性[34],在决定底物亲和性和通过生物膜的效率方面均发挥着重要作用[35]。如菠萝Ar/R选择性过滤器的Loop E上一个缬氨酸(V) 被丙氨酸(A) 替换后,水分运输效率降低,但可以兼容运输甲酰胺、尿素和甘油[14,33]。PeTIPs不同亚组间的Ar/R选择性过滤器的多样性预示着它们蛋白结构和功能多样性。另外,PeTIPs亚家族Froger's位点保守的T-S-A-Y-W残基,推测它们可能也参与尿素和H2O2的运输[36]。
在进化过程中,多倍体化是植物适应新环境和形成新物种的重要机制[37]。TIPs是定位在液泡膜上的运输水分效率极高的一类膜蛋白,它主要负责水和小分子物质的运输,并参与细胞膨压调节、信号传导和细胞降解等过程[38]。TIPs还可以通过提高水分运输效率从而增强植物对干旱和盐胁迫的耐受能力[39]。通过对毛竹种内以及毛竹和水稻种间的TIPs的共线性分析发现,片段重复可能是PeTIPs数量增加的主要原因,且扩张的基因主要集中在PeTIP4s和PeTIP5s亚组(图3)。然而,28对基因对的Ka/Ks均小于1,表明PeTIPs在扩张进化的过程中受到了纯化选择,复制产生的新基因可能还没有形成新的功能[40-41]。影响植物基因功能的因素有很多,其中转录因子通过识别靶基因启动子特定位点调控基因表达是重要机制之一[42]。在PeTIPs启动子序列中存在多种逆境和激素相关的调控元件(图4),其中已证明MYB转录因子通过结合MBS参与干旱调节[43],元件 AuxRR-core参与生长素响应[44],推测PeTIPs启动子中所含相同的调控元件可能具有类似作用。
基因的表达特征是基因功能的重要表现方式。RNA-seq结果表明,不同PeTIPs亚组在胁迫条件下的叶片中的表达模式不同,暗示着其功能的差异,其中PeTIP1s和PeTIP4s的5个基因明显参与叶片对逆境胁迫的响应(图5)。qPCR结果进一步证明PeTIPs在不同逆境胁迫下表达模式存在差异,同一基因在毛竹不同组织中的表达模式也不尽相同(图6)。另外,RNA-seq和qPCR结果也存在一定差异,原因可能是二者所用材料不一致。由此表明,PeTIPs在逆境条件下功能的多样性,而其发挥作用的机制仍需更深入研究。目前,对植物AQPs的研究大多局限于其基因组和转录组以及单个基因功能的鉴定,很少涉及个体表型与特定AQP异构体基因型的关联研究[14],这将是未来研究的重要方向。植物AQPs除了在提高水的利用率和耐旱、盐、有毒土壤等方面具有广泛的推广应用前景外,在土壤和水资源的生物修复方面也有很大的潜力。此外,含有植物AQP的膜可用于各种溶质或气体 (CO2、NH3) 的净化,将在食品加工、改进和恢复工业正常环境中发挥重要作用[14]。因此,要发挥PeTIPs在生产生活等方面的功能,仍需开展大量的基础性研究工作。
4 结论
在毛竹新版本基因组中共鉴定出19个PeTIPs基因,分为5个亚组,各亚组成员均具有完整的保守结构域。PeTIPs启动子区域中含有多种参与胁迫、激素响应的调控元件,RNA-seq数据和qPCR结果证实了PeTIPs参与低温、干旱和强光的胁迫应答,推测它们在毛竹抵御外界逆境胁迫时发挥着不同的功能。研究结果将为进一步开展毛竹基因工程研究提供候选基因资源,对培育毛竹抗逆新品种具有重要参考价值。

