婴儿中枢神经系统肿瘤的生存和预后影响因素多中心回顾性队列研究
2021-03-12孙艳玲王淑梅杜淑旭龚小军眉葛赵卫红黄东生孙黎明武万水马晓莉
李 苗 朱 帅 支 天 谢 瑶 孙艳玲 王淑梅 杜淑旭 龚小军 金 眉葛 明 宫 剑 赵卫红 刘 嵘 黄东生 孙黎明 武万水 马晓莉
儿童中枢神经系统 (CNS) 肿瘤是一组异质性肿瘤,其中髓母细胞瘤是最常见的CNS恶性肿瘤,约占所有儿童CNS肿瘤的20%[1-3]。此外,CNS肿瘤中也包含低级别肿瘤,如毛细胞星形细胞瘤、脉络丛乳头状瘤(CPP)等。婴儿期(年龄 <1岁)起病的CNS肿瘤相对罕见,仅占儿童CNS肿瘤的1%~10%,具有独特的临床和生物学特征[4-5]。国内关于婴儿期CNS肿瘤的临床研究极少,缺乏多中心婴儿CNS恶性实体肿瘤群体研究数据。2020年1月首都医科大学附属北京儿童医院联合北京 5家较大的儿童肿瘤诊疗医院成立北京实体瘤多中心协作组(简称协作组),期望建立婴儿恶性实体肿瘤研究和随访团队。本文回顾性收集协作组医院近10年收治的婴儿期起病的原发性CNS肿瘤,总结其临床特征、生存和预后的影响因素。
1 方法
1.1 伦理 本研究经过首都医科大学附属北京儿童医院伦理委员会批准(审批号:2020-Z-012),已豁免患儿及其监护人知情同意。
1.2 研究设计 回顾性队列研究。以协作组医院初诊的婴儿原发CNS肿瘤病例为队列起点,基于多学科诊疗模式,即手术联合化疗,并以2020年 3 月 31 日为随访终点,观察生存和预后影响因素。
1.3 CNS肿瘤病理分型及临床分期、危险度分级 病理分型参照2016年WHO CNS脑和脊髓肿瘤分类国际标准[6]。危险度分级:WHO Ⅰ和Ⅱ级为低级别肿瘤,WHO Ⅲ和Ⅳ级为高级别肿瘤。肿瘤分期参照文献[7]:M0,无转移;M1~4期统称为M+期。
1.4 纳入标准 同时满足以下2条:①2011 年 6 月至2019年 12月协作组医院的病案室数据查询和上报的CNS肿瘤病历;②患儿起病年龄<12个月。
1.5 治疗原则 采用多学科诊疗模式,CNS肿瘤患儿行初次肿瘤切除术后,根据病理分型和临床分期决定是否需要放化疗。化疗方案参照CNS肿瘤诊疗规范,并根据患儿情况进行个体化调整[8-11]。本文手术后化疗病理分型需经首都医科大学附属的北京儿童医院、北京天坛医院和宣武医院中至少2家医院的病理专家会诊。因对神经认知和内分泌功能的长期影响,婴儿期尽量避免放疗[8,9]。
1.6 随访和疗效评估 CNS肿瘤确诊后的2年内每2~3个月、~5年每6个月行头颅及全脊髓平扫加增强MR扫描、肿瘤标记物等检查评估。肿瘤进展(PD) :颅脑 MR 检查示肿瘤增大≥25%,存在新发病灶,临床症状恶化; 复发:经综合治疗取得完全缓解后肿瘤再复发。
1.7 生存与预后影响因素采集 以低和高级别肿瘤分组,性别,起病年龄(<6月龄和~12月龄),M0和M+,肿瘤部位( 幕上、幕下、脊髓),肿瘤直径(<5 cm和≥ 5 cm),切除程度(全切/次全切:切除肿瘤组织/肿瘤组织残留<1.5 cm,非全切和病理活检),化疗与否,总体生存率 (OS,确诊至死亡的时间),无事件生存率(EFS,确诊至首次出现肿瘤复发、进展或死亡的时间)。
1.8 随访 协作组各医院采用门诊随访或电话方式随访,随访截止至2020年3月31日。
1.9 统计学方法 应用 SPSS 25.0统计软件进行数据分析。正态分布资料采用均数±标准差表示,非正态分布资料以中位数(范围)表示,计数资料采用卡方分析。生存资料采用 Kaplan-Meier及Cox回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 符合本文纳入标准的初诊婴儿原发CNS肿瘤52例。表1显示,男36例,女16例;诊断时中位年龄6.7 (0~12)个月,起病年龄<6月龄18例,其中新生儿期起病2例,1例为母亲孕7月产检时发现,1例为生后18 d;~12月龄34例。首都医科大学附属医院50例(北京世纪坛医院儿科5例、北京儿童医院42例、同仁医院儿科1例、天坛医院小儿神经外科2例),北京大学第一医院1例,首都儿科研究所附属儿童医院血液科1例。协作组中首都医科大学附属北京世纪坛医院儿科和北京儿童医院通过病案室数据查询,其他协作医院为上报病例。
2.2 临床表现 起病临床表现:呕吐17例,眼球活动受限/震颤11例,头围增大8例,抽搐5例,嗜睡、肢体无力和体重下降各3例,发育落后、喂养困难和肌张力改变各1例。
2.3 肿瘤部位和大小 表1显示,52例中,幕上33例(63%),幕下17例(33%),脊髓2 例;肿瘤直径<5 cm 26例(50%),≥ 5 cm 19例(36%),不详7例。
2.4 有无转移 M0 48例(92%),M+ 4例,其中1例颅内脑脊液播散,因手术风险大放弃手术切除肿瘤后1月内死亡,星形细胞瘤(低级别肿瘤)转移2例(死亡1例),多层菊型团胚胎性肿瘤(ETMR )1例经手术和化疗存活。
2.5 病理类型 表1显示,接受肿瘤切除手术和非开颅病理活检获得明确病理资料44例,低级别肿瘤24例,高级别肿瘤20例。①脉络丛肿瘤17例(39%),其中CPP 10例(低级别肿瘤),非典型脉络丛乳头状瘤 (aCPP) 3例(低级别肿瘤),脉络丛癌 (CPC) 4例(高级别肿瘤);②胶质瘤11例(25%),其中含毛黏液星形细胞瘤(PMA)7例(低级别肿瘤),毛细胞星形细胞瘤、神经节细胞胶质瘤及婴儿促纤维增生型星形细胞瘤/节细胞胶质瘤各1例(均为低级别肿瘤),胶质母细胞瘤1例(高级别肿瘤);③胚胎性肿瘤13例均为高级别肿瘤,其中髓母细胞瘤(MB)5例,非典型畸胎瘤/横纹肌样瘤(AT/RT)和ETMR各3例,松果体肿瘤2例;④非成熟畸胎瘤 2例(高级别肿瘤);⑤先天性造釉细胞型颅咽管瘤1例(低级别肿瘤)。


表1 初诊婴儿期起病的CNS肿瘤患儿一般资料[n(%)]
2.7 手术后化疗 手术后化疗24例,复发或进展11例,其中高级别肿瘤9例(AT/RT 3例,CPC和ETMR各2例,MB和松果体肿瘤各1例)均死亡,低级别肿瘤2例,1例星形细胞瘤死亡; EFS 13例,其中有事件存活1例。全切/次全切14例,部分切除9例,活检1例。
手术后未化疗20例;复发或进展1例后死亡(松果体母细胞瘤),EFS 19例。
2.8 生存时间分析 基于52例婴儿原发CNS肿瘤,随访时间截至2020年3月31日,中位随访时间29.7(22.3~37.0)个月。中位生存时间14.3(0~89.6)个月,中位无事件生存时间10.7(0~53.8)个月(图1A)。基于52例婴儿原发CNS肿瘤是否行肿瘤切除手术,中位生存时间(月) [0.94(0.01~1.24)vs19.12(0.01~89.63)]和中位无事件生存时间(月)[0.94(0.01~1.24)vs16.55(0.01~53.80)] 差异均有统计学意义(图1B和C);基于44例手术婴儿原发CNS肿瘤低高级别肿瘤,中位生存时间(月)[ 27.62(3.23~53.80)vs9.63(0.01~89.63)]和中位无事件生存时间(月)[24.67(2.4~53.80)vs8.73(0.01~44.97)],差异均有统计学意义(图1D和E);基于42例手术婴儿原发CNS肿瘤肿瘤位于幕上和幕下,中位生存时间(月)[23.83(0.03~53.80)vs9.23(0.07~35.33)] 和中位无事件生存时间(月)[23.77(0.03~53.80)vs8.23(0.07~35.33)],差异均有统计学意义(图1F和G)。
2.9 预后影响因素分析 基于44例手术的婴儿原发CNS肿瘤OS和EFS,总体OS为74.6%±7.1%,其中低级别肿瘤95.2%±4.6%,高级别肿瘤47.6%±12.8%,差异有统计学意义(表2);EFS 70.5%±7.8 %,其中低级别肿瘤87.5%±8.6%,高级别肿瘤49.5%±12.5%,差异有统计学意义(表3);OS(EFS)低和高级别肿瘤Log-rank分析中,切除程度变量差异有统计学意义(表2和3)。
表4显示,将表2和3中的肿瘤部位、切除程度、有无化疗变量纳入COX回归分析,肿瘤非全切较肿瘤全切/次全切婴儿OS和EFS的HR分别为5.7(95% CI:1.408~23.115)和5.1(95% CI:1.260~20.731);手术后化疗较未化疗婴儿OS和EFS的HR分别为18.0(95%CI:2.222~146.5897) 和8.3(95%CI:1.687~40.530);肿瘤部位幕下较幕上婴儿OS和EFS的HR分别为4.2(95%CI:1.563~11.291)和4.9(95%CI:1.996~12.216),均为影响OS和EFS的不良预后因素。

图1 婴儿期起病的CNS肿瘤患儿Kaplan-Meier生存曲线注 A为52例总生存曲线和无事件生存曲线;B和D为52例是否行肿瘤切除手术患儿生存曲线和无事件生存曲线;C和E为44例高低级别肿瘤生存曲线和无事件生存曲线;F和G为42例肿瘤部位幕下与幕上患儿生存曲线和无事件生存曲线

表2 WHO不同级别婴儿CNS肿瘤总体生存率预后因素的Log-rank 检验1)
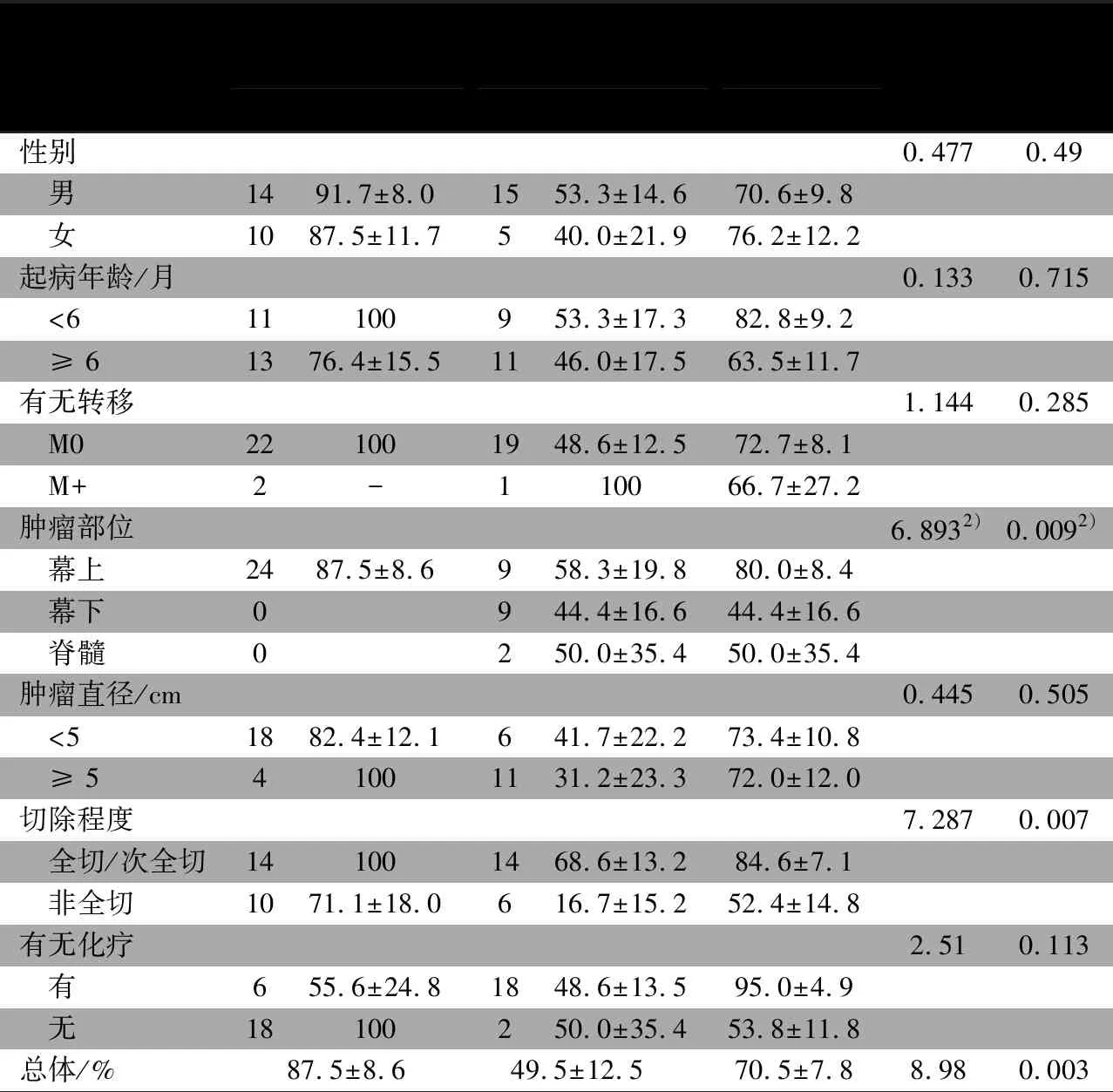
表3 WHO不同级别婴儿CNS肿瘤3年无事件生存率预后因素的Log-rank 检验1)
3 讨论
CNS肿瘤美国的发病率约为3.3/100 000,随年龄增长呈递增趋势[10]。本文男婴居多(男36例,女16例),与多数文献相符[5,10,11]。本文婴儿中位起病年龄6.7个月,新生儿期起病2例,1例为母亲孕检时发现。有研究指出,起病年龄< 6个月更倾向为先天性CNS肿瘤[12],本文婴儿均未发现有恶性肿瘤家族史,1例同时患有先天性心脏病,应注意先天遗传性疾病可能。
本文患儿以呕吐、头围增大等颅高压症状、体征为主,部分患儿出现抽搐、运动发育落后或倒退、喂养困难等表现;不同于成人及年长儿童,多以头痛症状为主诉。因婴儿颅缝未完全闭合,发病时肿瘤体积通常较大。若以肿瘤任一直径 ≥5 cm 定为巨大肿瘤,生存分析未发现巨大肿瘤对患儿OS[(81.5±8.4)vs(70.0±13.0),P=0.62]及EFS[(73.4±10.8)vs(72.0±12.0),P=0.505]有明显影响,考虑肿瘤负荷并非影响该组患儿生存的预后因素。本文低级别肿瘤患儿中,肿瘤均位于幕上;高级别肿瘤患儿中,幕上、幕下各9例,脊髓2例,提示婴儿低级别肿瘤以幕上部位(鞍区、侧脑室等)多见,而胚胎性肿瘤多以幕下居多(小脑、第四脑室等),与文献报道一致[5, 13-16]。通常肿瘤转移为CNS肿瘤预后不良的因素[1, 8],本文4例术前发现转移的患儿,OS及EFS差别不明显,考虑与样本量小有关。
关于婴儿期起病的CNS肿瘤病理类型分布特征,Larouche 等[13]回顾分析1 289 例婴儿脑肿瘤的资料,星形细胞瘤(30.5%)发病率最高,其次为MB(12.2%)、室管膜(11.1%)和脉络丛肿瘤(11%)。Bishop等[17]基于美国2008年SEER数据库中婴儿脑肿瘤的数据统计,病理类型分布与Larouche等报道基本一致。Shahab等[18]报道胎儿期婴儿原发CNS肿瘤类型以畸胎瘤最多见,其次为胶质母细胞瘤、ETMR等,提示胎儿期CNS肿瘤类型分布不同于较大年龄婴幼儿及儿童。本文44例病理明确的CNS肿瘤患儿中,病理类型10余种,体现出婴儿CNS肿瘤的异质性。病理类型依次为CPP、低级别胶质瘤和MB,胶质母细胞瘤仅1例,未见室管膜瘤患儿,与文献报道有区别。
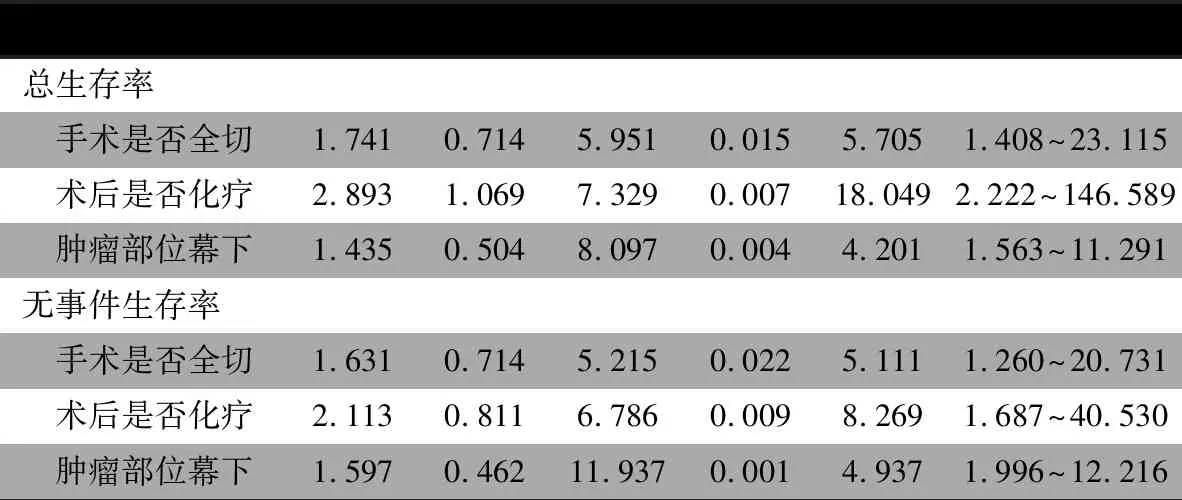
表4 婴儿CNS肿瘤总体生存率及无事件生存率的多因素COX回归分析
不同病理类型间预后差别巨大。一项单中心98例婴儿脑肿瘤研究发现[14],婴儿CPP或低级别胶质瘤均存活, 但可能需要多次手术,而间变室管膜瘤、AT/RT、ETMR等5 年OS最低。本文24例低级别胶质瘤中,仅有1例因肿瘤复发进展死亡,余10例死亡者均为高级别肿瘤,其中AT/RT 及松果体母细胞瘤2例均死亡,3例ETMR 中2例死亡,5例MB仅1例死亡,提示组织病理类型为影响预后的重要因素[1,3,5,14,17]。
手术切除肿瘤仍为首要治疗方式[8, 15,16]。虽然婴儿期手术风险高于较大年龄儿童,但近年来随着显微外科技术不断进步,婴儿期CNS肿瘤手术成功率得到很大提高。本文44例接受手术中,43例未出现围术期并发症,44例手术患儿与未行肿瘤切除手术的8例患儿(全部于诊断后1.3月内死亡)相比,OS和EFS差异有统计学意义(P< 0.001,图1 C和D),提示除组织学类型外,肿瘤切除程度是影响患儿预后的重要因素[8,15],尤其是高级别肿瘤如AT/RT、ETMR、CPC等,争取在风险可控前提下尽量手术切除肿瘤对延长生存期具有重要意义。
因对神经认知和内分泌功能的长期影响,多数研究推荐3岁以下婴幼儿尽量避免放疗[8, 9,15, 19]。本文病例均未采用放疗。
婴儿期CNS肿瘤的化疗方案及疗效尚处于探索中,具体方案取决于病理类型。低级别肿瘤中CPP和胶质瘤最多见,以手术切除为主要治疗,多可长期存活[12-15,17]。CPP多位于脑室系统,手术切除后仅有1例接受化疗,均存活,存活时间3.2~43.0个月。低级别胶质瘤最常见病理类型为毛细胞或毛黏液星形细胞瘤,如累及视路、视交叉、下丘脑等部位,即视路胶质瘤(OPG),占所有儿童脑肿瘤的4%~6%[20],可导致严重的视觉和内分泌功能障碍,手术多无法全切,需引起重视,因多存在MAPK信号通路异常,BRAF、MEK等抑制剂可改善预后[21]。提示临床需对婴儿期低级别胶质瘤患儿加强基因筛查,寻找合适的靶点,为选择优化的治疗方案提供依据。放疗对OPG患儿的视力、视野恢复有一定疗效,更推荐用于5~7岁以上的散发型、进展性OPG或化疗无效的患儿[20]。
婴儿期高级别肿瘤中,胚胎性肿瘤多见[5,13,14,17]。其中MB为预后相对最好的类型,得益于精准危险度分层的规范化个体化治疗[1, 8,22-24],5年OS 标危组达到80%,高危组60%左右[1]。随着全基因组测序及DNA甲基化等技术发展,WHO第4和5版 CNS 肿瘤分类按分子基因特征进行分型[25],其中分子分型SHH伴TP53突变者预后极差,发生率约为SHH型MB的21%,为极高危,组织学分型多为大细胞/间变型。本文5例婴儿期MB,组织学类型均为促纤维增生结节型,3例SHH型,未见TP53突变,无转移,为标危类型[8],2例未行分子分型检测,总存活率80%,与文献报道相符。今后临床需加强分子整合组织学诊断,进行精准危险度分层,便于选择最优的个体化治疗方案。
除MB外,其他婴儿型胚胎性肿瘤预后较差,包括非典型畸胎样/横纹肌样瘤[26-27]、ETMR[20]等。其中AT/RT是一种罕见的CNS恶性肿瘤,好发于3岁以下婴幼儿,呈高度恶性并早期随脑脊液播散种植,预后极差。Park等[26]对多中心收治的43例3岁以下AT/RT患儿进行回顾性研究,3年无进展生存率(PFS)/OS分别为 28.5%及38.1%,其中3年PFS 由0(2011年前)提高至47.4%(2011年后),本文AT/RT 3例均死亡。松果体母细胞瘤为恶性度高的CNS肿瘤,预后差,本文2例均死亡。另本文CPC 4例及不成熟畸胎瘤2例均为高级别肿瘤,恶性程度高,术后需进行化疗及放疗。接受化疗的CPC及不成熟畸胎瘤各2例,预后相对较好,均存活。
因此,辅助化疗对除MB外的其他婴儿期胚胎性肿瘤的疗效仍不理想,治疗方案有待进一步探索。大剂量化疗联合自体干细胞移植、靶向或免疫治疗等综合性治疗,以及延迟局部放疗或质子治疗等或有助于提高婴儿期CNS肿瘤的生存率[1,16,24,26-27]。
本文不足与局限:①本文以协作组医院收集初诊的婴儿原发CNS肿瘤病例,但在协作组医院间病例分布极为不均衡,除与各协作医院学科侧重方向不同有关,也可能与基于病案室数据查询和协作组医院上报的CNS肿瘤病历有关;②协作组医院婴儿CNS肿瘤非连续病例;③协作组医院化疗方案不统一,可能影响OS结局;④协作组医院随访方案不统一,可能影响EFS,未对肿瘤复发、进展进一步分析;⑤本文样本量不足,不良预后影响因素95%CI宽泛(非全切、高级别肿瘤和肿瘤部位幕下),结论不扎实。
