华丽牛肝菌菌塘土壤细菌多样性的高通量测序分析*
2021-03-12杜俊希申利群
伍 燕,杜俊希,张 娟,申利群
(1.兴义民族师范学院,贵州 兴义 562400;2.广西民族大学 化学化工学院,广西 南宁550006;3.广西林产化学与工程重点实验室,广西 南宁550006)
华丽牛肝菌(Boletus magnificus W.F.Chiu)属牛肝菌科(Boletaceae)牛肝菌属(Boletus),又名红见手青、红葱牛肝菌,是一种味道鲜美、经济价值较高的中小型牛肝菌[1]。在自然界,几乎所有的牛肝菌都属于外生菌根菌[2-4],菌根与特定植物根系形成营养方式密切的共生体,牛肝菌大多以这种方式在生境中生存。目前,已实现人工栽培的牛肝菌是营养方式兼具腐生型的暗褐网柄牛肝菌(Phlebopus portentosus)[5-6];而美味牛肝菌 (Boletus edulis)、远东疣柄牛肝菌(Leccinum extremiorientale)和褐环乳牛肝菌(Suillus rubinellus)[7-10]均不能在人工培养条件下形成子实体。一方面是对牛肝菌与其宿主植物之间的关系和作用机制了解较少;另一方面是未充分了解牛肝菌生活环境的微生物群落丰富度和多样性结构。
菌塘(shiro)是由牛肝菌的地下菌丝、宿主根系及周围的腐质土壤结合形成的团状结构,是牛肝菌菌丝体萌发和形成子实体的重要条件,对于牛肝菌这种经济价值高且不能人工栽培的山珍,菌塘的生物学特性吸引了大量研究者进行相关研究。秦余等[11]运用新一代高通量测序技术对远东疣柄牛肝菌(Leccinum extremiorientale)、美味牛肝菌 (Boletus edulis)和小孢粉孢牛肝菌(Tylopilus microsporus)菌塘进行研究,发现这3种菌塘中的细菌以酸酐菌门、变形菌门、拟杆菌门和放线菌门为主;张举龙等[12]采用变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)技术对点柄乳牛肝菌(Suillus granulatus)菌塘研究发现,菌塘中变形菌门和酸杆菌门菌群的相对丰度较高,是其中的优势菌群;郭霞等[13]研究还发现,蜡样芽孢杆菌(Bacillus cereus)对美味牛肝菌(Boletus edulis)菌根生长有促进作用。据《真菌词典》记载,牛肝菌科是一大类,有35属、26亚属超过787种[14],可食用牛肝菌约200种,由于对牛肝菌环境微生物组成和结构研究不多,目前对其菌塘生境也缺乏规律性认识。基于此,以华丽牛肝菌菌塘土壤为研究对象,采用高通量测序技术,结合生物信息学研究方法,对4个不同地区盛产牛肝菌采集点的土壤微生物群落特征进行研究,找出优势菌群、分析共性,为下一步为华丽牛肝菌的人工栽培研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 样品采集
2019年8月分别在4个出产华丽牛肝菌的地点采集。兴义仓更镇(平均海拔1 013 m),板栗(Castanea mollissima Blum)树下,记为XC;兴义市乌沙镇(平均海拔1 300 m),青冈林(Cyclobalanopsis glauca)下,记为XW;安龙县海子镇(平均海拔1 500 m),松木林(Pinus yunnanensis Franch.)下,记为XH;安龙县新桥镇(平均海拔1 200 m),青冈林下,记为XQ。每个地点选取3处华丽牛肝菌生长旺盛的菌塘,在距菌根2 cm半径周围处取土样,土样混合后放入4℃冰箱保存[15]。
1.1.2 药品及试剂
E.Z.N.ATMMag-Bind Soil DNA Kit试剂盒,美国OMEGA公司;Qubit3.0 DNA检测试剂盒,美国Life公司;2×Taq Master Mix,南京诺唯赞生物技术有限公司;MagicPure Size Selection DNA Beads,北京全式金生物技术有限公司;无水乙醇等试剂均为AR级,国药试剂集团有限公司。
1.2 仪器和设备
Pico-21台式离心机,美国赛默飞公司;Bio-Rad PCR扩增仪、凝胶成像仪,美国伯乐公司;Q32866 Qubit®3.0荧光计,美国英杰生物技术有限公司;DYCZ-21电泳槽、DYY-6C型电泳仪电源,北京市六一仪器厂。
1.3 方法
1.3.1 样品预处理
称取200 mg土样,放入灭菌的2 mL离心管中,加入1 mL 70%乙醇混匀,10 000 r·min-1室温离心3 min,弃上清。加入1×磷酸盐缓冲液(PBS)混匀,10 000 r·min-1室温离心3 min,弃上清,样品干燥待用。
1.3.2 总DNA 提取和检测
按照试剂盒 E.Z.N.ATM Mag-Bind Soil DNA Kit使用说明操作提取总DNA,1%琼脂糖凝胶检测DNA完整性。
1.3.3 PCR 扩增
1)扩增及纯化
用Qubit3.0 DNA检测试剂盒对基因组DNA准确定量,第一轮PCR以16S rRNA基因V3-V4通用引物进行扩增(341F:5′-CCCTACACGACGCTTTCC-GATCTG (barcode)CCTACGGGNGGCWGCAG-3′;805R:5′-GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC-3′),扩增结束后对PCR产物进行检测和纯化[16];第二轮PCR加入Illumina桥式PCR兼容引物扩增,对于细菌扩增的PCR产物和正常扩增片段在400 bp以上的PCR产物,选用0.6倍磁珠吸附(Agencourt AMPure XP)。
2)扩增条件
PCR扩增为30 μL体系:2×Taq masterMix 15 μL,341primerF 1 μL,805primerR 1 μL,基因组DNA 1 μL,用 ddH2O 补足至 30 μL。PCR 扩增条件为95℃预变性5 min;95℃反应30 s,45℃反应20 s,65℃反应30 s,5个循环;95℃反应20 s,55℃反应20 s,72℃反应30 s,20个循环;72℃延伸 5 min,转为4℃保存[17]。
1.3.4 测序
PCR产物纯化后,采用Illumina MiSeq第二代高通量测序平台测定16S高变区域的序列,测序片段为双向2×300 bp,委托上海生工完成测序。
1.3.5 数据分析
高通量测序序列(reads)通过拼接、过滤、去除嵌合体及非特异性扩增序列,使用QIIME软件,绘制操作分类单元(operational taxonomic unit,OTU),依据OTU数目变化与聚类相似值之间的关系图,从中选择最佳的相似度值 (similarity)(>0.97)进行OTU分析和分类学鉴定。每个OTU不少于120个有效碱基,每条OTU对应一种代表序列,基于16S RNA基因数据库(RDP数据库、Silva数据库、NCBI 16S数据库)对每一条OTU进行16S rRNA基因序列注释。
2 结果与分析
2.1 菌塘多样性指数(Alpha)分析
野生华丽牛肝菌生境见图1。

图1 野生华丽牛肝菌生境Fig.1 A wild fruiting body from Boletus magnificus
图1为野生华丽牛肝菌生境,地点为兴义仓更镇,板栗树下,此处平均海拔1 013 m,年平均气温16℃,气候温润多雨。
Alpha多样性指数分析可以反映微生物群落的丰度和多样性,其中表明群落分布丰度(community richness)的指数有Chao1和ACE,数值越大说明群落分布丰度好;Shannon和Simpson指数表明群落分布多样性(community diversity),Shannon值越大或Simpson值越小,说明群落多样性越高。各采集点菌塘土壤高通量测序数据质量分析结果见表1。
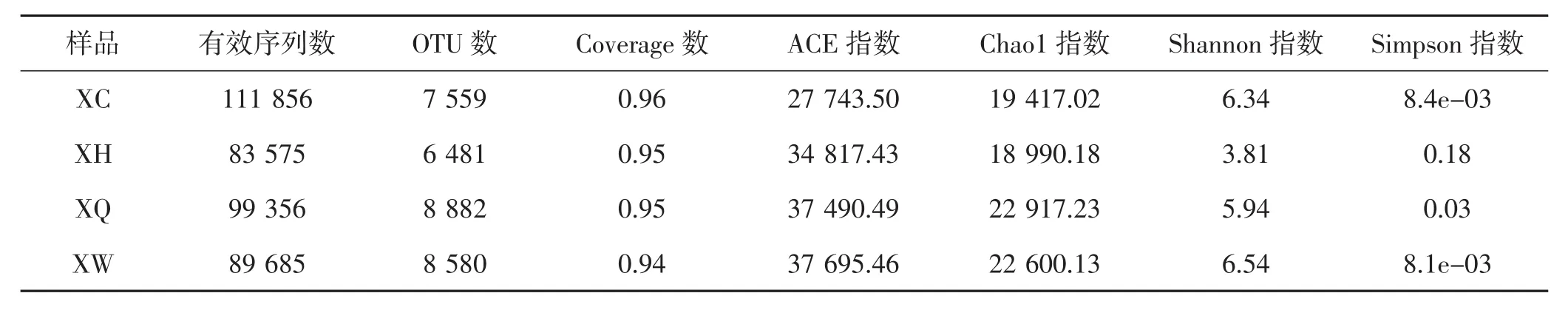
表1 菌塘土壤中细菌Alpha多样性分析结果Tab.1 Analysis and results of bacteria Alpha diversity in shiroes soil
由表1可知,4个采集点的样品通过高通量测序,共得到384 472条有效序列,样本聚类得到31 502条有效OTU,样品的覆盖指数(coverage)>0.94以上,覆盖率高,能真实反映样品的测序情况。XQ和XW的Chao1指数最高,说明样本的菌群丰度最高;XC和XW的Shannon指数较高、Simpson指数较低,说明2个地点的菌群多样性较丰富。不同土壤样品中细菌的稀释曲线见图2。
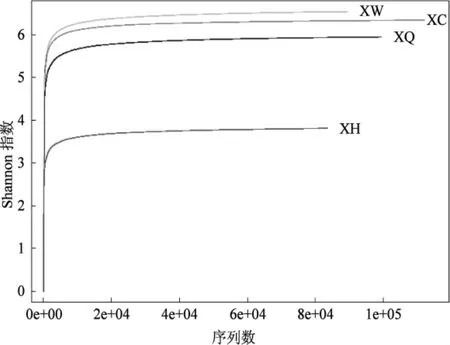
图2 不同土壤样品中细菌的稀释曲线Fig.2 Rarefaction curves of bacterias in different soil samples
由图2可知,4个样品的稀释曲线(rarefaction),shannon indexs指数呈直线上升,后趋向平稳,表明测序数据能覆盖菌塘中绝大多数细菌信息,曲线在平滑稳定后产出的OTU数趋于稳定,其中样品XH的Shannon指数稍低,说明该采集地的细菌多样性较其他3个菌塘有一定差距。
2.2 各样品中细菌类群的相关性分析
不同菌塘细菌基于OTU序列的聚类树见图3。
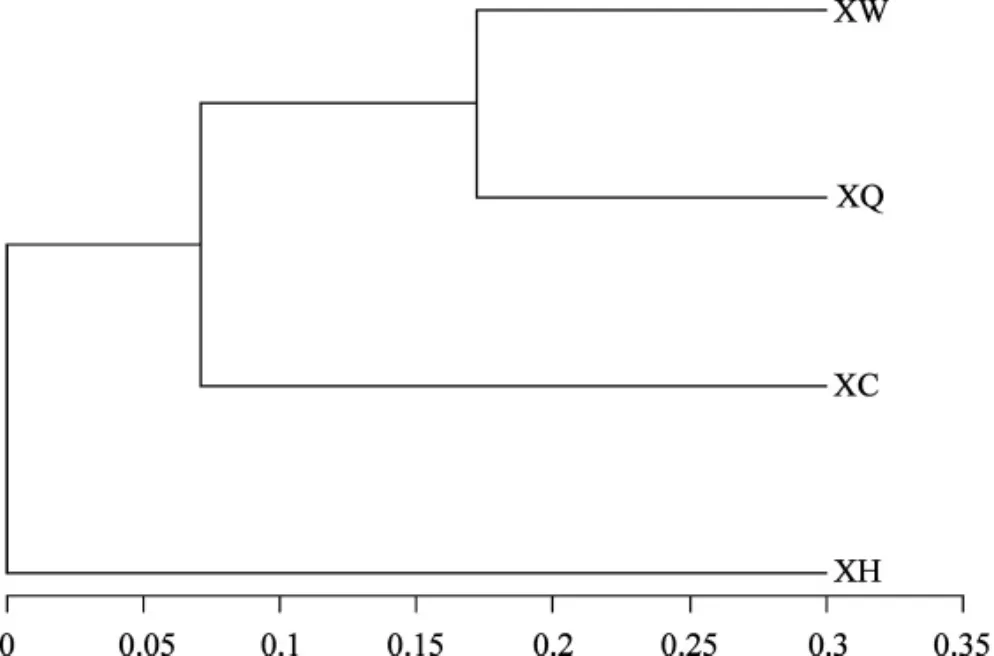
图3 基于OUT序列的样本聚类树Fig.3 Clustering tree diagram based on OUT sequence
由图3可知,XW和XQ聚成一类,并和XC在同一个簇上,XH位于较远分支,直观反映了不同土样菌群的相似性和差异关系。不同土壤样本主成分分析(principal components analysis,PCA)见图4。
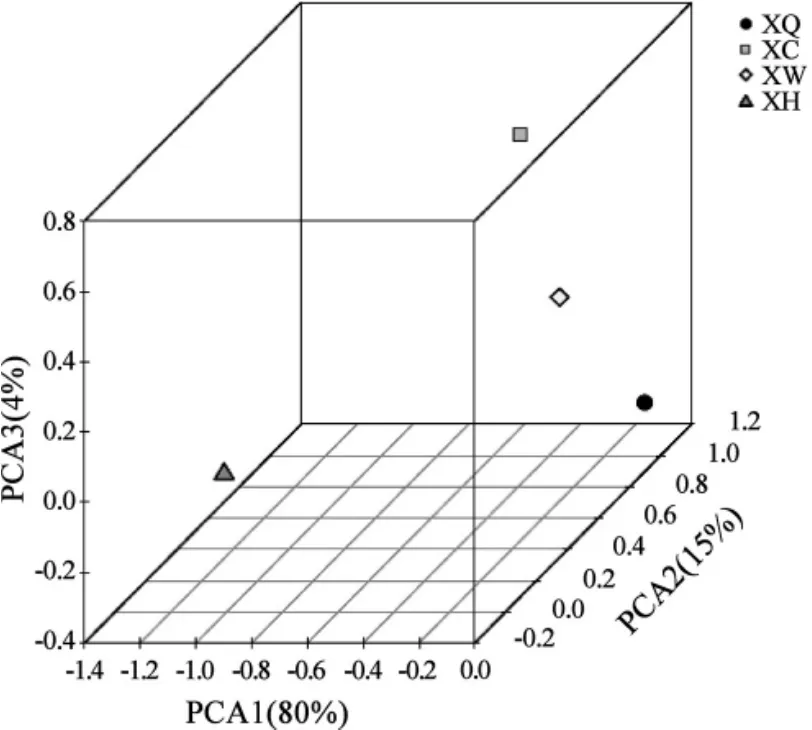
图4 不同土壤样本的PCA分析Fig.4 PCA analysis of different soil samples
由图4可知,XW、XQ和XC散布在相邻区域,XH在较远的区域,反映了取样生境不同,微生物菌群的差异性导致的差异。各样品间OTU相关性韦恩图见图5。
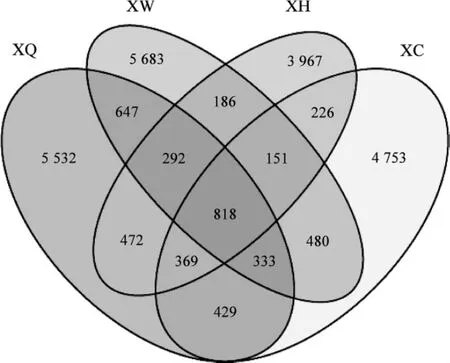
图5 不同样品中细菌多样性的相关性分析Fig.5 The similarity analysis of bacteria diversity in different soil samples
由图5可知,XQ样品中的细菌种类是8 882个、XW样品中的细菌种类是8 580个、XH样品中的细菌种类是6 481个、XC样品中的细菌种类是7 559个;聚类关系比较近的XQ和XW共有的OTU数是2 080个,XQ、XW和XC三者共有的OTU数是1 151个,而4个样品都共有的OTU数是818个,占OUT总数的7.05%;XQ、XW、XH和XC样品分别与其他样品发生重叠的数是3 350、2 897、2 544和 2 806个,分别占各自总数的 37.72%、33.76%、39.25%和 37.12%,反映了各自生境中土壤菌群的复杂性和共性。
2.3 菌塘中细菌组成分析
属级水平上不同土壤样品属水平分类丰度统计见图6。
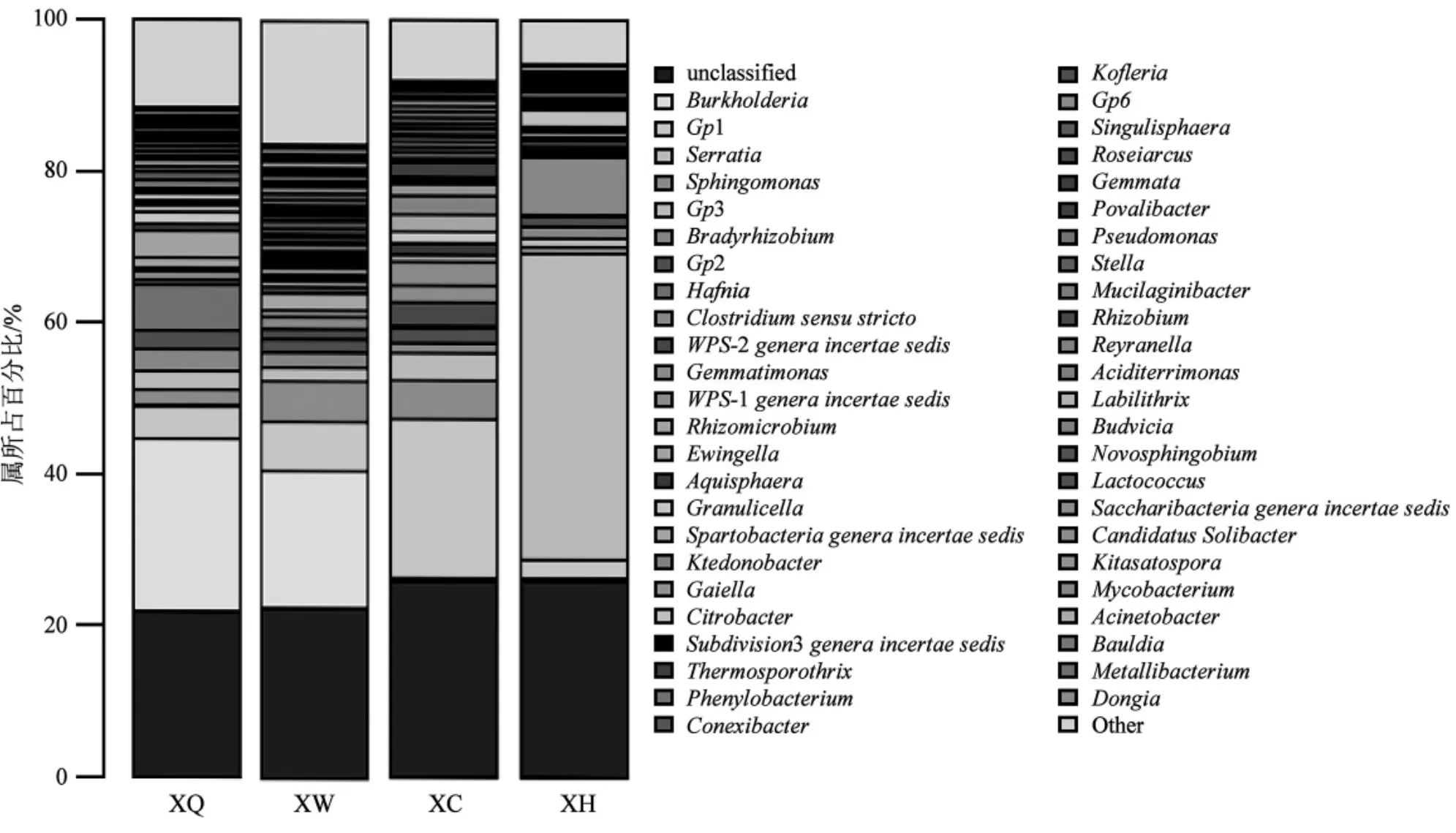
图6 不同土壤样品属水平分类丰度统计Fig.6 Relative abundance statistical figure of genus classification in different soil sample
由图6可知,4个菌塘可鉴定细菌分属于30个门78个属,主要有变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、厚壁菌门 (Firmicutes)、拟杆菌门 (Bacteroidetes)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria)等。
2.3.1 XQ 菌塘细菌分类
变形菌门占69.06%,下属主要有伯克氏菌属(Burkholderia,46.92%)、哈夫尼菌属 (Hafnia,12.19%)、缓生根瘤菌属 (Bradyrhizobium,5.32%)和鞘氨醇单胞菌属(Sphingomonas,2.63%);酸酐菌门占 15.81%,下属主要有 Gp1(8.89%)、Gp2(4.95%)和 Gp3 (1.97%);芽单胞菌门主要是芽单胞菌属 (Gemmatimonadetes,2.22%);此外还有WPS-1 genera incertae sedis(1.07%)和 WPS-2 genera incertae sedis(1.36%)。
2.3.2 XW 菌塘细菌分类
变形菌门占58.34%,下属主要有伯克氏菌属(Burkholderia,41.51%)、鞘氨醇单胞菌属 (Sphingomonas,11.08%)和缓生根瘤菌属 (Bradyrhizobium,2.75%);酸酐菌门占24.04%,主要的属有Gp1(15.39%)、Gp2(4.26%)和 Gp3(4.39%);芽单胞菌门主要是芽单胞菌属(Gemmatimonadetes,5.69%);此外有 WPS-1 genera incertae sedis(2.32%)和WPS-2 genera incertae sedis(3.21%)。
2.3.3 XC 菌塘细菌分类
酸酐菌门占 62.39%,下属主要有 Gp1(49.09%)、Gp2 (5.09%)和 Gp3 (8.21%);变形菌门占 14.70%,主要的属有鞘氨醇单胞菌属(Sphingomonas,11.64%)、缓生根瘤菌属 (Bradyrhizobium,2.17%)和伯克氏菌属(Burkholderia,0.89%);芽单胞菌门主要是芽单胞菌属 (Gemmatimonadetes,5.07%);此外有 WPS-1 genera incertae sedis(7.51%)和WPS-2 genera incertae sedis(7.42%)。
2.3.4 XH 菌塘细菌分类
变形菌门占72.13%,主要的属有沙雷氏菌属(Serratia,65.23%);酸酐菌门占 2.97%,主要有Gp1(1.31%)和 Gp6(0.92%);此外还有 WPS-1 genera incertae sedis(9.07%)。
2.4 基于属水平的优势细菌分析
在属水平上,把4个菌塘中相对丰度在5%以上的细菌列为优势菌,统计结果见表2。

表2 4个样品中优势细菌及相对丰度Tab.2 Dominant bacteria and relative abundance of 4 samples
由表2可知,4个菌塘中的优势菌各有特点,XQ和XW菌塘含有大量伯克氏菌属(46.92%~41.51%,Burkholderia),这2个菌塘位于青冈林下属于原生态环境,人类活动较少,生境大致相同,优势菌群均是以固氮菌和解钾为主的伯克氏菌属;XC取样于板栗林下,人工打药、施肥活动频繁,Gp1含量较高(49.09%),据王继玥等[18]对Pb污染后的三叶草土壤细菌多样性变化分析认为,Pb污染会导致土壤环境中酸酐菌门的Gp1含量增高,菌群结构发生改变,推测是人类活动使得仓更当地土壤重金属、农药有残留,导致Gp1含量升高;在XH菌塘中沙雷氏菌属(Serratia,65.23%)占比较高,可能因松林树种单一,土壤微生物多样性呈下降趋势,加之人为干扰等原因使得该松林中磷肥含量偏多,与解磷作用相关的沙雷氏菌属含量比较高[19]。此外,哈夫尼菌属(Hafnia)、Gp2、缓生根瘤菌属(Bradyrhizobium)、鞘氨醇单胞菌属(Sphingomonas)、芽单胞菌属(Gemmatimonadetes)、WPS-1 genera incertae sedis和WPS-2 genera incertae sedis在相应菌塘中丰度也较高。对4个菌塘中相对丰度前48个属的细菌进行热图-聚类分析,不同颜色代表丰度的高低,越红说明丰度越高,分析结果见图7。

图7 不同土壤样本属分类丰度热图Fig.7 Relative abundance heatmap of genus classification in different soil sample
由图7可知,从横向看,4个菌塘中丰度较高的是变形菌门和酸酐菌门,优势菌排前三的是伯克氏菌属、Gp1和沙雷氏菌属。从纵向看,XW菌塘细菌多样性较好,红色和浅红色贯穿在48个属中,其次是菌塘XQ和XC,XH菌塘因沙雷氏菌属的比例高导致菌群结构多样性简单。
3 结论
采用高通量测序技术对华丽牛肝菌4个菌塘细菌分析认为,4个菌塘中变形菌门、酸杆菌门是主要的细菌类群,在XW(乌沙)和XQ(新桥)菌群中,变形菌门的伯克氏菌属是优势菌;XC(仓更)菌群中,酸杆菌门的Gp1是优势菌;XH(海子)菌群中,变形菌门的沙雷氏菌属是优势菌。可见,各菌塘优势菌主要集中在固氮力较强和分解有机磷、钾的菌,且优势菌属集中在变形菌门、酸杆菌门、芽单胞菌门和硬壁菌门,同时WPS-1 genera incertae sedis和WPS-2 genera incertae sedis在菌塘中也占一定比值,表明牛肝菌生长的土壤环境主要由这些菌群组成,研究结果为华丽牛肝菌的人工驯化栽培提供了参考。
4个菌塘细菌丰度的差异与取样的环境、树种、土壤的特质和人类活动有关[20]。通过对华丽牛肝菌菌塘细菌类型的研究,发现人类活动多,例如施肥、打药的地方和人类活动少的地方相比,菌塘的菌群种类在多样性结构方面有较大差异。如XW和XQ菌塘都采自青冈林,人类活动干扰少,二者细菌组成和多样性相差不大;XC和XH菌塘分别采自板栗林和松林,二者的细菌组成和多样性都有差异,虽然这种微生物层面的变化对当地野生食用菌的产量和交易量影响较小,但对野生食用菌的品质如农药残留、重金属超标有一定影响[21],因此,注意保护当地生态环境,保护野生牛肝菌的种类和产量在未来是重要的任务。
