不同品种灵芝多糖得率及其体外抗氧化活性的差异研究*
2021-03-12张学新刘子宁王玉茜
张学新,刘子宁,王玉茜,杨 悦**
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.山东省高校食品加工技术与质量控制重点实验室,山东 泰安 271018)
灵芝 (Ganoderma lucidum),属于担子菌门(Basidiomycota)伞菌纲(Agaricomycetes)多孔菌目(Polyporales)灵芝菌科 (Ganodermataceae)灵芝属(Ganoderma)[1],是一种珍贵的药用真菌。中国是最早人工栽培和利用灵芝药用价值的国家,《神农本草经》中就有关于赤芝的记录,其性质温和,可以补中气,延缓衰老,对记忆力有改善效果,故又有“芝草、仙草”之称[2]。灵芝中含有很多对人体有益的生物活性成分及营养成分,如多糖[3]、三萜类化合物[4]、矿物质[5]、蛋白质、氨基酸[6]等,具有提高人体免疫力、抗氧化、保护修复消化系统、改善血液循环等作用[7]。目前很多行业已经开始研究和推出与灵芝有关的产品,如灵芝胶囊、灵芝茶和灵芝精华等。
多糖(polysaccharide)是一类由糖苷键连接单糖而成的天然高分子碳水化合物,在维持生物基础活动中起着重要作用,可以参与人体内的细胞代谢及生理调节过程。多糖在自然界中广泛存在,依据来源可分为动物多糖、植物多糖和真菌多糖[8]。不同生长区域的空气条件、土壤条件和光线等都会影响灵芝中多糖的含量[9]。泰山灵芝多糖得率最多可达1.58%,龙泉产粉灵芝多糖可达2.18%,佳木斯的云头状灵芝多糖最多为1.58%,广州灵芝多糖可达1.61%,韩国灵芝多糖最多可到1.91%,日本赤灵芝多糖可到1.34%[10]。多糖的生物活性主要取决于其特定的空间结构,包括一级结构和高级结构,其中高级结构对多糖功能的影响较大[11]。由于特殊的β-二股绳状螺旋型立体构型,多裂褶多糖有抑制肿瘤的作用,然而某些特别的物质如尿素,会改变多糖分子构型从而导致该作用受损或完全丧失[12]。除葡萄糖外,从灵芝中提取的多糖还有阿拉伯糖、半乳糖、甘露糖等[13]。作为灵芝中的主要生物活性成分,多糖有着抗肿瘤、免疫调节、抗辐射、抗氧化等多种重要作用[14-15]。
灵芝作为一种可食用真菌,已经进入我国药食同源原料目录,其重要的生物活性已经得到人们的关注和认可。灵芝多糖是灵芝中的重要活性组分,为了对其最大化的开发和利用,一些先进的物理技术已经应用于对其结构和生物活性功能的研究[16-18]。国内外灵芝品种繁多,不同品种灵芝子实体的外观形态以及多糖含量各不相同。通过测定12个不同品种灵芝多糖的含量及体外抗氧化能力,并对产量最高的灵芝粗多糖结构进行初步研究。
1 材料与方法
1.1 主要材料与试剂
12个灵芝品种,均来自山东省泰安市农科院食用菌研究所,分别为日本进口(1号)、泰山野生型(4号)、泰山野生型(8号)、泰山野生型(64号)、泰山野生型(76号)、韩芝(14号)、鹿角灵芝(18号)、泰山1号(20号)、紫芝(31号)、红芝(32号)、树舌(40号)、树舌(42号)。
无水乙醇、葡萄糖、铁氰化钾、磷酸氢二钠、三氯化铁,天津市凯通化学试剂有限公司;抗坏血酸(VC),天津市致远化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),上海华蓝化学科技有限公司;1,1-2,6-二叔丁基对甲酚(BHT),上海源叶生物有限公司;三氯乙酸、硫酸亚铁、正丁醇、氯仿、溴化钾,天津市巴斯夫化工有限公司。
1.2 试验仪器
FW-135中药粉碎机,天津市泰斯特仪器有限公司;DHG-9011A恒温干燥箱,海精宏实验设备有限公司;TCX-200S数控超声波清洗机,济宁天华超声电子仪器有限公司;HH-8数显恒温水浴锅,国华电器有限公司;UV-5500紫外可见分光光度计,上海元析仪器有限公司;TDL-5-A离心机,上海安亭科学仪器厂;NicoLet iS 10型红外光谱仪,美国Thermo Fisher Scientific公司。
1.3 试验设计与方法
1.3.1 灵芝粗多糖的提取与得率测定
利用超声波辅助水提法[19],将灵芝子实体放于烘箱中80℃烘至恒重,用中药粉碎机打碎,过80目筛得到灵芝粉末。称取1.5 g灵芝粉末放入烧杯中,以粉末和液体比1∶50加水;250 W、80℃超声波辅助提取40 min,将超声后的液体4 000 r·min-1离心5 min;取上清液,加95%乙醇溶液至乙醇体积分数为 75%,摇匀,4℃过夜。4 000 r·min-1离心 15 min,弃上清液,沉淀用去离子水溶解并转移至容量瓶中加水定容至100 mL。每个样品如此重复操作,得到不同品种的多糖样液,每个样品设3个重复。
采取苯酚-硫酸法[16]测定多糖得率,取6支试管,编号 1~6,分别加入 0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL 的 100 μg·mL-1葡萄糖标准溶液,后补充去离子水至2 mL,得到浓度分别为0、10 μg·mL-1、20 μg·mL-1、30 μg·mL-1、40 μg·mL-1、50 μg·mL-1的葡萄糖待测液;再分别加入1 mL 5%苯酚溶液,充分混合,沿内壁缓慢加入5 mL浓硫酸,快速充分摇匀,于室温条件下静置20 min后,测定各组溶液在490 nm处的吸光度值。根据浓度和所得数据绘制葡萄糖浓度-吸光度值标准曲线。每个浓度设3个重复。
准确吸取不同样品2 mL多糖溶液于各个试管中,重复上述试验步骤,测定混合液在490 nm波长处的吸光度值,依据不同样品溶液的吸光度值和绘制的标准曲线计算灵芝多糖得率。多糖得率(Y,%)计算公式为:
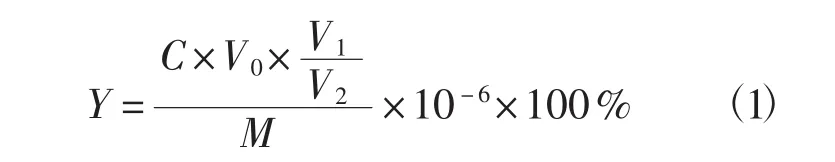
式中:C表示样本液多糖浓度(μg·mL-1);V0表示显色液总体积(mL);V1表示灵芝多糖样液的总体积(mL);V2表示显色步骤中添加的多糖样液的体积(mL);M表示称取的灵芝粉末的重量(1.5 g)。
1.3.2 灵芝粗多糖体外抗氧化活性的研究
取不同种类的多糖样液各2 mL,向其中加入2 mL的0.2 mmol·L-1DPPH溶液,充分摇匀,于室温下遮光放置15 min,4 000 r·min-1离心15 min。测定上清液在517 nm波长下的吸光度值[20]。以2,6-二叔丁基对甲酚(BHT)和抗坏血酸(VC)为阳性对照试验,重复上述步骤,测定吸光度值。每个样品设3个重复。DPPH自由基清除率(D,%)计算公式为:

式中:A0表示2 mL DPPH溶液+2 mL 95%乙醇的吸光值;Ai表示2 mL DPPH溶液+2 mL样品液的吸光值;Aj表示2 mL样品液+2 mL95%乙醇的吸光值。
精确量取1 mL多糖样液,向其中依次加入2.5 mL磷酸缓冲液和1.0 mL铁氰化钾溶液,充分混合后在50℃水浴锅中加热反应20 min,然后加入2.5 mL三氯乙酸溶液,混匀后放入离心机,2 000 r·min-1离心10 min。取2.5 mL上清液,向其中加入0.5 mL三氯化铁溶液和2.5 mL去离子水,充分混匀,在室温条件下静置10 min,测定混合液在700 nm波长时的吸光度值[21]。以VC为阳性对照,重复上述试验步骤并测定吸光度值。每个样品设3个重复。
1.3.3 灵芝粗多糖的分离纯化与理化分析
采用sevag法[22]除蛋白,在样液中加入约为其体积1/3的sevag试剂,震荡20 min后静置,4 000 r·min-1离心5 min,取上层液体并去除交界处白色的变性蛋白质。为完全去除蛋白质,需要多次重复操作,直到离心后溶液交界处不再有白色沉淀出现。每个样品设3个重复。
在脱蛋白多糖溶液中加入1.5%活性炭,进行脱色处理[23];在水浴锅中58℃加热30 min,不断搅拌,抽滤,向滤液中加入80%乙醇静置12 h;离心,去除活性炭,将剩余沉淀用无水乙醇进行多次洗涤,放入烘箱内干燥即得到精制多糖。每个样品设3个重复。
取1 mg精制多糖,与100 mg溴化钾混合,在玛瑙研钵中研磨10 min,在红外光谱仪中进行压片分析。测量红外光谱范围为400 cm-1~4 000 cm-1。测定前先不加样品,建立溴化钾背景基线扫描。每个样品设3个重复。
2 结果与讨论
2.1 不同品种灵芝粗多糖得率的测定
2.1.1 葡萄糖标准曲线
试验所得葡萄糖标准曲线见图1。
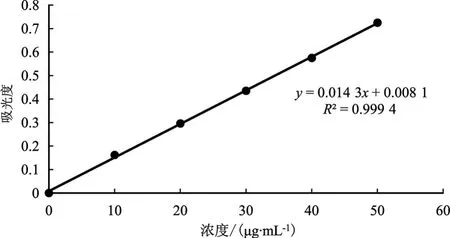
图1 葡萄糖标准曲线Fig.1 Glucose standard curve
由图1可知,线性回归方程:y=0.014 3x+0.008 1,R2=0.999 4,表明在 0~50 μg·mL-1的线性范围内葡萄糖浓度与吸光度有良好的线性关系。
2.1.2 多糖得率
多糖在浓硫酸作用下水解生成单糖,迅速脱水生成糠醛衍生物,与苯酚缩合成棕黄色化合物[16]。多糖浓度及得率得率见图2,不同品种灵芝的吸光度见表1。

图2 不同灵芝品种的多糖得率Fig.2 Polysaccharide yield of different Ganoderma lucidum species
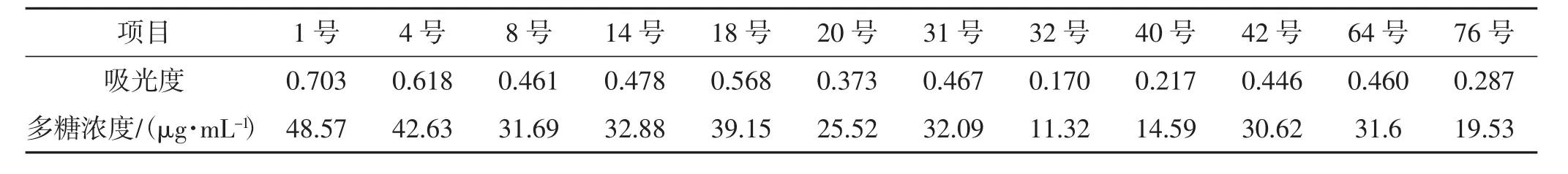
表1 不同品种灵芝的多糖吸光值Tab.1 Absorbance values of different Ganoderma lucidum species
由图2及表1可知,不同品种的灵芝多糖得率不同且差距较大,但试验中所测定的12种不同品种的灵芝多糖得率均在0.6%~2.6%。得率最高的是日本进口样品(1号)为2.590%,鹿角灵芝样品(18号)的多糖得率为2.090%;多糖得率最少的32号样品为0.604%,为1号样品多糖得率的约1/4。
2.2 不同品种灵芝粗多糖抗氧化活性
2.2.1 DPPH 自由基清除率测定
DPPH自由基的清除率可评估其抗氧化性强度[24],不同品种灵芝的DPPH清除率见图3。
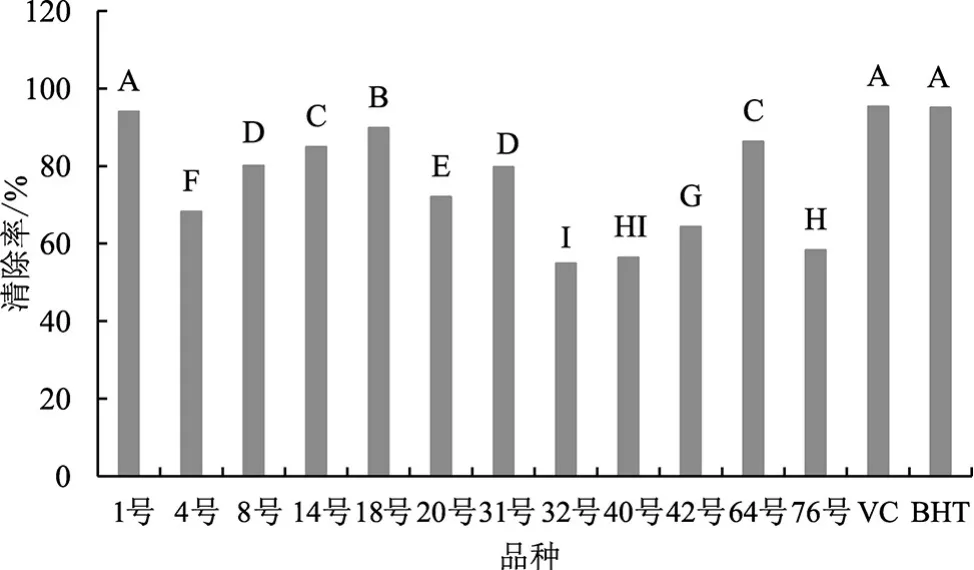
图3 不同品种灵芝的DPPH清除率Fig.3 DPPH radical scavenging rate of different Ganoderma lucidum species
由图3可知,阳性对照组VC在5 mg·mL-1时的清除率为95.3%、甲酚(BHT)在5 mg·mL-1时的清除率为95.0%。不同品种灵芝多糖的DPPH清除率也有所不同,12种灵芝多糖样品清除率在54%~95%。其中,清除率最高的是日本进口样品(1号),为95.0%,鹿角灵芝样品(18号)其次,清除率为89.4%,可推断2种样品有较好的抗氧化能力;红芝样品(32号)清除率最低,为54.9%。
2.2.2 还原能力测定
抗氧化物可以通过提供电子阻碍Fe3+和铁氰复合物形成亚铁离子的形式,从而实现还原能力[25],通过不同多糖样液反应后的吸光度值表示其还原能力,即其抗氧化能力,其还原能力数据统计见图4。
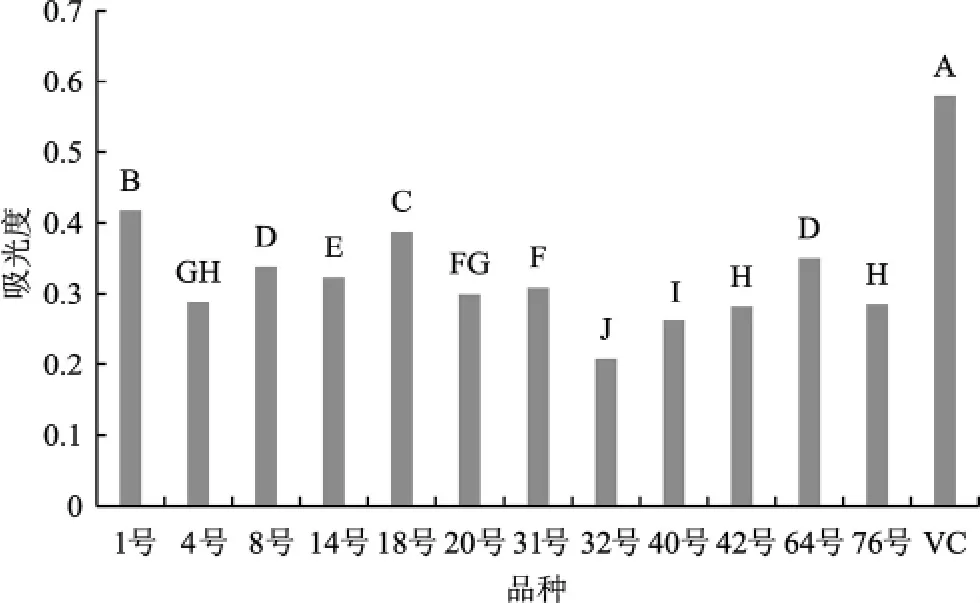
图4 不同品种灵芝的还原能力Fig.4 Reducing power of different Ganoderma lucidum species
由图4可知,灵芝多糖具有一定还原能力,日本进口样品(1号)的还原能力最高,为0.417,其次为鹿角灵芝样品(18号)还原能力为0.387;红芝样品(32号)的还原能力最低,为0.207。
2.3 结构解析
基于以上试验结果,选择多糖得率最高的1号样品,经分离纯化后在波长400 cm-1~4 000 cm-1对其进行红外光谱分析,其红外光谱见图5。
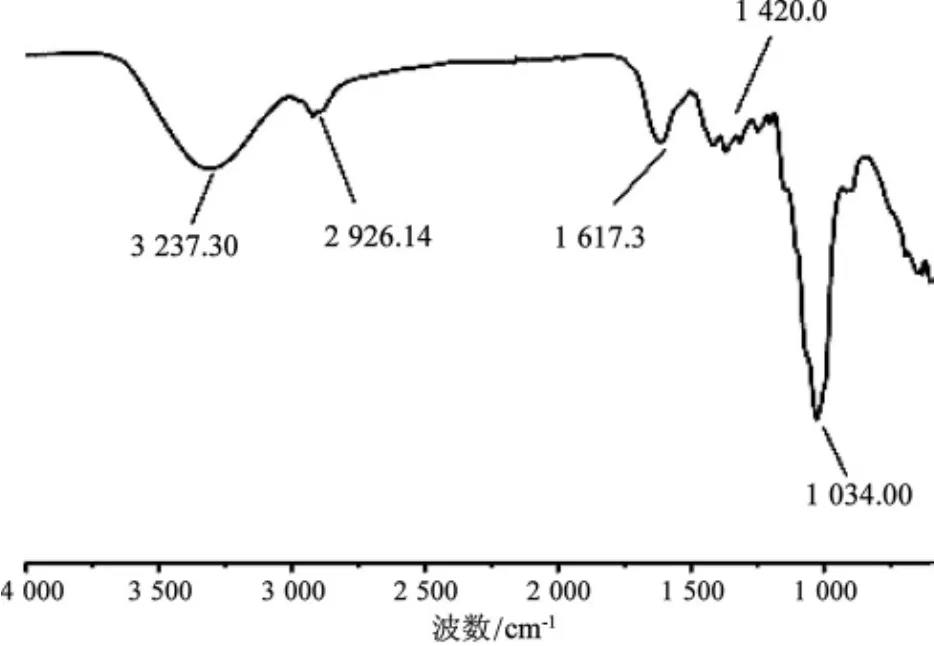
图5 1号样品灵芝多糖的红外光谱Fig.5 IR spetra of NO.1 Ganoderma lucidum polysaccharide
由图5可知日本进口样品(1号)多糖的红外吸收光谱在 3 237.30 cm-1、2 926.14 cm-1、1 617.34 cm-1、1 420.29 cm-1、1 074 cm-1等多处有明显的多糖特征谱带。O-H键的伸缩振动导致3 237.30 cm-1附近出现吸收峰;2 926 cm-1附近的吸收峰是由于C-H键的伸缩振动;1 617.34 cm-1附近的吸收峰是由结合水引起的;C-O键的伸缩振动引起1 420 cm-1附近的吸收峰,而出现在1 034 cm-1附近的吸收峰是吡喃环非对称环伸缩振动引起的,这些都是糖类的特征键[26]。
3 结论
通过超声辅助水提法提取灵芝多糖并测定其得率,对其进行体外抗氧化能力的测定,对日本进口(1号)灵芝粗多糖进行分离纯化,对结构表征进行初步研究。结果显示,所测不同品种的灵芝多糖得率不同,日本进口样品(1号)得率最高,为2.59%;红芝样品(32号)的多糖得率最低,为0.604%。不同品种灵芝多糖的抗氧化效果也不同,其中日本进口(1号)多糖样品的抗氧化性最强,DPPH自由基清除率为94%,还原力为0.417,其次为鹿角灵芝(18号)样品,其DPPH自由基清除率为89.4%,还原力为0.387;32号多糖样品的抗氧化性最弱,清除率为0.549%,还原力为0.207。将多糖得率最高的1号样品的灵芝粗多糖进行分离纯化,所得的精制多糖经红外光谱分析,得出多糖的结构,该多糖具有C-H键、C-O键、-OH等多种典型的多糖特征键。
灵芝多糖具有抗氧化、免疫调节、抗肿瘤等药理作用,可应用于食品和医疗保健行业。对不同品种灵芝多糖得率的测定及其体外抗氧化活性的差异进行研究,对于灵芝多糖的利用以及提取灵芝多糖时对不同品种灵芝的选择提供了技术支持。未来可继续对不同品种灵芝的组成结构进行深入研究,以建立更为详尽的评价体系,为灵芝多糖的利用提供理论依据。
