支气管哮喘患者外周血肝X受体、Periostin及蛋白磷酸酶1A表达与气道重塑的关系
2021-03-12许欣婷张瑶李娜陈丽展
许欣婷 张瑶 李娜 陈丽展
药物治疗能有效缓解支气管哮喘气道炎症,但并不能阻止气道重塑的发展,同时气道重塑将诱导不可逆性气流阻塞和重症哮喘。目前关于气道重塑的病理机制尚不明确。肝X受体(LXRs)是Ⅱ型核受体,包括LXRα、LXRβ两个亚型。研究发现,LXRs能通过抑制转化生长因子β(TGF-β)与其受体结合进而干扰气道重塑[1]。Periostin是一种细胞外基质蛋白,其血清含量能有效反映上皮下纤维化程度,在提示气道重塑中具有较好的应用效果[2]。蛋白磷酸酶1A(PPM1A)在抑制气道重塑重要机制TGF-β/Smad信号通路中具有一定作用[3]。目前,尚无评估气道重塑程度的“金标准”,本研究借助高分辨CT测量气道内径(L)、气道外径(D)、气道腔面积(Ai)、气道总面积(Ao)等参数,计算反映气道重塑的指标气道壁面积占气道总横截面面积的百分比(WA%)及气道壁厚度(T)/D,以此作为气道重塑的依据,研究外周血以上指标浓度在反映气道重塑程度中的作用。
对象与方法
1.对象:2018年12月~2019年12月我院收治的102例支气管哮喘患者为哮喘组,其中男62例,女40例,年龄33~75岁,平均年龄(42.36±10.25)岁。纳入标准:(1)符合中华医学会呼吸病分会哮喘学组[4]及全球哮喘防治创议[5]中哮喘相关诊断标准;(2)哮喘病史≥3年,病情处于稳定期。排除标准:(1)就诊前4周使用过激素类药物;(2)存在咯血、气胸、肺大疱等临床症状;(3)合并其他过敏性疾病;(4)急性感染。同期纳入40例健康志愿者作为对照组,均无感染性疾病、心血管疾病、自身免疫性疾病及支气管哮喘等疾病,其中男22例,女18例,年龄35~75岁,平均年龄(43.71±10.65)岁。两组患者性别、年龄比较差异均无统计学意义(P>0.05),具有可比性。本研究通过我院伦理委员会审核通过,所有受试者均知情同意。
2.方法
(1)高分辨率(HR)CT检查:所有受试者均接受胸部HRCT扫描。采用西门子公司HRCT机于主动脉弓层面上下各3层面扫描,扫描电压120 MV、矩阵512×512,骨算法重建。行深呼吸末屏气相、深呼气末屏气相扫描,每个气道的每项指标需进行2次测量,取平均值。测量指标包括气道内径(L)、气道外径(D)、气道腔面积(Ai)、气道总面积(Ao),计算T/D及WA%。气道壁厚度(T,mm)=[D(mm)-L(mm)]/2,气道壁面积(WA,mm2)=Ao(mm2)-Ai(mm2),气道壁面积占气道总横截面面积的百分比(WA%,%)=WA(mm2)/Ao(mm2)×100%。
(2)外周血LXRs、Periostin及PPM1A水平检测:采集所有受试者外周静脉血5 ml,以3 000 r/min离心15 min分离血清。采用酶联免疫吸附试验检测血清LXRα、LXRβ、Periostin及PPM1A水平,试剂盒均购自英国Abcam公司。
(3)电子气管镜检查:哮喘组15例患者及健康组7例受试者行电子气管镜检查,检查前均给予盐酸利多卡因雾化吸入局部麻醉,于被检查者右肺上叶及右肺中叶支气管开口处钳取4块标本,甲醛固定,石蜡包埋,行苏木素-伊红(HE)染色,观察黏膜下基底膜形态,计算黏膜下基底膜厚度。
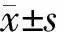
结 果
1.两组受试者气道重塑情况比较:哮喘组患者T/D及WA%均明显高于对照组(P<0.05),见表1。

表1 两组受试者气道重塑情况比较
2.两组受试者LXRα、LXRβ、Periostin及PPM1A水平比较:哮喘组患者血清LXRα、LXRβ、Periostin水平均明显高于对照组(P<0.05),PPM1A水平明显低于对照组(P<0.05),见表2。
表2 两组受试者LXRα、LXRβ、Periostin及PPM1A水平比较
3.两组受试者黏膜下基底膜厚度比较:哮喘患者肺组织HE染色结果提示,患者气道纤毛倒伏、上皮细胞破损,上皮下基底膜较对照组明显增厚。哮喘组患者黏膜下基底膜厚度明显高于健康者[(7.74±1.36)mm比(3.14±0.53)mm,P<0.05]。
4.血清LXRα、LXRβ、Periostin及PPM1A水平与T/D、WA%及黏膜下基底膜厚度的关系:Pearson相关分析结果提示,哮喘患者血清Periostin与T/D、WA%及黏膜下基底膜厚度均呈正相关(P<0.05),血清PPM1A与T/D、WA%及黏膜下基底膜厚度均呈负相关(P<0.05)。见表3。
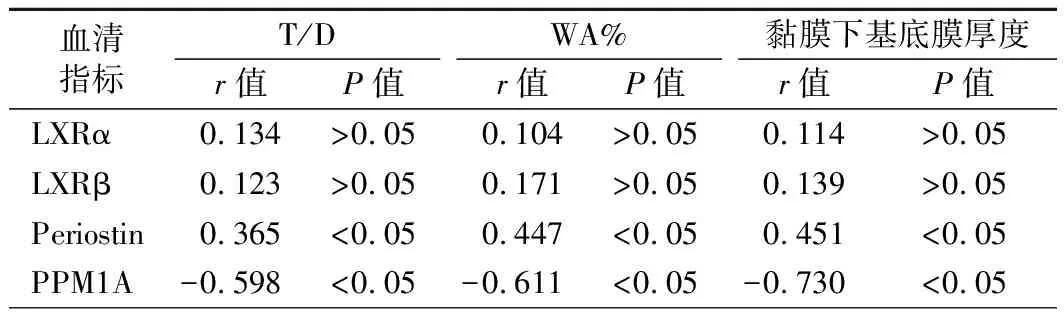
表3 血清LXRα、LXRβ、Periostin及PPM1A水平与T/D、WA%及黏膜下基底膜厚度的相关分析
讨 论
长期慢性气道炎症及慢性气道炎症的反复性修复将造成气道重塑。气道重塑可能造成气道的相对不可逆损伤,降低支气管哮喘治疗效果,并可反映疾病严重程度。但气道重塑的作用机制尚不明确[6]。气道黏膜下基底膜增厚是气道重塑的特征性表现,行黏膜组织病理学检查是检测黏膜下基底膜厚度的“金标准”,但病理检查属于有创检查,本文中仅有15例哮喘患者及7例健康受试者行黏膜组织病理检查。结果提示,15例哮喘患者黏膜下平均基底膜厚度明显大于健康者,且可见气道纤毛倒伏、上皮细胞破损现象。
HRCT采用骨算法进行图像重建,能识别直径为2.0~5.0 mm的小气道,显示100~200 μm的小结构组织。吴晓虞等[7]发现HRCT能有效评估哮喘患者的病情及气道重塑程度。本文应用HRCT测量患者气道L、D、Ai、Ao等参数,计算T、WA,并采用WA%及T/D作为反映气道重塑的指标,发现122例哮喘患者WA%及T/D水平均明显高于对照组。气道重塑将造成黏液分泌增多、上皮下纤维化、平滑肌增生等多种特征性结构改变[8],该过程的具体作用机制尚不明确,但有研究结果表明气道炎症、上皮细胞损伤、细胞外基质修复失衡、炎性介质等多种因素在气道重塑中发挥作用[9]。
LXRs在胆固醇代谢、先天性免疫、细胞炎症信号调节等生理过程中发挥作用,可抑制TGF-β与其受体相结合。而TGF-β与其受体相结合后,可诱导结缔组织生长因子表达、介导纤连蛋白与胶原沉积形成、影响气道上皮细胞修复,进而促进并加重气道重塑[10]。有研究推论LXRs可能抑制气道重塑,但LXRs在支气管哮喘患者外周血中表达的相关研究较少。本研究发现哮喘患者血清LXRα、LXRβ水平远高于对照组,提示哮喘患者存在气道重塑,后行相关分析结果提示血清LXRα及LXRβ水平与气道重塑指标T/D、WA%及黏膜下基底膜厚度均无明显相关性,这与郑琳等[11]研究结果相似。
Periostin是一种细胞外基质蛋白,其外周血表达量与网状细胞层厚度相关,能反映上皮下纤维化程度[12]。段圆方等[13]研究结果发现,哮喘患者血清Periostin及白细胞介素(IL)-13表达量增加,并与气道重塑相关指标呈明显正相关,与第1秒用力呼气容积占预计值百分比(FEV1%pred)、第1秒用力肺活量占用力肺活量百分比(FEV1/FVC%)呈负相关,提出Periostin可能通过与IL-13间的相互作用参与气道重塑。本研究行Pearson相关分析结果提示,Periostin水平与哮喘患者WA%、T/D水平及黏膜下基底膜厚度呈正相关,提示Periotin参与支气管哮喘气道重塑。
TGF-β/Smad信号通路是支气管哮喘气道重塑的重要机制,而PPM1A是调节TGF-β/Smad信号通路的重要蛋白,PPM1A能有效抑制TGF-β引起的增殖转录,终止TGF-β/Smad信号通路,故PPM1A水平也能在一定程度上反映气道重塑[14-15]。本研究结果发现,与对照组比较,哮喘组患者血清PPM1A水平明显下降,提示哮喘患者体内TGF-β/Smad信号通路被抑制的程度低,存在气道重塑,且随着哮喘病情的加重,患者血清PPM1A水平呈下降趋势。Pearson相关分析结果发现,血清PPM1A与气道重塑相关指标WA%、T/D及黏膜下基底膜厚度呈明显负相关。
综上所述,哮喘患者血清LXRα、LXRβ、Periostin水平异常升高,PPM1A水平异常下降,Periostin与气道重塑程度呈正相关,PPM1A与气道重塑程度呈负相关,但LXRα、LXRβ与气道重塑程度无明显相关性。但本研究未能对血清指标在气道重塑中的具体作用机制进行研究,存在一定的局限性,还需要大样本的前瞻性随机对照研究进一步探讨。
