补阳还五汤对动脉粥样硬化大鼠血管平滑肌细胞NF-κB p65 mRNA 及NF-κB p65 蛋白表达量的影响
2021-03-11郭春兰钟秉知刘建春姜维佳宋丽娟张红珍
郭春兰,钟秉知,刘建春,王 青,姜维佳,宋丽娟,张红珍,3
(1.山西中医药大学第四临床学院,山西 晋中030619;2.西北农林科技大学,陕西 咸阳712100;3.山西中医药大学生物学研究中心,国家中医药管理局多发性硬化益气活血重点研究室,山西 晋中 030619)
随着生活水平的不断提高,动脉粥样硬化(atherosclerosis,AS)在我国也逐渐成为死亡的重要因素,严重危害人类健康。血管内皮细胞激活与损伤、内膜下脂质的沉积与泡沫细胞的形成、血管平滑肌细胞(vascular smooth muscle cell,VSMC)的增殖和迁移是AS 形成的主要环节[1-2]。中医学没有动脉硬化的记载,根据相似症候群的描述,认为气虚、血瘀、痰凝为发病的主要病机,本虚标实是AS 的基本特征,气虚血瘀证为AS 辨证论治常见证型,益气活血能明显改善临床症状[3-4]。研究报道,核转录因子-κB(nuclear factor-kappaB,NF-κB)影响动脉粥样硬化的形成及进展,参与多种细胞因子及平滑肌的增殖[5]。本研究观察补阳还五汤含药血清对动脉粥样硬化模型大鼠主动脉组织NF-κB p65mRNA 的表达量以及NF-κB p65 蛋白表达量的影响,进一步探讨NF-κB p65 在AS 的形成过程发挥的作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 健康SPF 级雄性SD 大鼠60只,7 周龄,体质量(200±20)g,由北京维通利华实验动物技术有限公司提供,动物质量合格证号SCXK(京)2016-0011。饲养环境:温度为20~23 ℃,湿度60%,环境安静,通风良好。所涉及实验动物研究的有关材料以及临床取材,经山西中医药大学医学伦理委员会审查,符合医学伦理学要求。
1.1.2 药物与试剂 实验药物:棉芪30 g,川芎6 g,当归6 g,桃仁3 g,赤芍6 g,环毛蚓3 g,红花3 g。按以上比例配置浓缩,调至含药量2 g/mL,分装灭菌,100 mL/瓶。放置4 ℃冰箱保存备用。
主要试剂:Trizol 提取试剂盒、cDNA 合成试剂盒(批号SK2445)、定量PCR 试剂:SG Fast qPCR Master Mix(High Rox)(2X)(BBI),由上海生工生物工程股份有限公司提供。ROCK 激酶(Sigma,批号R1281),血管紧张素II(Sigma,批号A9525),Y27632 抑制剂(Sigma,批号Y0503)。大鼠血管平滑肌细胞株A10(ATCC,批号CRL1476)。
1.2 实验方法
1.2.1 AS 模型制作 参照经典的动脉粥样硬化造模方法[6],将30 只造模大鼠按60 万U/kg 的剂量一次性给予维生素D3 腹腔注射,随后每天喂服高脂饲料(81.3%基础饲料、10%猪油、5%白糖、3%胆固醇、0.2%丙基硫氧嘧啶、0.5%胆酸钠),连续喂服45 d,随机抽取4 只大鼠检测主动脉结构,符合动脉粥样硬化特征。
1.2.2 含药血清制备 根据体表面积法计算大鼠相当于成人的临床等效剂量,以此剂量作为补阳还五汤低剂量对照组的灌胃剂量[10 g/(kg·d)],并按此比例设定补阳还五汤高剂量对照组的灌胃剂量[20 g/(kg·d)]。取正常SD 大鼠30 只,随机分为正常对照组(A 组)10 只、补阳还五汤低剂量对照组(B 组)10 只、补阳还五汤高剂量对照组(C 组)10只。另取AS 模型大鼠30 只,随机均分为AS 模型组(D 组)10 只、补阳还五汤低剂量治疗组(E组)10 只、补阳还五汤高剂量治疗组(F 组)10 只。A组、D 组每日给予等体积生理盐水灌胃,连续灌胃10 d。第10 天(药物血清已稳定,达到平台期)禁食不禁水2 h 后,无菌条件下腹主动脉取血,静置、离心、取血清,同组混匀,56 ℃,30 min 灭活,过滤除菌后,分装,-20 ℃保存备用。临用前将血清用DMEM-F12 培养基均配成10%(为前期实验得出的最适浓度)的药物血清溶液,过滤除菌后分装,4 ℃保存备用,作为相对应的含药血清。
1.2.3 实验分组 取生长状态良好的第10 代血管平滑肌细胞,用0.25%胰蛋白酶溶液消化,并制备细胞悬液,以每孔3×103个细胞的密度接种于96 孔板中,放置于37 ℃,5% CO2培养箱中培养。24 h 后,将培养基换成对应的含药血清(A、B、C、D、E、F 共6 种血清),每种血清随机分为4 组,空白对照组:加入含10%胎牛血清的DMEM-F12 培养液;阳性对照组:加入Rho 激酶(1×10-10mol/L)的DMEM-F12 培养液;ROCK 激动剂组:加入AngII(Rho 激酶激动剂,1×10-9mol/L)的DMEM-F12 培养液;ROCK 抑制剂组:加入Y-27632(Rho 激酶抑制剂,1×10-6mol/L)的DMEM-F12 培养液。放置37 ℃,5% CO2培养箱中培养48 h。
1.2.4 平滑肌细胞NF-κB p65 mRNA 的检测 称取大鼠主动脉组织标本50 mg,按Trizol 试剂盒说明操作,测定RNA 的质量和RNA 的完整性,调节标本总RNA 浓度至50 mg/L,-70 ℃冰箱中保存样本RNA。按照试剂说明书进行RNA 逆转录及PCR 反应,反应结束后获取循环阈值(Ct 值),采用Excel 软件绘制标准曲线,进行实验数据分析。
1.2.5 平滑肌细胞NF-κB p65 蛋白表达的测定采用Western Blot 方法进行测定。
1.3 统计学方法
2 结 果
2.1 NF-κB p65mRNA 在血管平滑肌细胞中的表达
各AS 模型组含药血清作用后NF-κB p65 mRNA的表达水平明显高于正常对照组(P<0.001,P<0.01)。与AS 模型组相比,ROCK 激动剂组、空白对照组的补阳还五汤低剂量治疗组含药血清作用后NFκB p65mRNA 表达水平明显降低(P<0.001);阳性对照组的补阳还五汤低剂量治疗组含药血清作用后NF-κB p65mRNA 的表达水平降低(P<0.05);阳性对照组、ROCK 激动剂组的补阳还五汤高剂量治疗组含药血清作用后NF-κB p65mRNA 的表达水平明显降低(P<0.001);空白对照组、ROCK抑制剂组的补阳还五汤高剂量治疗组含药血清作用后NF-κB p65mRNA 的表达水平降低(P<0.05)。结果见图1。

图1 不同含药血清对血管平滑肌细胞NF-κB p65mRNA 表达的影响
2.2 不同干预组NF-κB p65 蛋白的表达
2.2.1 阳性对照组血管平滑肌细胞NF-κB p65 蛋白的表达 与正常对照组相比,AS 模型组含药血清作用后NF-κB p65 蛋白表达水平升高(P<0.05);补阳还五汤高剂量对照组含药血清作用后NF-κB p65 蛋白表达水平降低(P<0.05)。与AS 模型组相比,补阳还五汤低剂量、高剂量治疗组含药血清作用后NF-κB p65 蛋白表达水平降低(P<0.05)。结果见图2。

图2 阳性对照组血管平滑肌细胞NF-κB p65蛋白表达的Western Blot 检测结果
2.2.2 ROCK 激动剂组血管平滑肌细胞NF-κB p65 蛋白的表达 与正常对照组相比,AS 模型组含药血清作用后NF-κB p65 蛋白表达水平升高(P<0.05)。与AS 模型组相比,补阳还五汤高剂量治疗组含药血清作用后NF-κB p65 蛋白表达水平明显降低(P<0.01)。结果见图3。

图3 ROCK 激动剂组血管平滑肌细胞NF-κB p65 蛋白表达的Western Blot 检测结果
2.2.3 空白对照组血管平滑肌细胞NF-κB p65蛋白的表达 与正常对照组相比,AS 模型组含药血清作用后NF-κB p65 蛋白表达水平显著升高(P<0.001);补阳还五汤低剂量、高剂量对照组含药血清作用后NF-κB p65 蛋白表达水平明显降低(P<0.001)。与AS 模型组相比,补阳还五汤低剂量、高剂量治疗组含药血清作用后NF-κB p65 蛋白表达水平明显降低(P<0.001)。结果见图4。
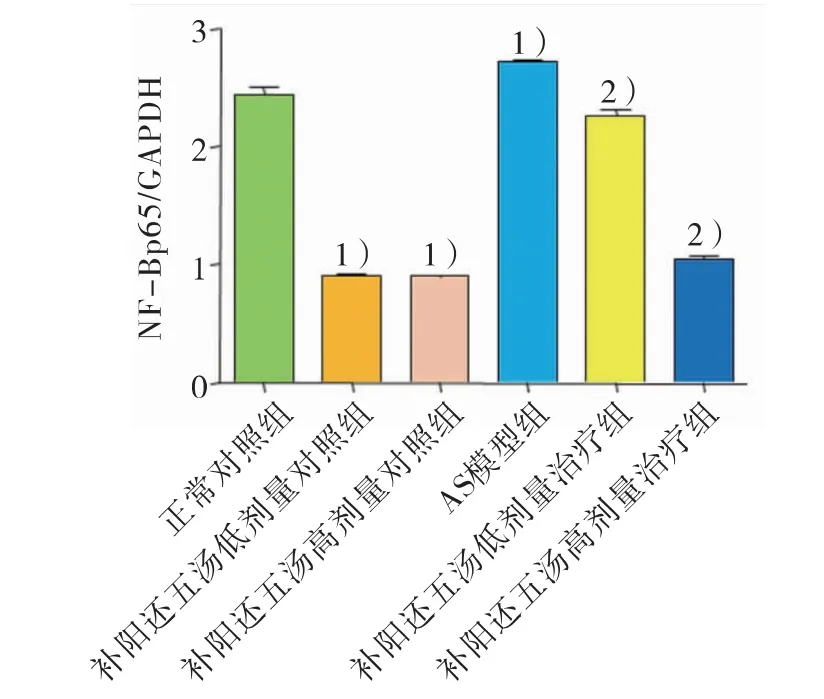
图4 空白对照组血管平滑肌细胞NF-κB p65 蛋白表达的Western Blot 检测结果
2.2.4 ROCK 抑制剂组血管平滑肌细胞NF-κB p65 蛋白的表达
与正常对照组相比,AS 模型组含药血清作用后NF-κB p65 蛋白表达水平显著升高(P<0.01)。与AS 模型组比较,补阳还五汤高、低剂量治疗组含药血清作用后NF-κB p65 蛋白表达水平明显降低(P<0.01)。结果见图5。
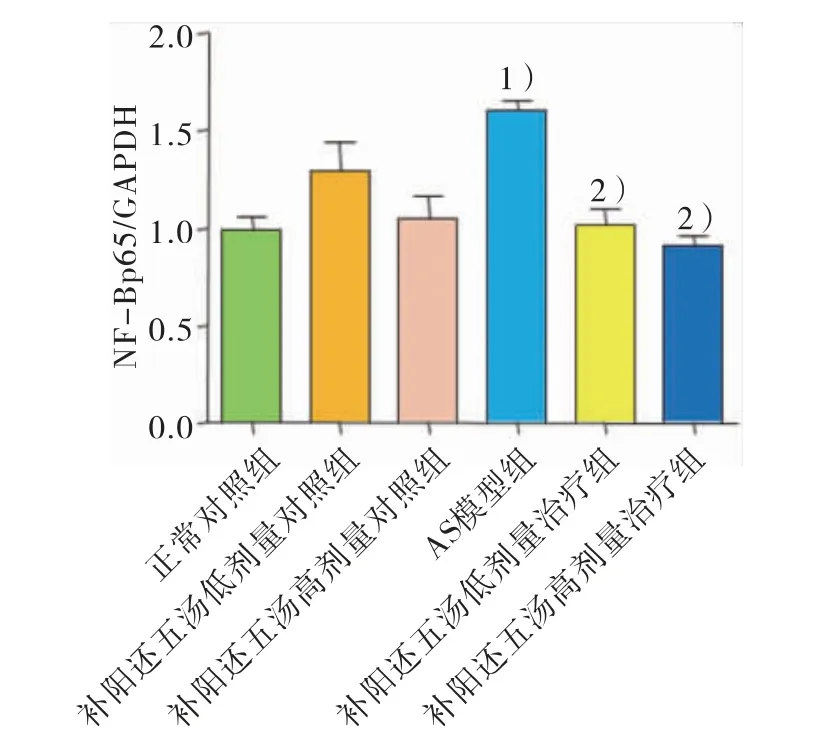
图5 ROCK 抑制剂组血管平滑肌细胞NF-κB p65 蛋白表达的Western Blot 检测结果
3 讨论
AS 的形成是一个复杂的病理变化过程,主要包括血管内皮细胞(endothelial cell,ECs)受损,细胞黏着分子(cell adhesion molecule,CAM)异常表达,白细胞黏附及迁移,平滑肌细胞(smooth muscle cell,SMC)增殖和迁移,泡沫细胞形成,纤维组织增生等病理过程,形成粥样斑块[7-8]。
大量研究显示,Rho 激酶参与机体多种生物过程,包括对内皮细胞通透性和迁移的增加,对血管平滑肌细胞的增殖和迁移,与AS 的发生发展密切相关[9-10]。
NF-κB 是参与免疫应答、炎症反应以及细胞的增生、转化和凋亡等病理生理过程,具有多向转录调节作用的蛋白质,同时参与多种基因的转录调控作用。研究报道NF-κB 在AS 形成中发挥着重要的作用,参与泡沫细胞形成、血管平滑肌细胞(VSMC)增殖、血管炎症、动脉钙化和斑块进展等多种病理过程[5]。活化的NF-κB 存在于AS 病灶的内皮细胞、平滑肌细胞、巨噬细胞等多种细胞中,对促炎细胞因子、生长因子、黏附分子、趋化因子等基因的表达可以起到调节编码的作用。
前期研究表明,补阳还五汤对主动脉的超微损伤有明显的治疗和预防作用[11-12]。本研究在前期研究的基础上将不同浓度的补阳还五汤给SD正常大鼠及AS 模型大鼠灌胃,制备含药血清,将体外培养的血管平滑肌细胞用不同浓度的含药血清保护后,分别加入Rho 激酶抑制剂、Rho 激酶激动剂、Rho 激酶,通过PCR 法检测各组含药血清对血管平滑肌细胞NF-κB p65 mRNA 含量的影响,通过Western Blot 法检测各组含药血清对血管平滑肌细胞NF-κB p65 蛋白表达的影响,结果显示各组补阳还五汤高剂量治疗组NF-κB p65 mRNA 含量、NF-κB p65 蛋白的表达均低于AS模型组,表明补阳还五汤具有调节血管平滑肌细胞增殖和迁移的作用,对血管平滑肌细胞能够起到保护作用,从而抑制AS 病变的形成和进展,防治动脉粥样硬化。这一过程可能与其下调NF-κB p65mRNA、NF-κB p65 蛋白的表达有关。当然,动脉硬化是一个多因素影响的病理结果,对NF-κB p65mRNA、NF-κB p65 蛋白表达的下调可能是补阳还五汤抗AS 作用机制之一,为中医药全面认识动脉粥样硬化提供了依据,进而为临床上防治动脉粥样硬化提供新的思路。
