RYBP通过激活PARP-1 诱导Parthanatos增加食管鳞癌细胞对YM155的敏感性
2021-03-11李宇星师小博刘笑笑王玉琛阮琴利潘纪元杨晓平
柯 悦,李宇星,师小博,郭 伟,刘笑笑,王玉琛,阮琴利,潘纪元,杨晓平
(西安交通大学第二附属医院:1. 肿瘤放疗科;2. 胸外科,陕西西安 710004)
食管癌是常见的消化道恶性肿瘤,其发病率及死亡率分别位列全球恶性肿瘤的第7位和第6位。食管癌发病率具有明显的地理分布差异,且两种主要病理类型——鳞状细胞癌和腺癌的病因完全不同。在许多低收入国家,如亚洲和撒哈拉以南的非洲地区,鳞状细胞癌占食管癌总数的90%以上[1]。渐进性吞咽困难是食管癌最主要的临床表现,由于缺乏特异的症状和体征,许多患者在确诊时已处于中晚期。对于不可手术切除的局部晚期食管癌,根治性同步放化疗是其标准的治疗方案。尽管如此,食管癌的5年总生存率为15%~25%[2]。因此,在传统放化疗的基础上,寻找更有效的抗肿瘤药物和潜在的分子靶点在食管癌未来的治疗中十分关键。
RYBP(RING1 and YY1-binding protein)是多梳蛋白(Polycomb Group, PcG)家族成员之一,是一类在染色质水平抑制靶基因转录的蛋白,在促进凋亡、个体发育、细胞增殖、肿瘤发生发展及调节免疫等过程中发挥重要作用[3]。RYBP能与Fas相关死亡结构域蛋白(fas-associated protein with death domain, FADD),半胱氨酸天冬氨酸蛋白酶(caspase)8,Caspase-10相互作用促进细胞死亡[4],并与人类3型纤维连接蛋白和1型锚蛋白重复结构域蛋白(fibronectin type3 and ankyrin repeat domains protein1, FANK1)和凋亡素基因(apoptin)相互作用从而特异性诱导肿瘤相关凋亡[5-6]。本课题组前期研究发现,RYBP能通过下调G1-S期相关基因表达水平,从而抑制食管鳞癌增殖能力[7]。此外,对原发性肝癌、非小细胞肺癌的研究发现,RYBP能通过调节BCL2-Associated X的蛋白质(Bax),多聚ADP核糖聚合酶-1[poly(ADP-ribose)polymerase-1, PARP-1],Caspase 8等诱导细胞凋亡并增加化疗药物的敏感性[8-9]。
YM155是存活素(survivin)的一种小分子转录抑制剂。在多种恶性肿瘤,如成人T细胞白血病、卵巢癌、肾癌中,YM155单用或联合使用能抑制肿瘤生长,诱导凋亡,增加抵抗细胞的敏感性,并延长荷瘤裸鼠的生存[10-12]。研究显示,YM155能通过激活PARP-1,进而催化合成多聚ADP核糖[Poly-(ADP)ribose, PAR],线粒体通透性改变,以及早期凋亡诱导因子(apoptosis-inducing factor, AIF)核浆转位导致Parthanatos,从而抑制食管鳞癌细胞及荷瘤裸鼠移植瘤生长[13]。Parthanatos是一种依赖于PARP-1激活导致的细胞死亡,由Harraz命名(Thanatos:希腊神话中的死亡之神),是一种新的细胞死亡形式,主要发生在中风、心力衰竭、糖尿病、帕金森病及缺血再灌注等疾病[14-15]。既往研究显示,RYBP过表达在原发性肝癌、肺癌中可致PARP-1激活从而诱导细胞凋亡[8-9]。而在食管癌中,RYBP过表达能否激活PARP-1,能否导致细胞通过Parthanatos途径死亡从而增加食管鳞癌对YM155的敏感性是本研究探索的关键问题。
1 材料与方法
1.1 细胞系及培养食管鳞癌细胞系KYSE170是由中国医学科学院肿瘤医院赵晓航教授课题组提供。细胞培养于含100 mL/L胎牛血清的1640培养基,放置在37 ℃,50 mL/L CO2培养箱内。
1.2 质粒转染及过表达细胞系建立①将KYSE170细胞种在6孔板上,培养至90%左右;②根据RYBP及pCMV6质粒(Origene,美国)浓度分别计算出所需加入质粒体积(1 μg);③配制转染试剂:取10个1.5 mL管,分别加入150 μL Opi MEM,每2个管为一组,分别加入等体积的lipofectamine 2000(Invitrogen,美国)及质粒标记为A、B,常温下放置5 min;④将每组中的A、B管混合,室温放置40 min。用PBS清洗培养基2遍后,每孔加入700 μL Opti MEM,将混合溶液分别加入培养基中;⑤6 h后,加入200 mL/L FBS的1640完全培养基。放入细胞培养箱内继续培养;⑥转染24 h后,将细胞消化传代至10 cm培养皿内,待细胞贴壁后,使用含800 mg/mL的G418培养基进行筛选至少2周,直至形成单克隆进行培养,至细胞长满保种并进行后续鉴定。
1.3 蛋白提取及Western blotting检测蛋白表达①细胞全蛋白采用RIPA裂解液(RIPA∶PMSF=100∶1)裂解细胞;细胞核蛋白、包浆蛋白及线粒体蛋白提取采用亚细胞蛋白质组提取试剂盒(Calbiochem,德国)提取;②上述蛋白提取液用BCA蛋白质定量试剂盒(赫特,中国)定量;③使用SDS-PAGE凝胶配置试剂盒配置8%~12%分离胶和4%浓缩胶,将30 μg蛋白质上样进行凝胶电泳;④采用湿转法进行转膜,110 V恒压转70 min;⑤采用80 mL/L脱脂牛奶室温下封闭3 h后孵育相应一抗:anti-RYBP(1∶1 000,Abcam,美国),anti-PARP-1(1∶1 000,Cell Signaling Technology,美国),anti-AIF(1∶500,Santa Cruz Biotechnology,美国),anti-PAR(Merck Millipore,美国),anti-β-actin(1∶3 000,Sigma-Aldrich,美国),anti-Lamin B(1∶500,Santa Cruz Biotechnology,美国),anti-GAPDH(1∶500,Santa Cruz Biotechnology,美国);⑥洗膜后孵育辣根过氧化物酶标记的二抗1 h并再次洗膜;⑦显色。
1.4 CCK-8法检测YM155对细胞抑制率将分别转染RYBP质粒和对照空载质粒后的细胞以10 000个/孔的密度接种于96孔板,放入细胞培养箱培养24 h后加入YM155,设置不同浓度梯度(2.216 5×10-3、4.432 9×10-3、8.865 8×10-3、17.731 6×10-3、35.463 2×10-3μg/mL)。加药后继续培养24和48 h,在终止实验前2 h每孔加入10 μL CCK-8试剂,于37 ℃,50 mL/L CO2避光孵育2 h,使用酶标仪测量450 nm处的光密度值(D)。以上实验均重复3次。
1.5 流式细胞仪检测细胞凋亡将已转染后的KYSE170细胞,加入8.865 8×10-3μg/mL YM155分别处理24、48 h,分别收集上清中和贴壁细胞,离心并使用预冷PBS清洗细胞备好样品,后使用细胞凋亡试剂盒(B&D,美国)说明书操作,进行流式细胞术检测。该实验重复3次。
1.6 免疫荧光实验①将已转染的细胞培养至70%~90%时以5×105个/孔于6孔板内进行爬片,待细胞贴壁后,加入8.865 8×10-3μg/mL YM155处理12 h后更换为正常培养基,用室温的2 mL PBS清洗2次。②40 g/L多聚甲醛固定30 min,PBS清洗甲醛3次。③0.1% Triton X-100 2 mL室温覆盖爬片10 min后,用1×PBS洗涤。④20 mL/L BSA溶液封闭30 min,1×PBS洗涤。⑤100 μL一抗于湿盒内,4 ℃静置孵育过夜。⑥用PBS洗3次后加入稀释好的荧光标记二抗,将玻片置于湿盒内,避光,室温孵育30 min。⑦PBS漂洗3次后使用DAPI封片,荧光显微镜下照相(荧光显微镜,Nikon ECLIPSE 80i C-SHG1,日本)。
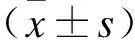
2 结 果
2.1 过表达RYBP对YM155敏感性的影响分别用2.216 5×10-3、4.432 9×10-3、8.865 8×10-3、17.731 6×10-3、35.463 2×10-3μg/mL的YM155处理KYSE170-RYBP及KYSE170-Ctrl细胞24、48 h,CCK-8法检测细胞存活率,计算IC50并绘制药物剂量-抑制率柱状图。结果显示,YM155处理24 h后,KYSE170-RYBP组和KYSE170-Ctrl的IC50分别为2.749 7×10-3μg/mL、17.810 5×10-3μg/mL;YM155处理48 h后,两组的IC50分别为2.206 3×10-3μg/mL、17.759 1×10-3μg/mL(图1,表1)。提示RYBP过表达能显著增加YM155对食管鳞癌细胞KYSE170的抑制率。

图1 不同浓度YM155分别处理24 h(A),48 h(B)后KYSE170-Ctrl及KYSE170-RYBP细胞的抑制率Fig.1 The inhibition ratio of KYSE170-Ctrl and KYSE170-RYBP cells after indicated concentration of YM155 treatment for 24 (A) and 48 (B) hours*P<0.01, **P<0.001。

表1 YM155分别处理24及48 h KYSE170-Ctrl及KYSE170-RYBP细胞的IC50值Tab.1 IC50 of KYSE170-Ctrl and KYSE170-RYBP after YM155 treatment for 24 and 48 hours
2.2 流式细胞仪检测细胞死亡形式采用8.865 8×10-3μg/mL YM155分别处理KYSE170-Ctrl及KYSE170-RYBP 24、48 h后,经流式细胞仪检测细胞死亡形式及百分比,结果显示,KYSE170-RYBP组较KYSE170-Ctrl组的细胞死亡比例明显增加,且存在凋亡及坏死两种死亡形式(图2)。
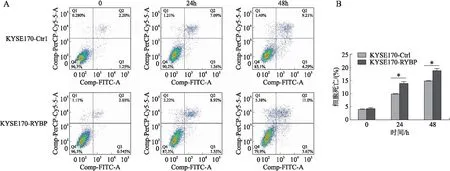
图2 YM155处理后检测细胞死亡形式及百分比Fig.2 Cell death pattern and percentage after YM155 treatment*P<0.01。
2.3 过表达RYBP后细胞内蛋白质水平的变化在食管鳞癌细胞KYSE170中外源性过表达RYBP,Western blotting检测PARP1的表达水平明显升高,而p53、Caspase8表达未见明显增加(图3A)。使用8.865 8×10-3μg/mL YM155分别处理12、24 h后,提取细胞总蛋白进行Western blotting检测,结果显示,PARP-1的表达水平随药物作用时间明显增加并出现活化切割条带,KYSE170-RYBP组表达量及活化程度高于对照组;Caspase8的表达量在YM155作用24 h时出现活化,但未见明显Caspase3的活化(图3B)。

图3 过表达RYBP后(A),8.865 8×10-3μg/mL YM155处理24 h后(B)免疫印迹法检测细胞死亡相关蛋白的表达水平变化Fig.3 Expression of cell death related protein after RYBP overexpression (A), and 8.865 8×10-3μg/mL YM155 treatment for 24 hours (B)
2.4 YM155处理后细胞组分蛋白质水平的变化经YM155处理后,分别提取线粒体及细胞核蛋白,Lamin B作为细胞核内参,GAPDH作为线粒体蛋白内参。结果显示,经YM155处理后,AIF由线粒体进入细胞核,PAR在细胞核内积累,且在RYBP过表达组上述变化更为显著(图4)。
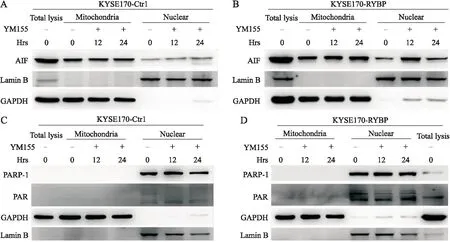
图4 YM155处理后细胞组分蛋白中AIF(A,B),PAR(C,D)的表达水平变化Fig.4 Expressions of AIF (A, B) and PAR (C, D) in cytosolic fraction protein after YM155 treatment
2.5 YM155处理后免疫荧光检测PAR及AIF表达为进一步验证YM155处理后细胞内AIF及PAR的改变,选择KYSE170-RYBP细胞,并经YM155处理12 h后进行免疫荧光检测。结果显示,较未加药组,YM155处理使PAR于细胞核内聚积,AIF则部分由细胞质进入细胞核(图5)。
图5 YM155处理后免疫荧光检测AIF(A),PAR(B)表达Fig.5 Translocation of AIF (A) and accumulation of PAR (B) in KYSE170-RYBP cell lines after YM155 treatment
3 讨 论
放化疗是不可手术的局部进展期食管癌的主要治疗手段,传统的化疗药物包括铂类、氟尿嘧啶及紫杉醇类,由于毒性及耐药性导致其临床应用受到限制,使食管癌的整体预后仍较差。新型小分子抑制剂YM155在多种恶性肿瘤中显示出良好的抗肿瘤作用,目前已有多项相关的Ⅱ期临床试验正在开展。RYBP是一种在染色质水平通过表观遗传修饰调控靶基因的转录因子,在胚胎发育过程发挥重要功能。近年来多项研究显示,RYBP在多种恶性肿瘤中发挥着抗肿瘤效应。本课题组前期通过构建外源性过表达RYBP的食管鳞癌细胞系,证实RYBP能通过抑制细胞周期转换从而抑制食管鳞癌细胞增殖能力[7]。
本研究在前期研究构建的RYBP过表达食管鳞癌细胞系及其对照组细胞中检测凋亡相关蛋白,发现过表达RYBP后能明显增加PARP-1表达,但Caspase8及p53表达未见明显增加。进一步通过YM155处理细胞后,经CCK8及流式分析检测发现过表达RYBP组细胞对YM155的敏感性高于对照组,且细胞死亡形式包含凋亡及坏死两种形式。为进一步明确细胞的死亡途径,使用YM155处理细胞后经分别提取线粒体及细胞核蛋白,免疫印迹法显示细胞核中PAR积累增多,AIF由线粒体进入细胞核,且RYBP过表达组的上述效应更为显著。免疫荧光结果也证实这一假设。提示YM155处理后细胞经Parthanatos途径死亡,而RYBP可能是其死亡途径中一个关键的调节蛋白。
在正常生理条件下,当DNA受到损伤时,PARP-1通过识别有缺口的DNA,与之结合并激活,催化底物烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide, NAD+)转化成为ADP核糖基化蛋白受体,后者与核受体蛋白结合形成多聚ADP核糖链,达到一定长度后降解产生聚ADP核糖,介导碱基切除修复复合物[(X射线交错互补修复基因(X-ray repair cross complementing group 1, XRCC1)为脚手架,与聚合酶β、DNA连接酶Ⅲ结合形成的复合物]参与DNA单链断裂处的修复[16]。而在病理条件下,如中风、缺血再灌注损伤或药物作用下,PARP-1大量激活,并触发Parthanatos。既往研究显示,YM155能通过激活PARP-1诱导食管癌发生Parthanatos[13]。本研究及多项研究均发现,在恶性肿瘤中,RYBP过表达后能明显增加PARP-1的表达水平,但在本研究发现未能激活Caspase家族,而RYBP是通过何种方式激活PARP-1,并在YM155的作用下增加食管鳞癌的Parthanatos,仍需进一步的研究。
4 结 论
RYBP能通过激活PARP-1/AIF/PAR增加食管鳞癌细胞对YM155的敏感性,导致细胞发生Parthanatos。
