BALB/C小鼠骨髓源性树突状细胞的定向诱导分化及鉴定
2021-03-11周文旭吴晓燕施秉银丁晨光管智慧姜亚卓项和立
周文旭,吴晓燕,施秉银,倪 宁,丁晨光,管智慧,姜亚卓,项和立
(1.西安交通大学第一附属医院内分泌科,陕西西安 710061;2.西安交通大学医院内科,陕西西安 710049)
树突状细胞(dendritic cell, DC)的来源及分化发育的成熟度与其功能关系紧密。人体内DC具有成熟和未成熟两种形态,前者是早期免疫应答强有力的抗原递呈细胞(APC),后者能诱导免疫耐受[1]。致耐受性树突状细胞(tDC)是诱导机体特异性免疫耐受的强有力工具。然而,由于DC在体内含量极微,无法从活体组织直接分离获得足量DC。造血干细胞(HSC)具有高度自我更新的能力和多能分化的潜能,是分化为DC的主要造血前体细胞,骨髓中的HSC含量远高于脾脏和外周血[2]。近年来,国内外研究报道,使用特定的细胞因子组合方案可以有效诱导小鼠骨髓HSC体外扩增并向DC定向分化[3]。免疫磁珠法具有分选纯度高、高效快速、操作简单等优点[4]。
雌性BALB/C小鼠是目前主要的Graves病(GD)动物模型。GD是器官特异性自身免疫性疾病,发病率高,可累及全身多个系统,对人类生命健康危害很大。近年来,机体免疫系统对某些自身成分免疫耐受的诱导和重建是自身免疫性疾病研究备受关注的焦点,维持或重建机体对自身抗原TSH受体(TSHR)的有效免疫耐受,可能成为一种防治甲状腺功能亢进症的新方法。DC仍然是GD免疫应答中的主要APC[5]。由于DC在免疫耐受诱导中的重要作用,建立一种能长期稳定地获得BALB/C小鼠骨髓源性DC并进行鉴定的有效方法成为GD免疫耐受相关研究的关键。目前尚没有应用免疫磁珠法自BALB/C小鼠中分离纯化诱导未成熟DC(imD)的研究报道。
本研究应用免疫磁珠法,自BALB/C小鼠骨髓中分离、纯化CD117+HSC,再加入相应的细胞因子促进HSC体外扩增,并诱导HSC定向分化为DC,最后进行形态、功能及表面标志鉴定,建立DC前体细胞的储备库,为进一步行基因修饰DC诱导GD免疫耐受研究奠定实验基础。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级别健康雌性BALB/C 8周龄小鼠,体质量20~25 g,由西安交通大学医学部实验动物中心提供。
1.1.2主要试剂 重组小鼠细胞因子:干细胞因子(rmSCF)、白细胞介素3(rmIL-3)、粒细胞-巨噬细胞集落刺激因子(rmGM-CSF)、白细胞介素4(rmIL-4)、白细胞介素10(rmIL-10)、肿瘤坏死因子α(rmTNF-α)购自美国R&D公司(货号分别为455-MC-010、403-ML-010、415-ML-010、404-ML-010、417-ML-025、410-MT-010)。FITC标记的流式细胞计数抗体(FITC anti-mouse CD11c、FITC anti-mouse CD40、FITC anti-mouse CD80、FITC anti-mouse CD86、FITC anti-mouse I-A/I-E)及FITC标记的同型对照抗体(FITC Armenian Hamster IgG、FITC Armenian Hamster IgM、FITC Armenian Hamster IgG、FITC Rat IgG2a、FITC Rat IlgG2b)购自美国BioLegend公司(货号分别为117305、124608、104705、105109、107606)。脂多糖(LPS)购自美国Invitrogen公司(货号tlrl-pglps)。小鼠IL-12 ELISA检测试剂盒购自美国BioSource公司(货号HZ-E0644m)。
1.1.3主要仪器 免疫磁珠分离系统:德国MiltenyiBiotec GmbH公司专利产品MiniMACS & MidiMACS。倒置相差显微镜:日本NIKON公司TE2000-U型。扫描电子显微镜:日本电子(JEOL)公司JSM-840。透射电子显微镜:日本日立(HITACHl)公司H-600。流式细胞仪:美国BD公司FACS Calibur。酶联免疫检测仪:美国Biokit公司Elx800。
1.2 方法
1.2.1BALB/C小鼠骨髓来源的CD117+HSC分离纯化及体外增殖 将BALB/C小鼠断颈处死,于超净工作台中取出股骨,用含双抗1640培养基注入骨髓腔反复冲洗,用100目筛网过滤制成单细胞悬液,加入2 mL红细胞裂解液,离心、重悬、细胞计数。利用免疫磁珠分离系统(MACS)自小鼠骨髓中分离、纯化CD117+HSC,接种于6孔板中,每孔加入25 ng/mL的rmSCF以及rmIL-3培养7 d,刺激HSC扩增,对比扩增前后细胞数量,了解扩增倍数。
1.2.2HSC定向诱导分化为DC 加入相应的细胞因子,使HSC定向分化为DC。将上述扩增所得的造血干细胞加入基础因子rmGM-CSF(50 ng/mL)及rmIL-4(20 ng/mL),以后每3 d以半量添加[6]。3 d后,将所得的造血干细胞分为两组:拟分化为未成熟DC(imDC)组和拟分化为成熟DC(mDC)组。在rmGM-CSF及rmIL-4基础上,imDC组中加入rmIL-10(20 ng/mL)抑制成熟[7],mDC组中加入rmTNF-α(20 ng/mL)促其分化为成熟[8]。以后每3 d以半量添加。同时追加细胞因子rmIL-4和rmGM-CSF。每日在倒置相差显微镜下观察,比较两组细胞在形态学方面的差异,总计培养7~9 d。
1.2.3DC的超微结构及吞噬功能检查 培养第9天,收获两组细胞(imDC和mDC),分别制作标本行扫描及透射电子显微镜检查,观察细胞超微结构以及吞噬功能。其中imDC组于第9天提取部分细胞,加入凋亡细胞,共培养2 h,制作标本后行电镜检查,观察其吞噬功能。
1.2.4DC表型分析 培养第9天,收获DC(imDC和mDC),加入死活染料去除死细胞和细胞碎片,将imDC和mDC分别根据所加入的不同标记抗体分组。收集细胞,800 r/min离心5 min,PBS洗涤细胞2次并重悬,调整细胞密度为5×106/mL,加入1 mL预冷的40 g/L多聚甲醛,4 ℃固定40 min,800 r/min离心5 min,再用PBS重悬细胞,每管细胞1×106个,体积为100 μL。分装,然后逐一加入不同的FITC标记抗体及其对照抗体,避光孵育后用PBS缓冲液冲洗,重悬成单细胞悬液,制作流式细胞计数标本,将标记好的样品置入流式细胞仪,激发光波长488 nm检测FITC荧光,应用流式细胞计数(FACS)比较两组细胞在表面标志表达方面的差异。
1.2.5DC功能检测 检测脂多糖(LPS)刺激对DC细胞因子分泌量的影响。培养第8~9天,收获两组DC(imDC和mDC)。两组DC细胞再分为A、B两组,A组DC(imDC和mDC)培养液中分别加入10 μg/mL LPS培养24 h;B组DC(imDC和mDC)继续原培养方案,不加LPS刺激,作为对照。分别于LPS刺激前以及刺激后24 h收集4组细胞的培养上清,应用IL-12试剂盒,采取ELISA法测定IL-12的浓度,以此比较4组细胞在LPS刺激前后上述细胞因子分泌量的变化,以及刺激组和未刺激组之间的差异。
1.3 统计学分析使用SPSS 22.0统计软件进行统计学分析。分类变量采用数字或者百分比表示,连续变量采用平均数±标准差表示,多组间比较采用方差分析及SNK两两比较。P<0.05为差异有统计学意义。
2 结 果
2.1 BALB/C小鼠骨髓来源的CD117+HSC分离纯化及体外增殖情况在倒置相差显微镜下计数,自每只BALB/C小鼠股骨骨髓中可得到4×107~6×107个有核细胞,经MACS系统分离、纯化的CD117+HSC有3×105~5×105个,纯度在95%以上。加入HSC刺激因子mSCF及mIL-3后,观察HSC体外增殖情况。结果表明,mSCF加mIL-3方案可以有效刺激HSC扩增,细胞数在接种第3、5、7天分别可达到接种时的(10.34±1.43)倍、(22.65±2.71)倍、(54.39±3.08)倍。对两组小鼠造血干细胞进行冻存与复苏,复苏后细胞回收率达(84.04±2.83)%。
2.2 定向分化的DC形态学表现在光镜下和电镜下比较两组细胞,mDC和imDC在光镜(图1)和扫描电镜下(图2)的形态有明显差异,主要表现在树突的密度、长度方面,mDC组细胞树突相对较为粗大,呈树枝状或星状,imDC组细胞树突相对短小,呈毛刺状;透射电镜下(图3)imDC核深染,细胞质内线粒体丰富,近膜侧有较多吞饮泡,可见吞噬凋亡细胞现象。
倒置相差显微镜显示,imDC细胞表面出现少量的毛刺状突起,形态稍不规则(图1A);mDC细胞表面有粗大的树枝状或星状突起,细胞形态不规则(图1B)。
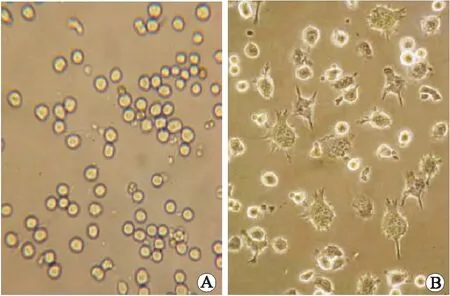
图1 BALB/C小鼠骨髓来源的DC培养(倒置相差显微镜, ×400)Fig.1 DC culture from bone marrow of BALB/C mice (inverted phase contrast microscope, ×400)A:未成熟DC(imDC);B:成熟DC(mDC)。
扫描电镜显示,imDC细胞呈球形或不规则形,细胞表面不光滑,可见到许多短小的突起(图2A);mDC的细胞形态基本同imDC,其表面粗糙,细胞表面突起较长且多,呈毛刺状、树枝状或星形突起(图2B)。

图2 BALB/C小鼠骨髓来源的DC(扫描电镜, ×4 000)Fig.2 DCs from bone marrow of BALB/C mice (scanning electron microscope, ×4 000)A:未成熟DC(imDC);B:成熟DC(mDC)。
透射电镜显示,imDC细胞形状不规则,细胞表面有较多的微绒毛样突起;核深染,细胞核不规则,核内染色质边集,核仁可见;细胞质内核糖体丰富,线粒体较小,嵴结构清晰;近膜侧有较多吞饮泡,细胞质内还可见到被吞噬的细胞碎片及细胞的吞噬现象(图3A)。mDC细胞形态仍然不规则,细胞表面的突起较多,细胞质内细胞器丰富,线粒体数量较imDC组明显增多,未见到凋亡细胞及细胞的吞噬现象(图3B)。

图3 BALB/C小鼠骨髓来源的DC(透射电镜, ×4 000)Fig.3 ImDCs and mDCs from bone marrow of BALB/C mice (TEM, ×4 000)A:未成熟DC(imDC);B:成熟DC(mDC)。
2.3 DC表型分析DC表型分析的流式图见图4。流式细胞计数结果以百分比的形式表示。CD11c在imDC与mDC中均呈较高水平表达,两组间无统计学差异(P>0.05)。CD40、CD80、CD86、I-A/I-E在imDC中呈低水平表达,而在mDC的表达水平明显增加,呈中水平或高水平表达,差异均有统计学意义(P<0.01),表现为特征性的成熟DC表型(图4)。

图4 流式细胞计数检测imDC及mDC细胞表面标志的表达Fig.4 FACS of the expressions of imDC and mDC cell surface markers
2.4 DC功能检测应用LPS刺激DC,比较imDC和mDC在LPS刺激前、后以及未刺激状态下IL-12分泌量变化。结果表明(图5),在LPS刺激前(A1),imDC组及mDC组IL-12分泌量差异有统计学意义(P=0.025)。使用LPS刺激24 h后,imDC组(A2)的IL-12分泌量较刺激前(A1)轻度升高(P=0.037),与LPS未刺激组(B)比较差异无统计学意义(P=0.064);而mDC组IL-12分泌量在LPS刺激后24 h(A2)较刺激前(A1)明显升高(P=0.007),与未刺激组(B)比较差异也有统计学意义(P=0.009)。imDC组及mDC组两组细胞在LPS刺激后IL-12分泌量差值差异有统计学意义(P=0.006)。结果表明,LPS刺激在促进DC成熟上与TNF-α有协同作用,imDC在LPS刺激后其IL-12分泌量的上调不如mDC显著,可能与IL-10的作用有关。

图5 LPS刺激前后各组DC的IL-12分泌量Fig.5 IL-12 secretion of DCs before and after LPS stimulation
3 讨 论
不同DC亚群的免疫功能有不同特点,机体imDC主要来源于骨髓中的HSC[9],如何在体外分离培养获得足够数量和纯度的功能性DC成为相关领域研究进展的瓶颈。雌性BALB/C小鼠是目前主要的GD动物模型。研究表明,HSC的分化能力在幼年小鼠优于老年小鼠[10]。因此,本研究采用健康雌性4~6周龄幼年BALB/C小鼠,自BALB/C小鼠股骨骨髓中分离DC的前体细胞。
HSC形态学上缺乏特异性,目前只能借助于其表面标志进行分选纯化。CD117(c-kit)即HSC生长因子受体(SCFR),高水平表达于多能干细胞表面,干细胞因子结合CD117后促进HSC增殖分化,CD117是目前公认的小鼠HSC分选的重要标志[11]。目前有多种HSC分选方法,主要包括组织培养瓶贴壁、亲和吸附柱、荧光活化细胞分选系统(FACS)、免疫磁珠分离系统 (MACS)等。前2种方法DC的产率和纯度不高、影响细胞活力、易于污染且费时费力。FACS和MACS均是免疫学细胞分选方法,能快速高效地分离纯化体内含量极少的一些细胞群。但FACS分选速度较慢(每小时处理约2.0×107个细胞)、技术要求高、仪器设备昂贵;MACS应用单克隆抗体荧光染色法与免疫吸附细胞分离技术相结合,能直接从大样本中分离纯化特定细胞,并且可以高纯度地分选出稀有细胞[4],具备不影响细胞活性、分选效率高、回收率高、分离纯度好、高效快速、操作步骤简便等优点。本研究采用德国Miltenyi Biotec GmbH公司的专利产品CD117单克隆抗体标记的免疫磁珠阳性选择法体外分离纯化HSC。经MACS系统分离、纯化得到的CD117+HSC 5×105~6×105,占骨髓有核细胞总数0.9%左右,与文献报道相符[11]。CD117+HSC纯度在95%以上,解决了以往方法所分选的HSC纯度低这一缺陷。
既往研究表明,细胞因子不同的组合方案以及不同浓度时,HSC扩增效果会有显著差异[12]。在本研究中,使用SCF加IL-3细胞因子组合对HSC进行培养扩增,结果表明,加入SCF和IL-3可以有效刺激HSC扩增,较以往研究节约了培养成本[12]。
体外条件下,DC的诱导培养必须通过细胞因子刺激其生长,针对不同前体细胞加入不同细胞因子和不同培养条件,能够改变DC的表型及功能。GM-CSF可以调控HSC向DC、单核细胞和巨噬细胞分化,而IL-4有利于HSC向DC定向分化,并使DC维持在未成熟状态[13]。研究表明,小鼠骨髓HSC在GM-CSF和IL-4刺激后24~48 h即能分化为DC[3]。IL-10可使DC维持于未成熟状态,并促进Th1 细胞分化,诱导T 细胞无能[14]。TNF-α是在体外培养中促进HSC分化而且促进DC成熟的必备因子[15]。一些免疫调节物质如LPS、PGE2等可以促进DC成熟[16]。本研究参考以往的研究[6],联合应用rmGM-CSF和rmIL-4体外诱导HSC定向分化为DC,并加入不同的细胞因子控制DC的成熟度。结果显示,联合应用rmGM-CSF(50 ng/mL)及rmIL-4(20 ng/mL)可以有效诱导DC定向分化,所培养细胞具有典型的DC形态特征,均明显有别于单核细胞和巨噬细胞,并且随着时间的推移这种变化越来越明显(图1,图2,图3)。FACS细胞表型分析证实所培养的DC为淋巴系DC。在体外诱导分化的过程中,相比以往研究[16],本研究的GM-CSF用量相对较小,表明低剂量GM-CSF有利于保持DC的未成熟状态。
DC具有异质性,而人类及小鼠的DC表面,无论成熟状态如何,CDllc表达均为阳性(人类浆细胞DC除外)[17]。CD830、CD80、CD86及CD40分子是成熟DC表面代表性的标志物,DC成熟活化时,上述分子的表达上调[17]。除CD11c+外,imDCs缺乏特异性表面标志[17]。本研究结果表明,未成熟DC组和成熟DC组均高表达CD11c,证实所培养的DC为淋巴系DC。加入了TNF-α刺激培养的mDC组,细胞表面标志CD40、CD80、CD86及I-A/I-E(MHC-Ⅱ类分子)的表达明显增强,表现为特征性的成熟DC表型;而imDC组低水平表达CD40、CD80、CD86及MHC-Ⅱ类分子,与文献报道的imDC表型特征一致[17]。所获得的imDC在细胞形态、表面标志表达、功能上均符合imDC的生物学特征,证实在GM-SCF和 IL-4 诱导HSC向DC定向分化的基础上加入IL-10培养方案可以有效诱导小鼠imDC定向分化。
IL-12对DC的发育成熟及功能发挥关键作用。imDCs能分泌少量IL-12,DC在成熟过程中会大量分泌IL-12。有研究认为,LPS可以刺激DC成熟,诱导DC分泌IL-12,并上调IL-10和TNF-α的分泌[16]。本研究表明,LPS与TNF-α在刺激DC成熟上有协同作用,LPS刺激后imDC和mDC所分泌的细胞因子量存在显著差异,可利用这一点进行DC功能鉴定。
综上所述,本研究证明,使用特定的细胞因子组合方案可以有效诱导小鼠骨髓HSC向DC定向分化,并可以较精确地控制DC的成熟度。小鼠mDC及imDC在细胞形态、表面标志物、功能及LPS刺激后细胞因子分泌量方面存在显著差异,利用这些指标可以鉴定DC的成熟度。本研究成功建立了一套自GD模型动物雌性BALB/C小鼠中长期稳定地获得DC特别是imDC并对其进行鉴定的有效方法,为诱导小鼠免疫耐受预防甲状腺功能亢进症的实验研究提供了必要的实验基础。
