模拟氮沉降和降水增加对弃耕草地土壤微生物学特性的影响
2021-03-11张玉革刘月秀马锐骜孟亚妮
张玉革, 刘月秀,, 杨 山,, 马锐骜, 吴 辉, 孟亚妮, 李 慧
(1. 沈阳大学 环境学院, 辽宁 沈阳 110044; 2. 中国科学院沈阳应用生态研究所 额尔古纳森林草原过渡带生态系统研究站, 辽宁 沈阳 110016)
随着农业生产中氮肥施用量的增加和化石燃料的燃烧等,我国大气氮沉降有逐年增加的趋势[1].氮沉降增加可以提高土壤氮素水平,增加地上植被的生物量,但持续增加的氮输入会导致土壤酸化、物种多样性丢失、群落稳定性降低[2].IPCC评估报告指出,至21世纪末,北半球中纬度地区夏季降水将出现增加的趋势,其中中国内蒙古东部地区降水增量在10%~20%之间[3].在受水分限制的半干旱草地生态系统中,增加降水能增加地上植被物种丰富度和群落稳定性[4],增加土壤的C、N库[5],促进营养物质的运输及有效性的增加,但也增加了土壤中盐基淋失[6]、化肥非点源污染的风险[7].长期氮沉降和降水格局变化对草地生态系统的功能和服务均有显著影响,目前,对氮和水输入增加对地上植被和土壤理化性质的影响已有一定的认识,但对土壤微生物学特性的影响尚不十分清楚.
土壤微生物是土壤养分循环过程的重要驱动者,是表征土壤质量的重要生物学指标,对人类活动和环境变化十分敏感.氮输入增加对土壤微生物生物量的影响因生态系统以及土壤类型而异.例如,在森林和草地等天然生态系统中,氮输入增加会降低微生物生物量,抑制微生物呼吸,对微生物生长和活性有负面影响[8];然而在农业生态系统中,有研究发现氮添加可增加土壤微生物生物量[9].在干旱-半干旱天然草地,降水增加通常能促进微生物生物量增加,但氮沉降和降水增加与微生物生物量的交互作用仍需进一步深入研究.微生物群落通常有比较恒定的元素计量比,微生物C、N、P元素计量比的比值通常维持在60∶7∶1到42∶6∶1之间.微生物群落元素计量比反映了其对周围养分变化的一种适应机制,对于调控土壤养分库和养分循环过程具有重要意义.然而,在研究土壤微生物学特性对环境变化的响应时,却很少关注微生物元素计量比这一指标.
土壤酶来源于土壤微生物、植物和动物的分泌,在土壤有机物质循环及能量转化中具有重要的作用.土壤酶活性强弱可以在一定程度上反映土壤状况,而且对于外界因素变化较敏感,可作为土壤生态功能变化的预警和敏感指标.研究发现[10],在内蒙古典型天然草地,氮输入增加提高了纤维素水解酶(CEL)和N-乙酰-β-D-葡糖苷酶(NAG)的活性.在美国新墨西哥州半干旱草地开展的野外试验证明了氮输入增加同样能够提高CEL活性,同时也提高了β-葡萄糖苷酶(BG)的活性[11].在内蒙古典型草地开展的模拟降水增加试验表明,降水增加提高了NAG、BG和蛋白质水解酶(PRO)的活性[10].然而,美国加利福尼亚草地增水处理则降低了BG和NAG活性[12].因此,氮沉降和降水增加对土壤酶活性的影响仍具有很大的不确定性,其交互作用也鲜有报道.
Sinsabaugh等[13]提出的生态酶化学计量学理论,讨论了元素在生态系统中受到生物和环境因素调控时维持动态平衡的过程.生态酶化学计量比,指与微生物代谢、养分的生物化学循环密切相关的土壤酶活性的比值,如β-1,4-葡萄糖苷酶和N-乙酰-β-D-葡糖苷酶活性的比值(BG活性/NAG活性)、纤维素水解酶和蛋白质水解酶活性的比值(CEL活性/PRO活性)等.酶活性计量比常与养分浓度或养分浓度的比值相联系,能够反映微生物群落的新陈代谢及养分需求与环境中养分有效性之间的生物地球化学平衡模式,酶活性计量比可以用来评价微生物C、N、P养分资源需求状况,是检测微生物代谢的环境驱动力和生态系统对资源可利用性的有效手段和工具.因此,氮沉降和降水增加背景下,研究土壤微生物酶活性及酶活性计量比对于评估全球变化条件下微生物代谢潜力的改变及生态系统对有效资源的分配具有重要意义.
内蒙古干旱-半干旱地区典型草原是我国重要的农牧业资源地区,从而形成农田镶嵌于草原景观的农牧交错带.自20世纪50年代起,为满足粮食生产需要,内蒙古地区大面积的天然草地被开垦成农田,导致天然草地面积减少以及荒漠化,生态系统退化严重.为防止草原进一步退化,21世纪初当地政府部门开始实施“退耕还草”“退牧还草”政策[14].在氮沉降和降水增加背景下弃耕恢复草地,土壤微生物量和活性的响应规律仍不明确.由于土地利用历史不同,有农耕利用背景的弃耕地,土壤微生物学特性对环境变化的响应与天然草地可能有所不同[15].本文选取位于内蒙古自治区多伦县恢复生态学试验示范研究站的弃耕恢复草地,研究了长期模拟氮沉降和降水增加对弃耕恢复草地土壤微生物量、酶活性及其计量比的影响,以期为未来降水格局改变和氮沉降量变化对温带草原土壤生态系统结构和功能的影响研究提供数据支撑.
1 材料与方法
1.1 研究地点
研究地点位于内蒙古多伦县的中国科学院植物研究所多伦恢复生态学试验示范站,地理坐标为E116°17′,N42°20′.该区域海拔1 150~1 800 m,属于温带半干旱大陆性季风气候,年均气温约2.1 ℃、年均降水量约385.5 mm,土壤类型主要为砾石质栗钙土.试验样地在1980年以前为天然自由放牧草地,从1980年开始开垦为农田,种植作物为莜麦(Avenachinensis)、荞麦(Fagopyrumesculentum)和胡麻(Sesamumindicum),期间大约每年施用90 kg·hm-2磷酸氢二铵((NH4)2PO4).样地经过多年连续种植后,作物产量逐渐下降,自2001年弃耕后一直处于围栏保护状态,未受任何大型食草动物践踏和啃食,并逐步恢复为以冰草(Agropyroncristatum)和克氏针茅(Stipakrylovii)为优势物种的草地.
1.2 试验设计
于2005年4月设置野外试验,采用裂区设计,降水为主区因子,分为常规降水和增加降水2个主区域.在2个主区内,进行氮添加处理.共计4个处理:对照(CK)、氮添加(N)、水添加(WCK)、氮水共同添加(WN),每种处理7个重复小区.每个小区尺寸为8 m×8 m,小区之间设有1 m宽的过道,作为缓冲隔离带.增加降水采用具有流量控制的装置进行喷灌,在每年的6~8月进行12次喷灌,每周增水1次,每次15 mm,每年共增水180 mm,约为全年降水量的50%.氮肥施用形式为尿素(N的质量分数为46%),年氮施用量10 g·m-2,于每年5、6月分2次施用.本研究从各处理的7个重复中选取编号为1~4的4个重复,共计16个小区.
1.3 土壤样品采集与测定
1) 土壤样品采集:2013年8月(田间试验第9年)采集土壤样品,采用直径3 cm土钻以5点混合法采集表层(0~10 cm)土壤样品.土壤样品去除根系和石块后分为2份:1份于自然条件下风干,用于测定土壤理化性质;1份4 ℃条件保存,用于测定土壤微生物学特性.

3) 土壤微生物量测定:微生物量碳(microbial biomass carbon, MBC)和微生物量氮(microbial biomass nitrogen, MBN)质量分数采用氯仿熏蒸-浸提法,用0.5 mol ·L-1K2SO4溶液浸提后,滤液用HT1300型号TOC分析仪(德国Analytik Jena公司生产)进行测定.
4) 土壤酶活性测定:β-1,4葡萄糖苷酶(β-1,4-glucosidase,BG)和N-乙酰-β-D-葡糖苷酶(N-acetyl-β-D-glucosaminidase,NAG活性)采用对硝基苯酚(p-nitrophenol,PNP)比色法测定.BG和NAG的特异性结合底物分别为对硝基苯基-β-D-吡喃葡萄糖苷和对硝基苯-N-乙酰-β-D-氨基葡萄糖,酶活性用单位时间内底物裂解后释放的对硝基苯酚质量分数来表征,单位为mg· kg-1·h-1.具体方法如下:称取1 g鲜土,加入250 μL甲苯,将4 mL修正pH值的缓冲溶液(将溶液调节至最适合酶促反应的pH,BG修正缓冲液的pH=6.0,NAG修正缓冲液的pH=5.5)和1 mL底物,混匀后在37 ℃下培养1 h.培养结束后加入终止剂过滤,滤液用UV1700型号紫外分光光度计(日本SHIMADZU公司生产)在410 nm处比色测量对硝基苯酚质量分数.纤维素水解酶和蛋白质水解酶的特异性结合底物分别为羧甲基纤维素钠盐和酪蛋白,具体方法为:称取1 g鲜土,加入250 μL甲苯,5 mL缓冲溶液和5 mL底物,混匀后分别在30 ℃条件下培养24 h,在50 ℃下培养2 h.培养结束后加入终止剂过滤,滤液离心后取5 mL的上清液与7.5 mL的碱性试剂混合,用紫外分光光度计在700 nm处比色测量葡萄糖和酪氨酸质量分数[10].
1.4 地上植被生物量测定
于2013年8月中旬采集植物样品.在每个试验小区的典型区域随机选取一个0.15 m×2 m 的样方,将样方内的植物齐地面剪下装入信封,置于烘箱内105 ℃杀青后,65 ℃恒温24 h烘干至恒重,采用称重法测定地上部分净初级生产力(ANPP).
1.5 数据统计
本文采用Excel分析处理基础数据,土壤理化指标和胞外酶数据均表示为平均数±标准差(n=4).采用SPSS 16.0统计分析软件中的裂区-双因素方差分析(two-way ANOVA)检测水因子(W)和氮因子(N)及其交互作用(W×N)对土壤理化性质、地上植被生产力、土壤微生物生物量和土壤酶活性的影响.采用单因素方差分析和Duncan’s multiple-range test多重比较检验土壤理化性质、地上植被生产力、土壤微生物生物量和土壤酶活性在不同处理间的差异显著性.采用R3.6.3软件中的corrplot数据包分析土壤酶活性和酶化学计量比与土壤理化性质间的相关性.采用Canoco 5.0软件中的Biplot of redundancy analysis(RDA)数据包分析土壤理化数据对土壤酶活性总体变化的解释程度,采用蒙特卡罗置换检验(Monte Carlo permutation test)分析水处理、氮处理和土壤理化性质对土壤酶活性变化的贡献是否显著(α=0.05).
2 结果与分析
2.1 氮和水添加对土壤理化性质和植被地上生产力的影响
氮和水添加对土壤理化性质及地上净初级生产力的影响如表1所示,两因素方差分析如表2所示.结果显示,氮添加显著降低了土壤pH值,与CK和WCK处理相比,N和WN处理土壤pH分别降低了0.73和0.45.增加降水显著增加了土壤全碳(TC)和全氮(TN)质量分数(P<0.05),与CK和N处理相比,WCK和WN处理的土壤TC质量分数分别增加了13.3%和33.3%,土壤TN质量分数分别增加了11.5%和29.4%(P<0.05).氮添加有增加硝态氮和铵态氮质量分数的趋势,但总体效应不显著(P>0.05).氮添加显著增加了植被地上净初级生产力(ANPP)(P<0.05),与CK和WCK处理相比,N和WN处理,植被ANPP分别增加了18.3%和21.2%.增加降水没有明显改变植被ANPP,同时氮和水处理对植被ANPP不存在交互作用(P>0.05).
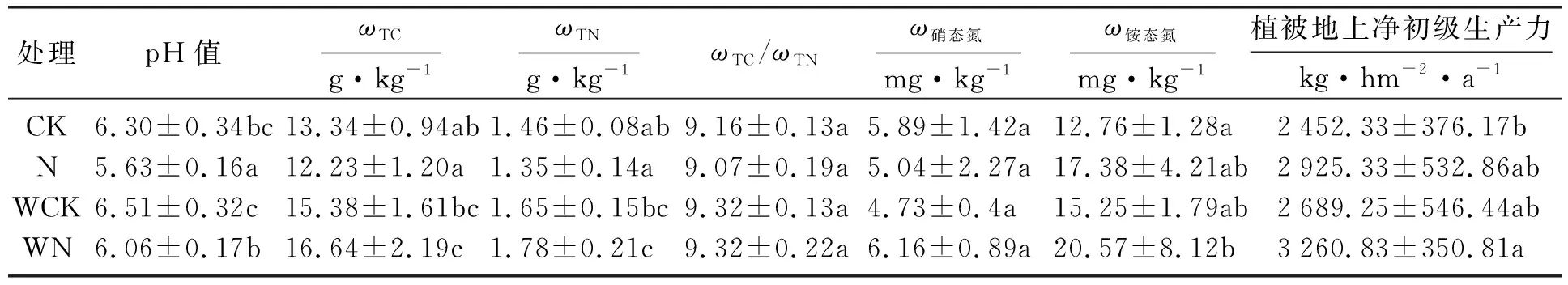
表1 氮和水添加对土壤理化性质及地上净初级生产力的影响Table 1 Effects of nitrogen and water addition on soil properties and aboveground net primary production
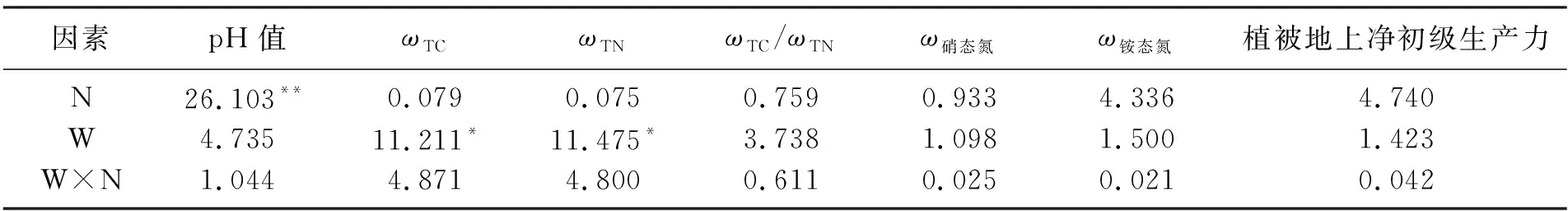
表2 氮和水添加对土壤理化性质及地上净初级生产力影响的两因素方差分析
2.2 氮和水添加对土壤微生物生物量的影响
图1为氮和水添加对土壤微生物生物量的影响,表3为氮和水添加对土壤微生物学特性的两因素方差分析.从图1和表3中可知,氮添加显著降低了微生物生物量碳(MBC)和微生物生物量氮(MBN)质量分数(图1(a)、1(b),P<0.05),并显著增加了微生物生物量碳氮比(ωMBC/ωMBN)(图1(c),P<0.05);与CK和N处理相比,WCK和WN处理,土壤(ωMBC/ωMBN)分别增加了108%和67%.增加降水显著增加了土壤MBC质量分数(图1(a),P<0.05),与CK和N处理相比,WCK和WN处理,土壤MBC质量分数分别增加了18.5%和98.5%.增加降水对ωMBN和ωMBC/ωMBN无显著影响(图1(b)、1(c),P>0.05).氮添加和增加降水对土壤微生物生物量不存在交互作用(P>0.05).

(a) 氮水添加对微生物生物量碳的影响(b) 氮水添加对微生物生物量氮的影响(c) 氮水添加对微生物生物量碳氮比的影响

表3 氮和水添加对土壤微生物生物量及酶活性影响的两因素方差分析
2.3 氮和水氮添加对土壤酶活性和酶化学计量比的影响
图2为氮和水添加对土壤酶活性及酶化学计量比的影响,两因素方差分析结果表明,氮添加显著增加纤维素水解酶(CEL)的活性(图2b,表3,P<0.05),相对于CK和WCK处理,N和WN处理土壤中CEL活性分别增加了43.2%和8.5%.氮添加显著降低了蛋白质水解酶(PRO)的活性(图2(d),P<0.05),相对于CK和WCK处理,N和WN处理PRO活性分别降低了23.3%和21.9%.氮添加对β-1,4-葡萄糖苷酶(BG)活性(图2(a))和N-乙酰-β-D-葡糖苷酶(NAG)活性的比值(图2(c))均无显著影响(表3,P>0.05).相反地,增加降水不影响CEL和PRO的活性,而显著增加BG和NAG的活性(P<0.05).相对于CK和N处理,W和WN土壤BG活性分别增加了31.9%和45.2%;土壤NAG活性分别增加了43.4%和36.3%.氮和水处理对4种土壤酶都不存在交互作用(表3,P>0.05).

(a) 氮水添加对β-1,4-葡萄糖苷醇活性的影响 (b) 氮水添加对纤维水解酶活性的影响(c) 氮水添加对N-乙酰-β-D-葡糖苷酶活性的影响 (d) 氮水添加对蛋白质水解酶活性的影响(e) 氮水添加对BG活性/NAG活性的影响(f) 氮水添加对CEL活性/PRO活性的影响
进一步分析氮添加和增加降水对土壤酶化学计量比的影响.结果表明,β-1,4-葡萄糖苷酶活性和N-乙酰-β-D-葡糖苷酶活性的比值(BG活性/NAG活性)对氮添加和降水增加响应不敏感(图2(e),P>0.05);氮添加显著增加了土壤纤维素水解酶活性和蛋白质水解酶活性的比值(CEL活性/PRO活性)(图2(f),P<0.05),增加降水对CEL活性/PRO活性无显著影响.氮添加和增加降水对土壤BG活性/NAG活性和CEL活性/PRO活性不存在交互作用(表3,P>0.05).
2.4 土壤酶活性和酶化学计量比与土壤特性的相关关系
图3为土壤理化性质、地上植被生产力、微生物生物量和土壤酶活性的相关关系,由图3可知,BG、NAG活性与土壤TN、TC质量分数显著正相关(P<0.05),CEL活性与ANPP显著正相关(P<0.05);PRO活性与土壤pH值、MBC质量分数显著正相关(P<0.05).土壤BG活性/NAG活性与土壤特性没有显著相关关系,这可能也是氮、水添加对其无显著效应的主要原因.CEL活性/PRO活性与土壤铵态氮、硝态氮质量分数显著正相关(P<0.05),与土壤pH值、MBN质量分数显著负相关(P<0.05).
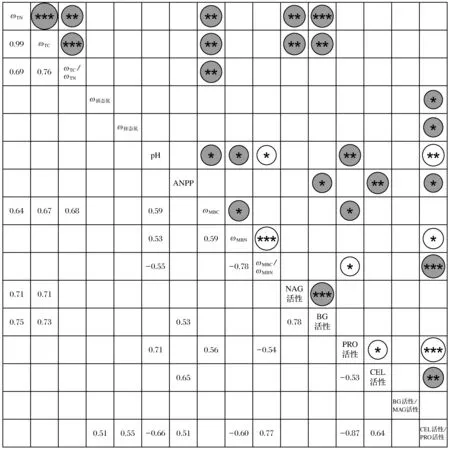
图3 土壤理化性质、地上植被生产力、微生物生物量和土壤酶活性的相关关系Fig.3 Correlations among soil physicochemical properties, ANPP, soil microbial biomass and enzymatic activities
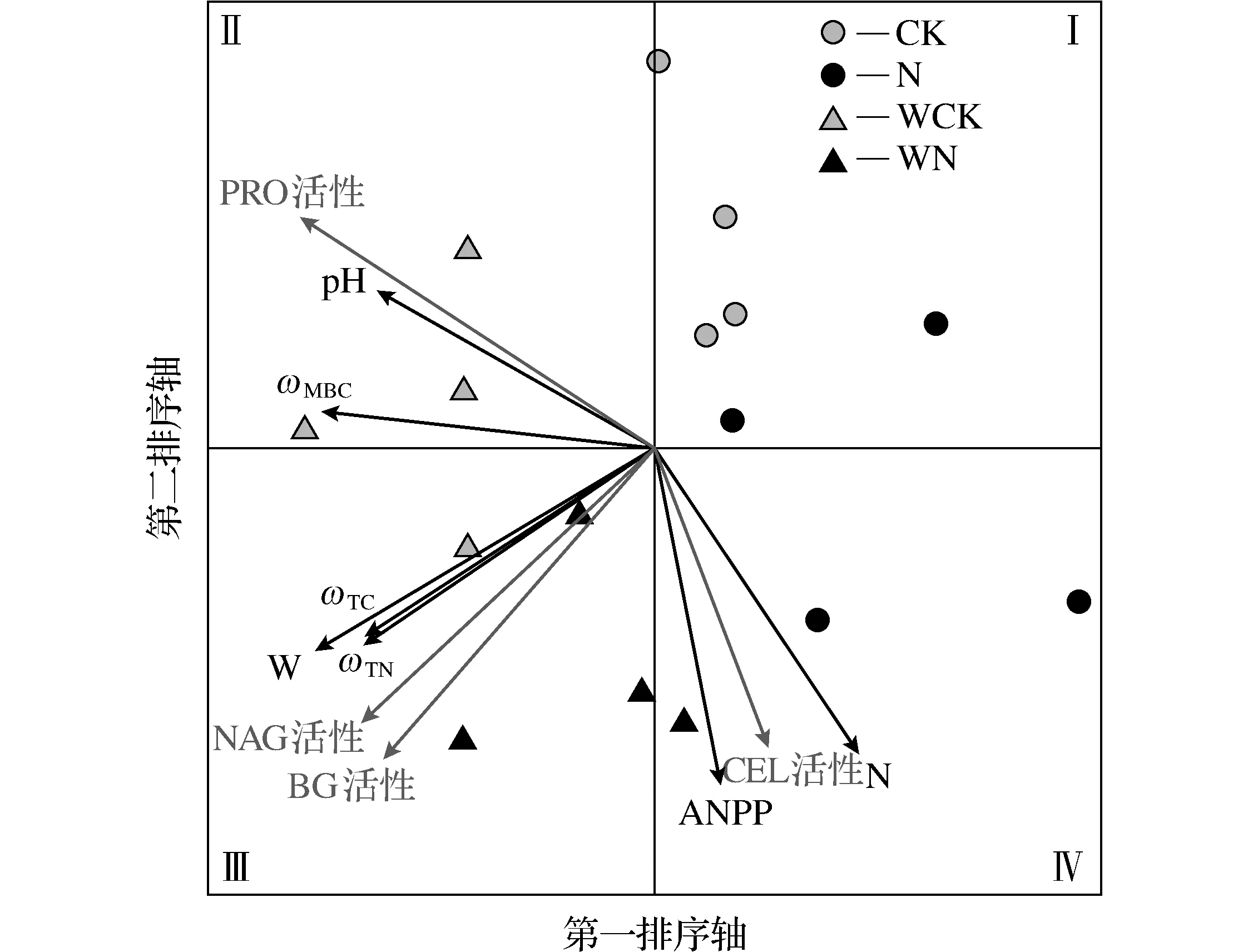
图4 氮水添加处理下环境因素对总体土壤酶组成的影响冗余分析排序Fig.4 Redundant analysis sorting of effect of environmental factors on the composition of the overall soil enzyme under the treatment of nitrogen and water addition
进一步通过冗余分析(RDA)评估环境因子对总体土壤酶组成的影响见图4,图4中,第一排序轴、第二排序轴用来描述因子线性组合中最显著的2种;Ⅰ、Ⅱ、Ⅲ、Ⅳ为第一、第二、第三、第四象限;不同因子间的夹角越小代表相关性越大,方向相同代表正向相关,方向相反代表负向相关.结果显示,2个排序轴共同解释了总体土壤酶组成变异的79.82%(第一排序轴为38.2%,第二排序轴为41.56%).与CK处理相比,N、WCK和WN处理的土壤酶组成有明显改变,N处理分布在第一排序轴正方向,WCK处理分布在第一排序轴负方向,CK分布在第二排序轴正方向,WN处理分布在第二排序轴负方向.固定因子氮(N)位于第四象限,与CEL活性和ANPP分布在同一象限,表明氮添加促进了地上净初级生产力,提高了土壤CEL活性,且与简单相关分析一致,即CEL活性和ANPP显著正相关(图3).固定因子水(W)位于第三象限,与TC质量分数、TN质量分数、NAG活性、BG活性分布在同一象限,表明水添加提高了土壤TC、TN质量分数,提高了NAG和BG活性,且NAG和BG活性与TC和TN质量分数呈显著正相关.土壤PRO活性分布在第二象限,与N因子反向分布,表明氮添加抑制了土壤RRO活性;与MBC质量分数和土壤pH值分布在同一象限,显著正相关,与简单相关分析一致(图3),蒙特卡罗检验显示固定因子氮和水对土壤酶活性改变效应显著(P<0.05),见表4,并具有最高解释度,分别解释了32.5%和27.2%的变异.同时土壤TC、TN、MBC质量分数、ANPP和pH值对土壤酶活性有显著效应(P<0.05).

表4 基于蒙特卡罗置换检验分析土壤环境因素对土壤酶功能组成变异解释度及其显著性
3 讨 论
3.1 弃耕恢复草地和天然草地对氮水添加响应之比较
本研究发现,增水处理显著增加了土壤TC质量分数和TN质量分数,而ωTC/ωTN对氮水添加的响应均不敏感,这与毗邻的天然草地研究结果一致[5].在青藏高原草甸草地和全国尺度上的研究也表明,土壤表层碳含量与降水量呈正相关[16-17].研究推测,增水对土壤TC和TN质量分数的正效应主要与植被地下生物量的增加有关[18].施氮对土壤TC和TN质量分数影响的研究结果并不一致.本研究中,氮输入增加对土壤TC和TN没有明显效应,与毗邻天然草地和北美高草草原开展的研究结果一致[5].但也有一些研究[19]表明,增氮处理通过增加植被生产力,从而增加凋落物返还到土壤中的碳和氮.施氮导致的土壤酸化使表层无机碳损失,抵消了一部分返还到土壤中的碳,这可能也是导致土壤总碳没有增加的原因[20].这些不同的研究结论可能与不同试验处理具有不同的土壤质地、处理前土壤养分背景、植被类型和处理年限有关.
之前在毗邻天然草地的研究结果显示,长期氮输入显著增加了土壤铵态氮和硝态氮质量分数[5,20].而在本研究中发现,氮输入对土壤铵态氮和硝态氮质量分数无显著影响(表1).这可能是由于该样地为弃耕后恢复草地,有历史氮肥施用遗留效应,导致再次接受一定剂量氮输入时,响应不敏感[21].但也有研究[22]表明,当存在氮肥遗留效应时,输入更高浓度的氮,可能会引起显著的生态学效应.

3.2 降水增加缓解了氮对微生物生长的负效应
本研究发现,氮添加降低土壤微生物生物量碳(MBC)和微生物生物量氮(MBN)质量分数,这可能与氮添加导致土壤酸化有关(图3、图4).本研究和之前的研究表明,氮添加能够降低土壤pH值,土壤微生物不适应酸性环境,从而使微生物生物量降低[10].此外,外源氮输入导致地上植被的盖度、生物量和生产力都有不同程度增加[2].植物生长带走了土壤中的大量养分,由于植被与微生物的养分竞争,使土壤微生物生长受到限制,导致在氮添加条件下,土壤微生物生物量进一步降低[25].同时发现,氮添加显著增加了土壤微生物生物量碳氮比,可能为氮添加导致土壤酸化,与细菌相比,真菌更容易在偏酸性环境下生存,氮添加导致真菌在群落中的比例增加[26],且大部分真菌比细菌有更高的微生物碳氮比,可能是造成微生物生物量碳氮比增加的原因[27].但在本研究中并未测定细菌和真菌的生物量,只能做初步推测.调整群落结构组成和元素计量比,可能是微生物群落适应外界环境变化的重要调控机制.在本研究中,增水处理显著提高了MBC质量分数,而在干旱-半干旱草地和河岸带生态系统中,微生物生长受水分限制[28].因此,降水增加可能会提高土壤含水量,促进了微生物的生长和对碳氮的固定.降水还通过扩散(diffusion)作用释放干旱条件下积累的有机质、无机氮和微生物残体来增加养分的有效性,进而提高土壤微生物生物量[29].降水增加还可能通过加速凋落物分解,释放出较多的养分和微量元素来补充表土养分库[30],从而促进土壤微生物生长.
研究发现,氮水共同添加处理(WN)条件下的土壤微生物生物量明显高于单独施氮处理(N),这表明在干旱-半干旱草地生态系统中,降水能有效缓解氮输入增加对微生物生长的负效应.这与之前在毗邻的天然草地以及贝加尔针茅草原开展的增水、增氮试验研究结果一致[26,31].此外,氮和水处理对土壤pH值的影响,也具有相反的效应,与单独施氮处理相比,氮水共同添加处理,pH值显著增加(表1).氮和水的这种抵消效应可能存在生物学和非生物学两方面机制.非生物学方面,增水处理增加了养分和盐基离子向下层移动,从而减缓了酸化效应[32].从生物学方面,其机理可能为在较为干旱的条件下,微生物和植被都下调了代谢水平,微生物矿化出来的养分超过了微生物和植物所需,因此导致这些养分在土壤中累积,酸化效应进一步恶化[33].而当降水较为丰沛的条件下,刺激了微生物和植物的生长,从而使微生物矿化出的养分和微生物植物吸收的养分达到平衡,减缓了氮素在土壤中的累积[29].
3.3 氮输入增加了微生物碳获取能力
“资源分配假说”认为,微生物产酶需要巨大的能源投资,因此某一养分元素处于限制状态时,微生物产酶增加以矿化有机物质并满足自身养分需求,而该养分元素在土壤中有效性增加时,微生物产酶将减少[34].换言之,微生物倾向于消耗其大量资源储备去获取最限制其生长的元素,因此,当某一种可利用的养分较为充足时,就会抑制获取该养分的酶,刺激获取其他养分的酶的活性.本研究中,氮添加显著增加了参与碳获取的纤维素水解酶的活性(图2),降低了参与氮获取的蛋白质水解酶的活性,符合资源分配假说.当外源氮输入增加时,土壤中氮较为充足,此时相比于氮元素,碳元素成为比氮元素更限制微生物生长的元素,为了维持稳定的微生物生物量碳氮比,微生物抑制获取氮元素的酶活性,获取碳元素的酶活性增加,导致纤维素水解酶/蛋白质水解酶降低,这是微生物应对养分元素计量比变化的一种策略.此外,外源氮素添加使草原地上植被生产力增加,并导致植物凋落物中纤维素和半纤维素质量分数增加,也可能是导致土壤纤维素酶活性上升的原因[35].本研究也确实观察到ANPP和CEL活性的显著正相关关系(图3、图4).氮添加对蛋白酶活性的抑制还可能与土壤酸化有关.有研究指出,土壤pH值是影响蛋白酶活性的主要因素[26],而氮添加显著降低了土壤pH值,土壤蛋白酶活性随着土壤氮添加而降低.本研究中发现的蛋白酶活性与pH值正相关关系印证了这一推测(图3).
本研究还发现氮添加显著影响土壤中大分子聚合物降解的初始限速步骤,例如参与纤维素初始水解的纤维素水解酶(CEL)活性和参与蛋白质初始水解的蛋白质水解酶(PRO)活性;而水因子控制矿化的最终步骤,促进了小分子物质分解,包括分解纤维二糖的β-1,4-葡萄糖苷酶(BG)活性和水解几丁二糖的N-乙酰-β-D-葡萄糖苷酶(NAG)活性.其原因可能为长期施氮肥导致土壤板结退化,团聚体稳定性下降,小分子底物移动性降低,而增水处理则有助于维持土壤团聚体结构,小分子底物与微生物接触增加,因此,增水处理影响了小分子底物的矿化酶,而氮对小分子底物矿化酶的效应不显著.此外,研究还发现,ωCEL/ωPRO与ANPP和ωMBC/ωMBN呈显著正相关关系(图3),而ωBG/ωNAG与两者之间无明显相关关系,这暗示参与大分子聚合物初始水解的酶化学计量比与植被地上净初级生产力(反映凋落物量)关系更密切,也更能反映微生物养分需求.
4 结 论
本研究依托内蒙古恢复生态学试验示范研究站的长期野外氮水添加实验平台,探讨了人类长期活动和全球气候变化背景下土壤微生物特性的响应趋势,对于准确评估氮沉降和降水增加背景下,全球变化对弃耕草地生态系统土壤生物学特性和生态服务功能的影响具有重要参考意义.得到如下结论.
1) 与天然草地的大多数结论不同,弃耕草地由于历史施肥背景,土壤氮素养分水平对氮添加不敏感;地上生产力也没有显著提升.
2) 氮添加显著降低了土壤微生物生物量,而增水显著增加了土壤微生物生物量,缓解了土壤酸化对土壤微生物生长的负效应;此外,氮添加显著增加土壤微生物生物量碳氮比,这可能是微生物适应外界环境变化的一种自身调控机制.
3) 氮添加降低了氮获取酶活性,增加了碳获取酶活性,符合资源分配假说;大分子底物(例如纤维素和蛋白质)水解酶活性及其计量比,更能反映微生物养分需求.
