抗中性粒细胞胞质抗体相关性血管炎合并血栓栓塞患者的临床特征
2021-03-10樊容榕张磊刘升云
樊容榕,张磊,刘升云
(郑州大学第一附属医院 风湿免疫科,河南 郑州 450000)
抗中性粒细胞胞质抗体相关性血管炎(anti-neutrophil cytoplasmic antibody associated vasculitis,AAV)是一组自身免疫性坏死性血管炎,包括显微镜下多血管炎、肉芽肿性多血管炎以及嗜酸性肉芽肿性多血管炎,多累及小血管并可能导致多个系统损伤[1]。近年来,有病例报道AAV与血栓栓塞的相关性[2-3],也有研究表明AAV患者存在合并血栓栓塞的高风险,特别是在疾病的活动期[4-6]。然而,目前对AAV患者合并血栓栓塞的危险因素仍有不同结论,尚未达成共识。本研究主要探讨AAV患者合并血栓栓塞的临床特征,旨在提高临床医生对此类疾病的认识。
1 资料与方法
1.1 研究对象选取2013年9月至2020年9月于郑州大学第一附属医院住院的100例AAV患者,其中合并血栓栓塞的患者26例(AAV-T组),未合并血栓栓塞的患者74例(AAV-N组)。纳入患者均符合2012年Chapel Hill会议制定的AAV诊断标准[1]。排除标准:(1)其他结缔组织病;(2)药物引起的继发性血管炎;(3)其他原因导致的肾损伤。
1.2 血栓栓塞诊断血栓栓塞包括动脉血栓和静脉血栓,前者以心肌梗死和脑梗死为主,后者以深静脉血栓和肺栓塞为主。(1)心肌梗死:根据典型临床表现,结合心电图以及血清心肌标志物的改变来诊断[7]。(2)脑梗死:影像学图像上出现责任病灶或局灶神经功能缺损症状或体征持续24 h以上[8]。(3)深静脉血栓:患者突然出现某侧肢体肿胀疼痛,彩色多普勒超声检查或静脉造影检查结果为阳性[9]。(4)肺栓塞:CT肺动脉成像(CT pulmonary angiography,CTPA)、肺通气/灌注核素扫描、磁共振血管造影(magnetic resonance angiography,MRA)、肺动脉造影等检查结果为阳性,患者可能存在胸痛、胸闷、低氧等一系列临床症状[10]。
1.3 临床资料分别收集AAV-T组与AAV-N组患者的一般资料、临床表现、实验室指标、治疗方案及预后情况等。(1)一般资料包括性别、AAV诊断年龄等。(2)临床表现包括是否发热、咯血或合并肺部感染,有无关节肿痛、皮肤症状、眼部症状、胃肠道症状、肾脏受累以及外周神经受累等。肾脏受累的标准为肾活检提示存在AAV肾损伤。通过临床表现和实验室检验结果计算每位患者的伯明翰血管炎活动性评分(Birmingham vasculitis activity score,BVAS)。(3)实验室指标包括白细胞计数、血小板计数、血红蛋白、红细胞沉降率、C反应蛋白、白蛋白、血肌酐、补体C3、补体C4、D-二聚体、24小时尿蛋白总量、尿红细胞计数、总胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白以及ANCA等。ANCA包括以蛋白酶(proteinase 3,PR3)为靶抗原的血清PR3-ANCA和以髓过氧化物酶(myeloperoxidase,MPO)为靶抗原的血清MPO-ANCA,均采用酶联免疫吸附法检测。(4)治疗方案:糖皮质激素、免疫抑制剂、丙种球蛋白、血浆置换的使用情况。(5)评估预后的指标为患者生存或死亡情况。
1.4 统计学方法采用SPSS 21.0统计软件处理数据。计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料以频数和率(%)表示,组间比较采用χ2检验;采用多因素logistic回归分析AAV合并血栓栓塞的危险因素;利用Kaplan-Meier法绘制生存曲线,采用log-rank方法比较两条生存曲线的差异。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料和临床表现AAV-T组男性占比、发热患者占比、BVAS评分高于AAV-N组(P<0.05)。两组发病年龄、高血压、关节痛、眼部症状、胃肠道症状、肾脏受累、外周神经受累、咯血情况比较,差异无统计学意义(P>0.05)。见表1。

表1 AAV-T组与AAV-N组患者的临床特征比较
2.2 实验室检查AAV-T组血小板、C反应蛋白、红细胞沉降率、D-二聚体水平高于AAV-N组(P<0.05)。两组白细胞、血红蛋白、白蛋白、肌酐、补体C3、补体C4、24小时尿蛋白总量、尿红细胞计数、总胆固醇、甘油三酯、高密度脂蛋白及低密度脂蛋白水平比较,差异无统计学意义(P>0.05)。见表2。两组MPO-ANCA阳性率、PR3-ANCA阳性率比较,差异无统计学意义(P>0.05)。见表3。
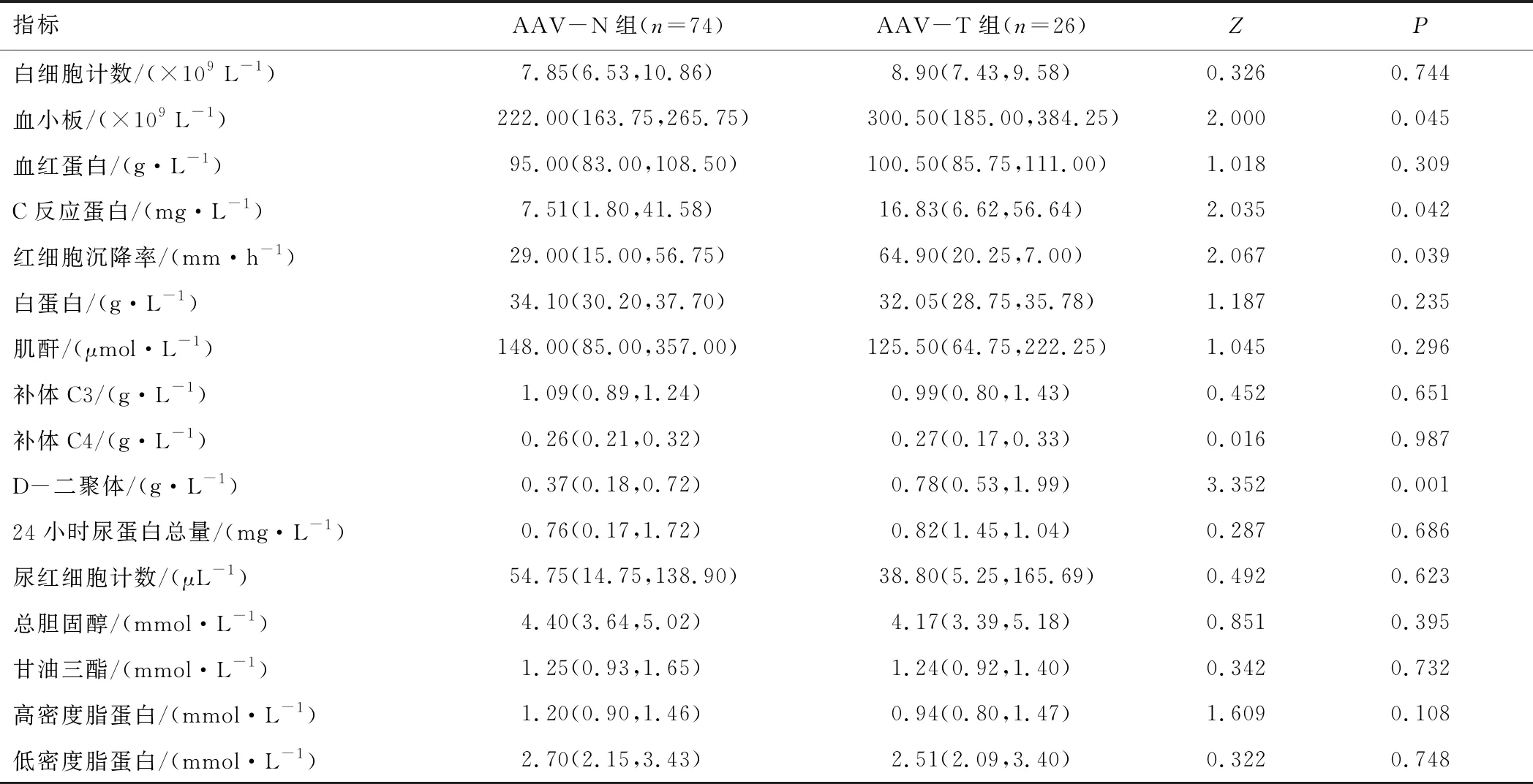
表2 AAV-T组与AAV-N组常规实验室检查结果比较[M(P25,P75)]
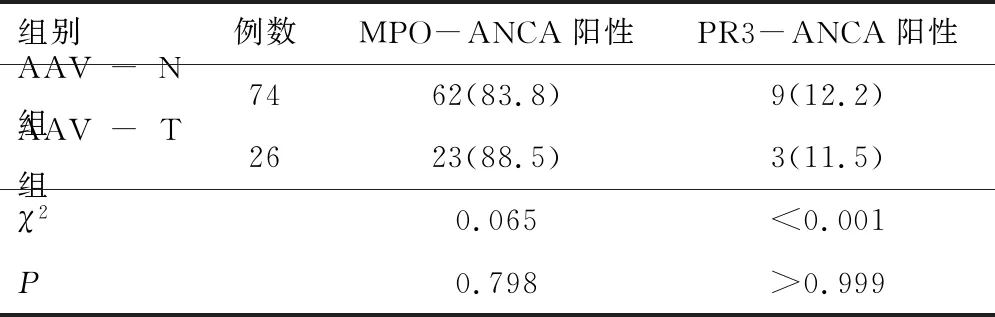
表3 两组ANCA类型比较[n(%)]
2.3 血栓栓塞发生情况AAV-T组有18例(69.2%)患者在AAV活动期发生血栓栓塞,8例(30.8%)患者在缓解期发生血栓栓塞,其中脑梗死19例(73.1%)、心肌梗死2例(7.7%)、下肢静脉栓塞7例(26.9%)。其中4例脑梗死发生于AAV确诊前2~12个月,1例在静脉置管后发生周围血管栓塞。
2.4 AAV患者合并血栓栓塞的影响因素以是否合并血栓栓塞为因变量,以性别、发热、BVAS评分、血小板计数、C反应蛋白、红细胞沉降率及D-二聚体为自变量,进行多因素logistic回归分析,结果显示,男性、发热、BVAS评分偏高及血小板水平升高是AAV患者合并血栓栓塞的独立危险因素(P<0.05)。见表4。
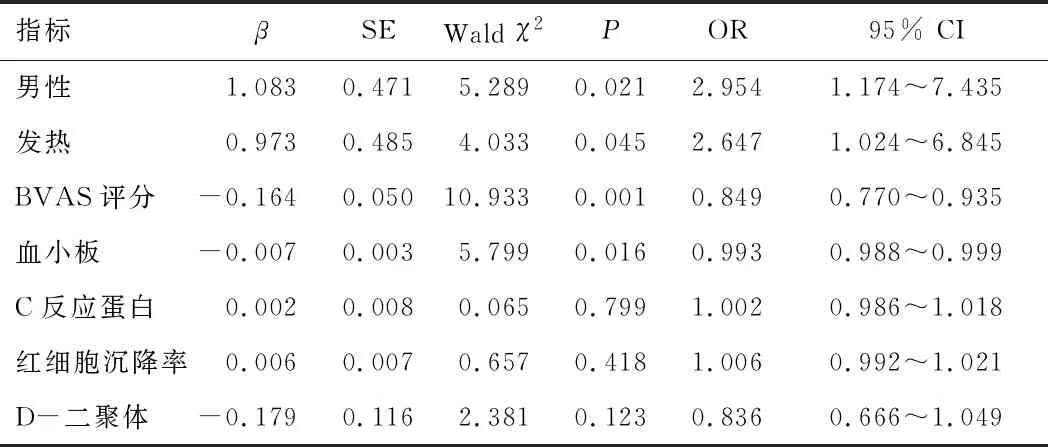
表4 AAV患者合并血栓栓塞的危险因素
2.5 治疗AAV-N组中8例(33.3%)患者接受单一环磷酰胺治疗,65例(87.8%)患者接受糖皮质激素治疗,其中17例患者联合环磷酰胺治疗,12例患者联合丙种球蛋白治疗,19例患者联合血浆置换。AAV-T组患者均接受糖皮质激素治疗,其中9例(37.5%)联合环磷酰胺治疗,3例(12.5%)联合丙种球蛋白治疗,5例(20.8%)联合血浆置换。
2.6 预后所有患者均被随访2~84个月。在随访过程中,AAV-N组患者死亡2例(1例死于食管癌,1例死于肺部真菌感染),2例出院后失访。AAV-T组患者死亡4例(15.4%)。采用Kaplan-Meier法绘制生存曲线,见图1。AAV-T组生存率低于AAV-N组(P<0.05)。
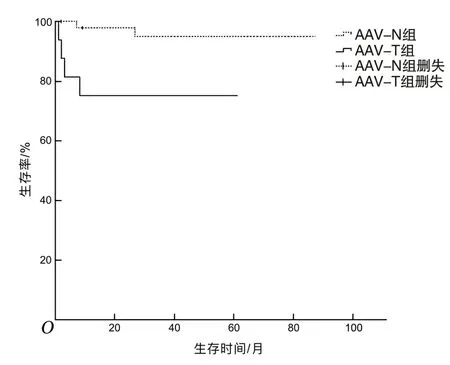
图1 AAV-T组与AAV-N组患者Kaplan-Meier生存曲线
3 讨论
AAV为一种多系统自身免疫性疾病。与一般人群或其他免疫系统疾病患者相比,AAV患者更容易合并血栓栓塞[4]。有研究表明,AAV在疾病活动期合并静脉栓塞的发生率为6.57%~10.00%[11-13],这与本研究结果相符。即使在疾病缓解期,AAV患者发生血栓栓塞的风险也高于一般人群[4,6]。Bautz等[14]认为纤溶酶原是AAV中未被明确的自身抗原,在AAV患者中纤溶酶原向纤溶酶的转化过程被延缓,从而延长了纤维蛋白凝块的溶解时间,导致缓解期血栓事件的发生。
男性AAV患者更容易发生血栓栓塞[15]。在本研究中,AAV-T组男性占比高于AAV-N组。BVAS评分是评估血管炎临床疾病活动性的依据之一。Luqmani等[16]提出了BVAS评分标准,并认为当BVAS评分高于15分时,可以判断为血管炎活动期。本研究发现,AAV合并血栓栓塞患者虽与未合并血栓栓塞者有部分重叠的BVAS评分,但AAV-T组BVAS评分高于AAV-N组,提示血管炎活动期患者更容易出现血栓栓塞。Willeke等[17]发现血小板计数与AAV的疾病活动性相关,AAV活动期患者的血小板计数增加,且与BVAS评分密切相关。因此,血小板计数可以用来代表免疫活性,并作为疾病活动性的标志之一。在本研究中,AAV-T组血小板水平高于AAV-N组。AAV造成的血管损伤导致血小板和多种细胞因子共同释放[18],致使机体处于高凝状态,更易发生血栓栓塞。
红细胞沉降率是一种非特异性的炎症指标。AAV患者在活动期常存在红细胞沉降率升高的现象,可能与免疫球蛋白G(immunoglobulin G,IgG)抗体的形成与增加有关,且红细胞沉降率升高也提示患者的血流动力学发生了改变,更容易发生血栓栓塞[12]。C反应蛋白也是一种非特异性炎症标志物,参与炎症发生和心脑血管疾病的进展过程。高C反应蛋白水平与静脉血栓栓塞风险相关,而慢性低级别的炎症可能是肥胖相关性心肌梗死和静脉血栓栓塞的共同危险因素[19]。本研究发现,AAV-T组C反应蛋白、红细胞沉降率水平高于AAV-N组。AAV-T组生存率低于AAV-N组。
D-二聚体升高说明机体处于高凝状态并继发纤维蛋白溶解亢进。在本研究中,AAV-T组D-二聚体水平高于AAV-N组。从动物模型和临床观察中积累的证据表明,补体系统的激活,尤其是替代途径可能对AAV的进展至关重要,补体激活产物和ANCA刺激中性粒细胞不仅会导致中性粒细胞呼吸爆发和脱颗粒,还会激活凝血系统,产生凝血酶[20]。这也可能导致血栓栓塞事件的发生风险升高。
血栓栓塞不仅可能发生于AAV活动期,也可能发生于缓解期,是AAV病情变化和治疗过程中易出现的严重并发症。男性AAV患者合并血栓栓塞的风险更高,合并发热、BVAS评分偏高、血小板水平升高的AAV患者也更容易出现血栓栓塞。AAV合并血栓栓塞患者的预后较差。早期诊断与对症治疗能够有效地改善AAV患者的预后,提高其生存率。
