23G微创玻璃体切割术联合雷珠单抗玻璃体腔注射治疗PDR
2021-03-10李超鹏黄大蕊
韩 蔚,李超鹏,黄大蕊,王 婷
0引言
增生性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)属糖尿病视网膜病变(diabetic retinopathy,DR)进展终末阶段,是导致糖尿病致盲的重要原因[1]。目前尚未完全阐明DR发病机制,近年来越来越多报道认为PDR发病与血管内皮生长因子(vascular endothelial growth factor,VEGF)增殖密切关联[2-3]。以往对PDR主张采用玻璃体切割术联合全视网膜激光光凝术治疗,可控制DR进展,保存视功能,降低超过90%的DR患者5a致盲风险[4]。但在手术过程中,剥离视网膜前新生血管增殖膜时出血或渗血影响手术视野,尤其晚期PDR患者剥离难度大,手术难度高,增加手术并发症,直接影响手术效果[5]。最新研究提出,通过抗VEGF药物改善视网膜微环境,可减少血管渗漏,提高手术可操作性,降低手术出血风险[6]。雷珠单抗为人源性抗VEGF单克隆抗体片段,分子质量小,与VEGF-A结合度高,易穿透视网膜,通过与VEGF-A异构体及降解产物靶向结合,降低VEGF活性,抑制VEGF增生,减轻血管渗透,抑制新生血管形成[7]。已证实可控制眼内新生血管性疾病进展,抑制新生血管生成[8]。故本研究将其与23G玻璃体切割手术联合用于PDR治疗中,旨在探究加用雷珠单抗玻璃体腔注射是否有助于降低PDR患者23G玻璃体切割术难度、减少手术并发症、促进视力改善,以期为PDR临床治疗提供证据。
1对象和方法
1.1对象回顾性研究。采集我院2016-01/2020-01收治的PDR患者78例89眼的临床资料。纳入标准:年龄>18岁;PDR诊断满足中华医学会眼科学会眼底病学组糖尿病视网膜病变临床诊疗指南(2014年)PDR标准,分期为Ⅳ~Ⅵ期[9],经眼底血管造影、眼底照相等检查证实;有明确2型糖尿病病史,病程10~20a;玻璃体积血≥1级[10];无视网膜脱离;眼压正常;入组前未接受视网膜光凝或其他相关治疗;治疗前、术后均自愿采集房水标本;均为本市常住居民,有固定联系方式,依从性好,经评估可完成随诊及复查;临床资料完善。排除标准:近12mo内有玻璃体腔抗VEGF药物治疗史;眼部手术史;无法控制高血压;严重心肝肾肺功能不全;合并青光眼、葡萄膜炎;视网膜动静脉阻塞;息肉样脉络膜新生血管病变;已接受激光光凝或玻璃体手术治疗;经期;服用抗凝药物;血液系统疾病;凝血功能障碍;恶性肿瘤;孕期或哺乳期女性;临床资料不全。按术前是否给予雷珠单抗玻璃体腔注射治疗分为手术组(仅行23G微创玻璃体切割术,35例41眼)与联合组(23G微创玻璃体切割术联合术前玻璃体腔注射雷珠单抗治疗,43例48眼)。
1.2方法
1.2.1治疗方法术前均完善常规眼科检查,包括眼压、BCVA、眼科B型超声、荧光素眼底血管造影、同裂隙灯显微镜检查等,满足PDR诊断及分期。术前均控制空腹血糖<8.0mmol/L,合并其他内科疾病者病情稳定后进行手术治疗。两组手术均由同一手术团队完成。手术组仅接受23G微创玻璃体切割术治疗。无菌铺巾,0.75%布比卡因3.0mL+2%利多卡因3.0mL球后局部麻醉,高速玻璃体切割仪进行标准23G巩膜三通道玻璃体切割术,一步法固定套管至巩膜,高速玻璃体切割设备(切割频率:每分钟3 000~5 000次,吸力:200~500mmHg)切除机化或积血玻璃体,剥离视网膜纤维血管增殖膜,解除视网膜牵拉,复位视网膜,电凝止血,眼内全视网膜激光光凝,出现视网膜裂孔或水肿无法光凝者,依据患眼视网膜情况,玻璃体腔内填充硅油(视网膜较大或裂孔较大者)、灌注液(视网膜彻底松解、无裂孔者)或C3F8气体(视网膜彻底松解,有较小裂孔者)等。伴明显切口渗漏者,可吸收线关闭切口,术后患眼氧氟沙星滴眼液点眼预防感染。联合组采用雷珠单抗玻璃体腔内注射联合23G微创玻璃体切割术治疗。23G微创玻璃体切割术前3~5d托吡卡胺滴眼液点眼,消毒铺巾,散瞳,盐酸奥布卡因滴眼液表面麻醉,开睑器开眼睑,齿镊固定眼球,镊下角巩膜缘下侧4mm处采用4.5号针自眼球壁垂直进入玻璃体腔中心,缓慢注射雷珠单抗(10mg/mL,批准文号:S20170003)0.05mL,完毕后退针头,无菌纱布覆盖,氧氟沙星滴眼液点眼,持续至玻璃体切割术术前。
1.2.2观察指标治疗前、术后1d,3mo均应用KR-8900型电脑角膜验光仪检测患者术眼最佳矫正视力(best corrected visual acuity,BCVA,LogMAR),同时间点采用CT-80A型电脑非接触眼压仪测定眼压;采用Cirrus HD光学相干断层扫描仪测定黄斑中心凹厚度(central macular thickness,CMT)[11];采用Spectralis HRA型眼底血管造影

表1 两组患者一般资料对比
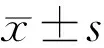
表2 两组手术情况对比
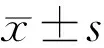
表3 两组治疗前后不同时间BCVA、眼压、CMT、视网膜新生血管渗漏面积变化比较
仪拍摄眼底荧光照片,测定视网膜新生血管荧光素渗漏面积的变化,以上各参数均重复测定3次取均值。治疗前,术后1wk均采用注射器(1mL)自角巩膜缘进入前房,抽取房水0.2mL,低温高速离心,取上清液,采用酶联免疫吸附试验[12]测定房水内VEGF-A、人基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1)、色素上皮衍生因子(pigment epithelium derived factor,PEDF)含量的变化,试剂盒购自美国R&D公司。
均记录两组手术时间、术中出血(0级:无出血或小出血点无需止血操作;1级:可自行停止小出血或调高灌注压、按压玻璃体切割头即可停止;2级:出血量大需电凝止血;3级:血块形成,超过后极部,影响手术视野[13])眼数、术中电凝止血次数及眼内填充物情况,统计视网膜裂孔发生率;并统计两组手术期间及术后3mo内并发症(医源性裂孔、玻璃体积血、前房积血等)发生情况。

2结果
2.1两组患者一般资料对比两组患者性别、年龄、糖尿病病程、PDR分期、眼压、玻璃体积血分级比较,差异均无统计学意义(P>0.05,表1),具有可比性。
2.2两组手术情况对比联合组手术时间短于手术组,电凝止血次数、硅胶填充眼数少于手术组(P<0.05),术中总出血眼数少于手术组(P<0.05),见表2。
2.3两组治疗前后不同时间BCVA、眼压、CMT、视网膜新生血管渗漏面积变化比较治疗前,两组BCVA、眼压、CMT、视网膜新生血管渗漏面积比较,差异均无统计学意义(P>0.05)。术后1d,3mo联合组BCVA改善优于手术组(P<0.05),CMT、视网膜新生血管渗漏面积低于手术组(P<0.05)。术后1d两组眼压均一过性上升,但比较差异无统计学意义(P>0.05),术后3mo均恢复至术前水平(P>0.05,表3)。
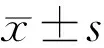
表4 两组治疗前后房水细胞因子水平对比

表5 两组手术相关并发症发生率比较 眼(%)
2.4两组治疗前后房水细胞因子水平对比术后1wk,两组VEGF-A、SDF-1、PEDF均降低(P<0.001),联合组房水内VEGF-A、SDF-1、PEDF均低于手术组(P<0.001),见表4。
2.5两组手术相关并发症发生率比较联合组医源性裂孔及玻璃体再积血发生率低于手术组(P<0.05),其余各并发症比较差异均无统计学意义(P>0.05,表5)。两组医源性裂孔较大者均予硅油填充;联合组玻璃体再积血、前房再出血各2眼,出血少予活血化瘀药物后自行吸收,手术组3眼吸收不理想,玻璃体切割术配合硅油填充术后改善;一过性高眼压均出现在术后1~2d,未经特殊处理后术后1wk内恢复正常;两组前房渗出均为少量炎性渗出,予抗炎药物点眼后吸收。
3讨论
PDR主要由糖尿病持续高血糖环境损伤视网膜微循环,造成血-视网膜屏障受损引起,以视网膜基底膜增厚、微血管瘤形成为特征,是造成视力丢失的重要原因[14]。玻璃体切割术是目前治疗PDR的常用手段,可清除玻璃体积血,解除视网膜牵拉、复位脱离视网膜,有助于视力恢复。但PDR、尤其晚期PDR患者视网膜、增殖血管膜及新生血管黏连致密,手术剥离难度大,易损伤正常视网膜,造成医源性裂孔,并发症多,影响术后视功能恢复[15]。近期越来越多研究发现,高糖环境诱导小血管阻塞及畸形,微循环受阻,微血管瘤形成,引起视网膜缺血、缺氧损伤,VEGF大量释放,形成新生血管,是造成PDR新生血管增殖、增殖性纤维膜形成的关键机制[16-17];突出表现为视网膜新生血管形成、黄斑水肿及渗出,是造成玻璃体积血、牵拉性视网膜脱离的重要原因[18]。已证实VEGF介导PDR发病及进展过程,是诱导PDR新生血管形成的原因[19]。故以抗VEGF治疗为靶向,有望控制视网膜脉络膜新生血管生成,消退视网膜新生血管,改善视网膜组织微循环。
雷珠单抗为临床常用抗VEGF药物,已证实可阻止DR患者血管内皮细胞增殖,减轻微血管渗漏[20]。前期已有大量报道将其用于眼内新生血管性疾病治疗中,证实对活动性PDR、进展性PDR血管生成均有较好的控制效果[21-22]。但对其与23G微创玻璃体切割术联合应用的增益效应尚未完全明确。本研究中,联合组行玻璃体切割术前加用雷珠单抗玻璃体腔内注射治疗,而手术组单独应用23G微创玻璃体切割术治疗,结果发现,联合组手术时间较手术组缩短,术中出血比例及出血程度分级较手术组低,电凝止血次数较手术组少,硅油填充眼数较手术组少,支撑马列等[23]研究结论,表明术前加用雷珠单抗玻璃体腔内注射可缩短手术时间,降低手术难度,减少医源性裂孔及出血。考虑原因为:术前经玻璃体腔内注射雷珠单抗可促进视网膜新生血管消退,促进增殖内膜组织收缩,封闭视网膜新生血管,促进血管膜萎缩及纤维化,减轻新生血管增殖膜与视网膜黏连程度,降低手术剥离难度,降低新生血管剥离过程视网膜误伤风险,进而降低视网膜裂孔发生率,减少出血,改善手术视野,减少电凝止血次数,减少手术器械进出次数,降低手术难度,缩短手术时间。而手术组在解除视网膜牵拉时需辅助应用锐性器械,剥离难度大,易误伤正常视网膜组织,增加再出血风险。
高智勇等[24]表示,术前配合抗VEGF药物治疗PDR更利于促进患者术后视功能恢复。本研究结果显示,联合组术后1d,3mo BCVA改善情况均优于手术组,同时CMT、视网膜新生血管渗漏面积降低,支撑上述报道结果,提示加用雷珠单抗玻璃体腔内注射有可改善视力,减轻黄斑水肿及视网膜新生血管渗漏。分析机制为:术前加用雷珠单抗抗VEGF治疗可抑制眼底新生血管形成,降低视网膜毛细血管通透性,减轻黄斑水肿程度,稳定血-视网膜屏障,助于术后视力改善,更有利于减少视网膜血管渗漏,避免玻璃体反复出血,改善局部代谢,促进黄斑水肿消退。目前雷珠单抗拮抗VEGF生成作用已得到临床证实[25]。本研究结果同样支撑上述结论,研究结果显示,术后1wk联合组房水内血管生成相关细胞因子VEGF-A、SDF-1、PEDF均低于手术组,提示加用雷珠单抗对抑制视网膜新生血管形成,促进增殖血管退化有积极的作用。其中VEGF-A属VEGF家族成员,参与病理性新生血管生成过程,可通过增加内皮细胞数量、基质细胞数量等,改善血管形态。前期报道发现,PDR患者VEGF-A表达明显增高,且与PDR病情严重程度呈正相关[26]。SDF-1属趋化因子蛋白家族成员,存在典型趋化细胞生长因子聚集及增殖等作用,VEGF-A可与SDF-1协同参与PDR新生血管增殖过程,加速血-视网膜屏障破坏[27]。PEDF属细胞外丝氨酸蛋白酶抑制剂,主要分布于神经系统及视网膜内,与VEGF诱导血管通透性增加作用相反,PEDF可拮抗血管渗漏及炎症反应,存在抗纤维化作用[28]。动物试验发现,PEDF、VEGF高表达于血管内皮细胞内,两者协同参与血管纤维膜形成过程[29]。本研究发现,治疗前,两组房水内VEGF-A、SDF-1、PEDF均处于较高水平,考虑三者共同参与PDR新生血管增殖过程,促进内皮细胞增殖,导致血管渗透性提升,加速血-视网膜屏障破坏,导致PDR进展有关。而术后1wk,两组上述因子均降低,但联合组较手术组更低,考虑可能与加用雷珠单抗可促进视网膜新生血管消退,抑制血管纤维化,降低血管通透性,改善视网膜增殖性病变有关。
前期有学者认为,玻璃体腔内注射雷珠单抗可能引起眼压上升、眼部疼痛的不良反应[30]。后续也有药代动力学研究发现,雷珠单抗注药后血药浓度较低,可快速清除,耐受性好,不会引起全身并发症,安全性较高[31]。本研究发现,联合组医源性裂孔、玻璃体积血等并发症发生率较手术组低,其余各并发症相似,两组术后早期均有一过性眼压上升,但均自行改善,表明加用雷珠单抗耐受性较好,且通过术前注药可降低医源性裂孔及术后玻璃体再次积血风险,这与路俊霞等[32]结论相似。
因此,本研究建议对Ⅳ~Ⅵ期PDR患者更推荐术前雷珠单抗玻璃体腔注射联合23G微创玻璃体切割术治疗,较单纯23G玻璃体切割术更能降低手术难度,减少医源性裂孔,降低术中出血风险,促进术后视功能恢复,减轻黄斑水肿,抑制视网膜新生血管增殖,且安全有效,耐受性更高。但本研究为小样本研究,且属回顾性分析,尚存在局限,上述结论尚需进一步扩充样本量、展开多中心随机对照研究证实。
