不同时机血管内介入栓塞术治疗Ⅰ~Ⅲ级颅内动脉瘤破裂的临床疗效
2021-03-10贾建文王文蕾秦怀海
沈 寻 贾建文 王文蕾 秦怀海
1 应急总医院神经外科,北京 100028
2 首都医科大学附属北京朝阳医院神经外科,北京 100020
颅内动脉瘤(intracranial aneurysm,IA)是指由各种原因导致颅内动脉扩张所形成的一种瘤样突起,是颅内动脉异常扩张的常见表现[1-3]。IA破裂是蛛网膜下腔出血的一项主要诱因,具有较高的致残率和致死率,患者多遗留不同神经功能缺损的症状[4-6]。目前,IA破裂主要通过手术进行治疗,其中,开颅夹闭术与血管内介入栓塞术是临床常用的两种术式[7]。开颅夹闭术能够释放蛛网膜下腔的脑脊液,改善颅内血管痉挛,复发率极低。血管内介入栓塞术具有创伤小、安全性高、术后易恢复等优势。临床上将IA分为五级,其中,无明显症状为Ⅰ级;可见明显的头痛及颈中肌肉僵硬但无神经功能缺损为Ⅱ级;在Ⅱ级基础上合并嗜睡及意识障碍,出现轻微神经功能缺损为Ⅲ级;在Ⅲ级基础上出现木僵、单侧肢体麻木、自主神经系统功能障碍与去大脑强直为Ⅳ级;处于深度昏迷、呼唤无反应、接近死亡为Ⅴ级。Ⅰ~Ⅲ级属于低级别IA,术后多可获得较为理想的预后。部分患者因客观原因于发病后72 h后接受手术治疗,但也有部分患者具备选择手术时机的机会。发病后72 h内患者的血管痉挛较活跃,此时行血管内介入栓塞术易引发术中出血,但有利于减轻脑与神经组织细胞损伤,对于改善患者的预后具有积极作用,且腰椎穿刺术、扩容药物等能够改善患者早期血管痉挛[8]。因此,血管内介入栓塞术治疗Ⅰ~Ⅲ级IA破裂虽然具有良好的效果,但关于其应用时机目前尚无统一定论。本研究对应急总医院收治的不同时机行血管内介入栓塞术治疗的Ⅰ~Ⅲ级IA破裂患者的临床资料进行了对比分析,以期为今后该类患者介入治疗时机的选择提供参考,现报道如下。
1 资料与方法
1.1 一般资料
收集2018年1月至2021年1月于应急总医院接受血管内介入栓塞术治疗的Ⅰ~Ⅲ级IA破裂患者的临床资料。纳入标准:(1)年龄≥18岁;(2)经数字减影血管造影(digital subtraction angiography,DSA)等医学影像学检查确诊;(3)Hunt-Hess分级[9]为Ⅰ~Ⅲ级,且符合《颅内动脉瘤血管内介入治疗中国专家共识(2013)》[10]中相关介入治疗标准;(4)行血管内介入栓塞术治疗;(5)相关临床资料完整。排除标准:(1)复发性IA;(2)合并多脏器功能衰竭;(3)处于妊娠期、哺乳期;(4)处于传染性疾病急性期或其他重大创伤、手术后恢复期;(5)同时采用两种及以上治疗方法。根据纳入、排除标准,最终共纳入79例Ⅰ~Ⅲ级IA破裂患者,根据治疗时机的不同将患者分为两组,将在发病后72 h以内(含72 h)接受治疗的47例患者作为观察组,将在发病72 h后接受治疗的32例患者作为延迟组。观察组中,男性26例,女性21例;年龄42~69岁,平均(57.32±5.62)岁;Hunt-Hess分级:Ⅰ级14例,Ⅱ级21例,Ⅲ级12例;病灶位置:前交通动脉瘤6例,后交通动脉瘤9例,大脑前动脉13例,大脑中动脉11例,大脑后动脉8例。延迟组中,男性18例,女性14例;年龄41~68岁,平均(57.28±5.71)岁;Hunt-Hess分级:Ⅰ级10例,Ⅱ级14例,Ⅲ级8例;病灶位置:前交通动脉瘤4例,后交通动脉瘤6例,大脑前动脉9例,大脑中动脉7例,大脑后动脉6例。两组患者的性别、年龄、Hunt-Hess分级和病灶位置比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
两组患者均采用血管内介入栓塞术进行治疗。行全身麻醉后,给予肝素2500~3000 U肝素,静脉滴注。常规消毒铺巾后,按照Seldinger法行经皮穿刺,经右股动脉推送6 F导管达左侧颈内动脉、右侧颈内动脉、左侧椎动脉、右侧椎动脉内。先行常规造影检查,定位IA,观察IA的直径、形态等,随后行DSA检查,以确定观察动脉腔、瘤颈的最佳位置及角度,同时显示球管的位置。于清晰显示动脉瘤、载瘤动脉、导引导管头端路图的引导下,采用微导丝引导支撑,将微导管口置入IA的瘤颈内。选用直径稍大于IA直径的弹簧圈,经微导管将其送入瘤腔并于瘤腔内成篮,在造影下确定成篮后,解脱弹簧圈,调整微导管的位置至瘤颈与瘤顶中央的1/3处,由内向外填塞动脉瘤,至出现致密表现。术毕经DSA复查动脉瘤填塞完成后结束手术。对穿刺点行按压止血,加压包扎,嘱患者平卧8 h;术后第2天视患者情况确定是否给予治疗性腰椎穿刺或腰大池引流。术后第3天行颅脑计算机断层扫描(computed tomography,CT)检查,确定无再出血等症状后于术后第6~7天可出院。
1.3 观察指标
(1)依据术毕DSA检查结果,比较两组患者的栓塞效果。以IA内无造影剂为完全栓塞;以单侧动脉可见少量造影剂残留为单侧少量残留;以IA颈部存在少量造影剂残留为瘤颈残留;以IA内可见明显造影剂充盈为IA充盈。以IA充盈为栓塞失败,其他各征象综合判定为栓塞成功。(2)比较术前及术后3 d两组患者的血清神经与血管相关标志物[半胱氨酸蛋白酶抑制剂C(cystatin C,Cys-C)、神经元特异性烯醇化酶(neuron specific enolase,NSE)、中枢神经特异性蛋白100-β亚型(beta subunit of specific protein S100 protein,S100-β)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、内皮 素-1(endothelin-1,ET-1)]水平、血清炎性因子[肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、C反应蛋白(C-reactive protein,CRP)]水平。采集患者静脉血样6 ml,使用离心机分离血清后,按照免疫比浊法检测Cys-C水平,按照酶联免疫吸附法检测NSE、S100-β、MMP9、ET-1、TNF-α、IL-6、CRP水平。(3)统计并比较两组患者术中出血量、术后并发症的发生率。(4)出院时,依据改良Rankin量表[11]对两组患者的临床疗效进行评分。Rankin量表共分为0~6级,0级为无神经功能障碍,日常生活正常;1级为仅有轻微神经功能障碍,但不影响日常生活; 2级为轻度神经功能障碍,影响日常生活,但尚可自理;3级为中度神经功能障碍,需一些帮助,但可自己行走;4级为中重度神经功能障碍,无帮助下无法行走和自理,靠轮椅行走;5级为卧床不起,失禁,完全不能自理,需长期照护;6级为死亡。
1.4 统计学方法
应用SPSS 23.0软件对数据进行统计学分析。计量资料以(±s)表示,组间比较采用两独立样本t检验。计数资料以n(%)表示,组间比较采用χ2检验、连续校正χ2检验或Fisher确切概率法。等级资料的比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 栓塞效果的比较
观察组患者的栓塞成功率为95.74%(45/47),高于延迟组患者的78.13%(25/32),差异有统计学意义(χ2=4.240,P=0.039)。(表1)

表1 两组患者的栓塞情况
2.2 血清神经与血管相关标志物水平的比较
术前,两组患者的Cys-C、NSE、S100-β、MMP9、ET-1水平比较,差异均无统计学意义(P>0.05);术后3 d,两组患者的Cys-C、NSE、S100-β、MMP9、ET-1水平均低于本组术前,且观察组患者的Cys-C、NSE、S100-β、MMP9、ET-1水平均明显低于延迟组患者,差异均有统计学意义(P<0.01)。(表2)
表2 手术前后两组患者血清神经与血管相关标志物水平的比较(±s)
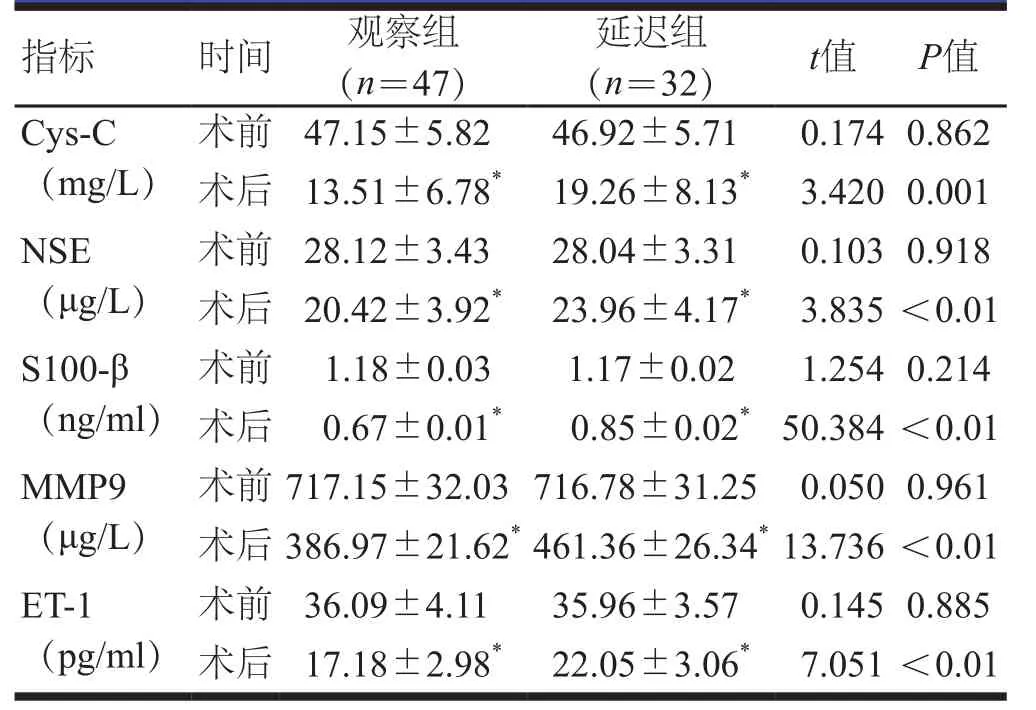
表2 手术前后两组患者血清神经与血管相关标志物水平的比较(±s)
注:与本组术前比较,*P<0.05
指标 时间 观察组(n=47)延迟组(n=32) t值 P值Cys-C(mg/L)术前 47.15±5.82 46.92±5.71 0.1740.862术后 13.51±6.78* 19.26±8.13* 3.4200.001 NSE(μg/L)术前 28.12±3.43 28.04±3.31 0.1030.918术后 20.42±3.92* 23.96±4.17* 3.835<0.01 S100-β(ng/ml)术前 1.18±0.03 1.17±0.02 1.2540.214术后 0.67±0.01* 0.85±0.02*50.384<0.01 MMP9(μg/L)术前717.15±32.03716.78±31.25 0.0500.961术后386.97±21.62*461.36±26.34*13.736<0.01 ET-1(pg/ml)术前 36.09±4.11 35.96±3.57 0.1450.885术后 17.18±2.98* 22.05±3.06* 7.051<0.01
2.3 血清炎性因子水平的比较
术前,两组患者的TNF-α、IL-6、CRP水平比较,差异均无统计学意义(P>0.05);术后3 d,两组患者的TNF-α、IL-6、CRP水平均高于本组术前,且观察组患者的TNF-α、IL-6、CRP水平均明显低于延迟组患者,差异均有统计学意义(P<0.01)。(表3)
表3 手术前后两组患者血清炎性因子水平的比较(±s)
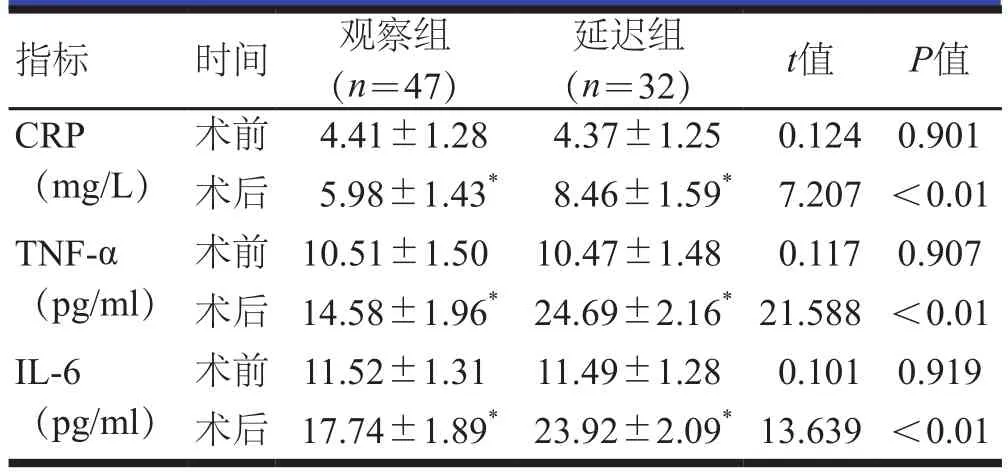
表3 手术前后两组患者血清炎性因子水平的比较(±s)
注:与本组术前比较,*P<0.05
指标 时间 观察组(n=47)延迟组(n=32) t值 P值CRP(mg/L)术前 4.41±1.28 4.37±1.25 0.124 0.901术后 5.98±1.43* 8.46±1.59* 7.207 <0.01 TNF-α(pg/ml)术前 10.51±1.50 10.47±1.48 0.117 0.907术后 14.58±1.96* 24.69±2.16*21.588 <0.01 IL-6(pg/ml)术前 11.52±1.31 11.49±1.28 0.101 0.919术后 17.74±1.89* 23.92±2.09*13.639 <0.01
2.4 术中出血量与术后并发症发生情况的比较
两组患者的术中出血量与术后意识障碍、肢体活动障碍、脑积水发生率比较,差异均无统计学意义(P>0.05);观察组患者术后再出血的发生率低于延迟组患者,差异有统计学意义(P<0.05)。(表4)

表4 两组患者术中出血与术后并发症发生情况的比较[n(%)]
2.5 临床疗效的比较
观察组患者的临床疗效优于延迟组患者,差异有统计学意义(Z=1.987,P=0.047)。(表5)

表5 两组患者的Rankin 分级情况[n(%)]
3 讨论
目前,IA的发病机制尚未完全清晰,临床上普遍认为IA的发病机制与患者的先天因素、后天病变所致颅内动脉壁发生的退行性病变相关[12-14]。IA具有较高的致残率与致死率,尤其是当其发生破裂后病情进展迅速,应及时给予治疗[15-16]。目前,主要采用手术治疗IA破裂。血管内介入栓塞术是IA破裂的主要微创术式,具有疗效确切、微创、术后易恢复等优势[17]。但关于手术时机的选择尚存在一定争议,认为应延迟行血管内介入栓塞术治疗的原因主要是IA破裂出血后可诱发颅内动脉痉挛,可在一定程度上影响介入导管的操作准确性,从而导致栓塞失败[18-19]。但血管痉挛的发生包括急性反应期与慢性反应期。急性反应期为破裂出血后的若干分钟以内且持续时间较短,不易被发现,而慢性反应期为破裂出血的3 d,持续时间较长。因此,通过完善术前检查确定患者未处于血管痉挛的急性期,则可在保障栓塞效果的前提下开展栓塞术。延迟开展栓塞术时,病情进展至血管痉挛的慢性期,此时凝血块溶解、血红蛋白释放,行栓塞操作会对血管造成刺激,加重血管痉挛程度,特别动脉痉挛可影响导丝的正常推进,从而影响栓塞效果。另外,延迟施术可致患者脑组织的损伤加重,不利于患者术后神经功能的恢复。
本研究结果表明,观察组患者的栓塞成功率高于延迟组患者,提示发病后72 h以内施术能够提高Ⅰ~Ⅲ级IA破裂患者的栓塞成功率。马修尧等[20]的研究认为早期与超早期行栓塞术治疗高级别IA破裂可获得更为良好的疗效,与本研究的结论可相互支持。本研究中,两组患者的Cys-C、NSE、S100-β、MMP9、ET-1水平均低于本组术前,且观察组患者的Cys-C、NSE、S100-β、MMP9、ET-1水平均低于延迟组患者,提示发病后72 h以内施术可有效减轻Ⅰ~Ⅲ级IA破裂患者的血管与神经功能损伤,并可更好地预防血栓形成。TNF-α、IL-6、CRP均是临床上常用的促炎因子,IA破裂与栓塞术损伤均可诱发炎性反应,使TNF-α、IL-6、CRP水平异常升高。本研究结果提示发病后72 h以内施术能够有效减轻Ⅰ~Ⅲ级IA破裂患者的炎性反应,这与早期施术有效减轻了患者脑组织、血管及神经组织的损伤有关。本研究亦发现,发病后72 h以内施术能够降低Ⅰ~Ⅲ级IA破裂患者的术后再出血发生率。两组患者其他术后并发症的发生率并无统计学差异,提示发病后72 h以内施术安全可行。通过出院前对比可知,观察组患者的临床疗效优于延迟组患者,提示发病后72 h以内施术可提高血管内介入栓塞术的临床疗效。
综上所述,发病后72 h以内采用血管内介入栓塞术治疗Ⅰ~Ⅲ级IA破裂,可提高栓塞效果和临床疗效,主要是通过减轻患者炎性反应,改善患者神经、血管、脑损伤等机制发挥这一作用,并可降低术后再出血发生率,手术时机的选择安全可行。
