主动脉夹层假腔远端动脉瘤样扩张与临床和基因的相关性
2021-03-10鲍贤豪马鹏程徐子依烨刘军军郭明金景在平冯家烜
许 鼎 鲍贤豪 张 恒 刘 鹏 马鹏程 徐子依 陆 烨刘军军 郭明金 冯 睿 景在平 冯家烜
1解放军海军军医大学第一附属医院血管外科,上海 200433
2青岛大学附属医院血管外科,青岛 266555
3上海市第一人民医院介入中心血管外科,上海 200940
主动脉夹层是一种威胁生命、易引起猝死的血管疾病,每年的发病率为0.05‰~0.30‰[1]。主动脉夹层分为Stanford A型(累及升主动脉)和Stanford B型(未累及升主动脉),其中Stanford B型通常采用血管腔内治疗。Stanford B型主动脉夹层患者的近端破裂口采用开放手术置换或腔内隔绝术治疗后,多数患者夹层假腔稳定,但文献显示,经过长期随访,每3例Stanford B型主动脉夹层患者经腔内隔绝术治疗后就有1例出现主动脉夹层假腔远端动脉瘤样扩张(distal aneurysmal expansion of false lumen of aortic dissection,DAEAD)[2],这表明主动脉夹层仍在进展,出现疼痛等症状,甚至出现DAEAD瘤腔压迫周围脏器形成梗阻。30.0%~62.5%的DAEAD患者在随访5年以上时需要再次治疗[3]。由于DAEAD解剖学的高度复杂性,当发生广泛累及内脏分支动脉的DAEAD时,无论采取开放手术还是腔内治疗都具有高风险。近期研究显示,可以采用平行支架技术进行腔内修复作为解决DAEAD的方法[4]。但这一技术通常花费高昂,同时也存在着内漏、分支动脉闭塞等缺点。有研究显示,DAEAD即使进行早期腔内干预,也无法避免高昂的花费,也存在术后并发症[5]。但是对于真正进展风险较高的患者,早期识别干预还是具有重要意义,因此需要对DAEAD的发病机制开展深入研究,本研究探讨DAEAD的遗传学风险,初步探索DAEAD进展的遗传学基础,从而为临床提供新的夹层进展风险评估指标,现报道如下。
1 资料与方法
1.1 一般资料
收集2013年4月至2020年10月解放军海军军医大学第一附属医院主动脉夹层近端破裂口治疗后患者外周血样本中的基因表达谱和影像等临床资料。根据随访转归情况分为DAEAD组和非DAEAD组。DAEAD患者纳入标准:(1)主动脉夹层(Stanford A型或B型)近端撕裂采用开放手术(Stanford A型夹层行升主置换或术中象鼻支架技术)、腔内治疗(支架移植物隔绝近端破裂口);(2)近端破裂口处理良好(无内漏、无逆撕Stanford A型夹层等),远端夹层动脉瘤继续进展,形成了胸降主动脉夹层动脉瘤、胸腹主动脉夹层动脉瘤或腹主动脉夹层动脉瘤;(3)夹层动脉瘤的主动脉最大直径>5 cm和/或迅速增大(5 毫米/6个月或1 厘米/年)。DAEAD患者排除标准:(1)交通事故、高空坠落等创伤因素引起的创伤性主动脉夹层;(2)非典型的主动脉夹层,如主动脉溃疡或壁间血肿;(3)缺少必要临床信息或不能提供随访期完整影像学资料。根据纳入排除标准,最终纳入12例DAEAD患者为DAEAD组。同期选取主动脉夹层近端破裂口治疗后假腔远端恢复良好患者为非DAEAD组患者,纳入标准:(1)主动脉夹层(Stanford A型或B型)近端撕裂采用开放手术(Stanford A 型夹层行升主动脉置换或术中象鼻支架技术)、腔内治疗(支架移植物隔绝近端破裂口)。(2)第1次手术治疗后随访,主动脉计算机断层扫描血管造影(computed tomography angiography,CTA)证实主动脉夹层假腔无进展或萎缩,甚至假腔完全消失。根据纳入和排除标准,最终纳入5例患者。两组患者临床特征比较,差异无统计学意义(P>0.05,表1),具有可比性。
1.2 资料收集
收集首次围手术期结果和并发症等相关信息。此外,使用Aquarius和CTA测量各主动脉裂口的位置和大小,测量真腔和假腔的长短径等夹层动脉瘤解剖数据。测量部位包括主动脉根部、主动脉弓部、降主动脉和腹主动脉。由成都奇恩生物技术公司进行基因测序。
1.3 样本处理和全外显子组测序
采用基因组DNA提取试剂盒(Invitrogen,美国)从患者外周血中提取外显子测序和变异体调用基因组DNA。使用SureSelect Human All Exon V6试剂盒(Agilent Technologies,美国)或Medical Exome v2(MyGenostics,中国)制备和捕获测序文库。使用NovaSeq或HiSeq-X测序系统在Illumina平台上对靶区域进行配对末端测序[6]。
对原始测序读数过滤,从而去除测序质量较低的读数。用BWA-MEM软件将清洗后的读数映射到人类参考基因组(Grch37)上,并用Picards(http://broadinstitute.github.io/picard)去除聚合酶链反应的重复序列[7]。变体调用通过4种基于单倍型的调用算法(Platypus、Samtools、6 FreeBayes和GATK单倍型调用者)中至少2种方法的一致调用来执行。用R软件包ExomeDepth分析基因拷贝数变异(copy number variations,CNV)。使用VEP软件进行变异注释,包括基因功能结果(基因背景、氨基酸变化、剪接效应等)[8]。致病性预测还采用多种计算方法(SIFT、Polyhen2、MutationTaster、CADD等 )。健康人群的健康对照组等位基因频率来自2个数据库:Exac(http://exac.broadinstitute.org/)和gnomAD(https://gnomad.broadinstitute.org/)[9]。
1.4 变异过滤与基因诊断
分析仅限于外显子、典型剪接位点和已知致病内含子区域内的变异。对变异进行筛选,只包括普通人群中罕见的变异[在gnomAD和Exac数据库中,最小的等位基因频率(minor allele frequency,MAF)≤0.001]。结合临床表型-基因关系的XREARE算法[10]和美国医学遗传学和基因组学(American College of Medical Genetics,ACMG)序列变异解释指南[11]被用于基因诊断的变异分类。重点研究了28个已知主动脉瘤和7个夹层相关的基因,并详细检查了这些基因中罕见的变异[12]。对于未知意义的变异的遗传,测试了主动脉瘤和夹层相关最重要的3条途径:细胞外基质(extracellular matrix pathway,ECM )途径、平滑肌细胞收缩(smooth muscle cell contraction,SMC )途径和转化生长因子-β(transforming growth factor-β,TGF-β )途径。对每条通路进行Kruskal-Wallis 检验,比较DAEAD患者中意义未明的基因突变(variant of undetermined significance,VUS)的数量与健康对照组中VUS变异的数量。
1.5 统计学方法
应用 SPSS 22.0 统计学软件进行统计分析,计数资料以n表示,组间比较采用Fisher确切概率法;非正态分布资料以M(P25,P75)表示,组间比较采用秩和检验;P<0.05为差异有统计学意义。
2 结果
2.1 围手术期结果
患者术后无截瘫,无内脏缺血等并发症和死亡。撕裂部位以降主动脉最多。DAEAD组和非DAEAD组在腹腔干平面真腔长径和短径、肠系膜上动脉平面真腔长径和短径及假腔长径和短径、左肾动脉平面真腔长径和短径、右肾动脉平面真腔长径和短径、肾下最大平面真腔长径和短径及假腔长径比较,差异无统计学意义(P>0.05);DAEAD组腹腔干平面、左肾动脉平面和右肾动脉平面的假腔长径和短径长于非DAEAD组,肾下最大平面的假腔短径长于非DAEAD组,差异有统计学意义(P<0.05,表2)。DAEAD组和非DAEAD组患者不同分支血管的真假腔比较,差异无统计学意义(P>0.05,表3)。
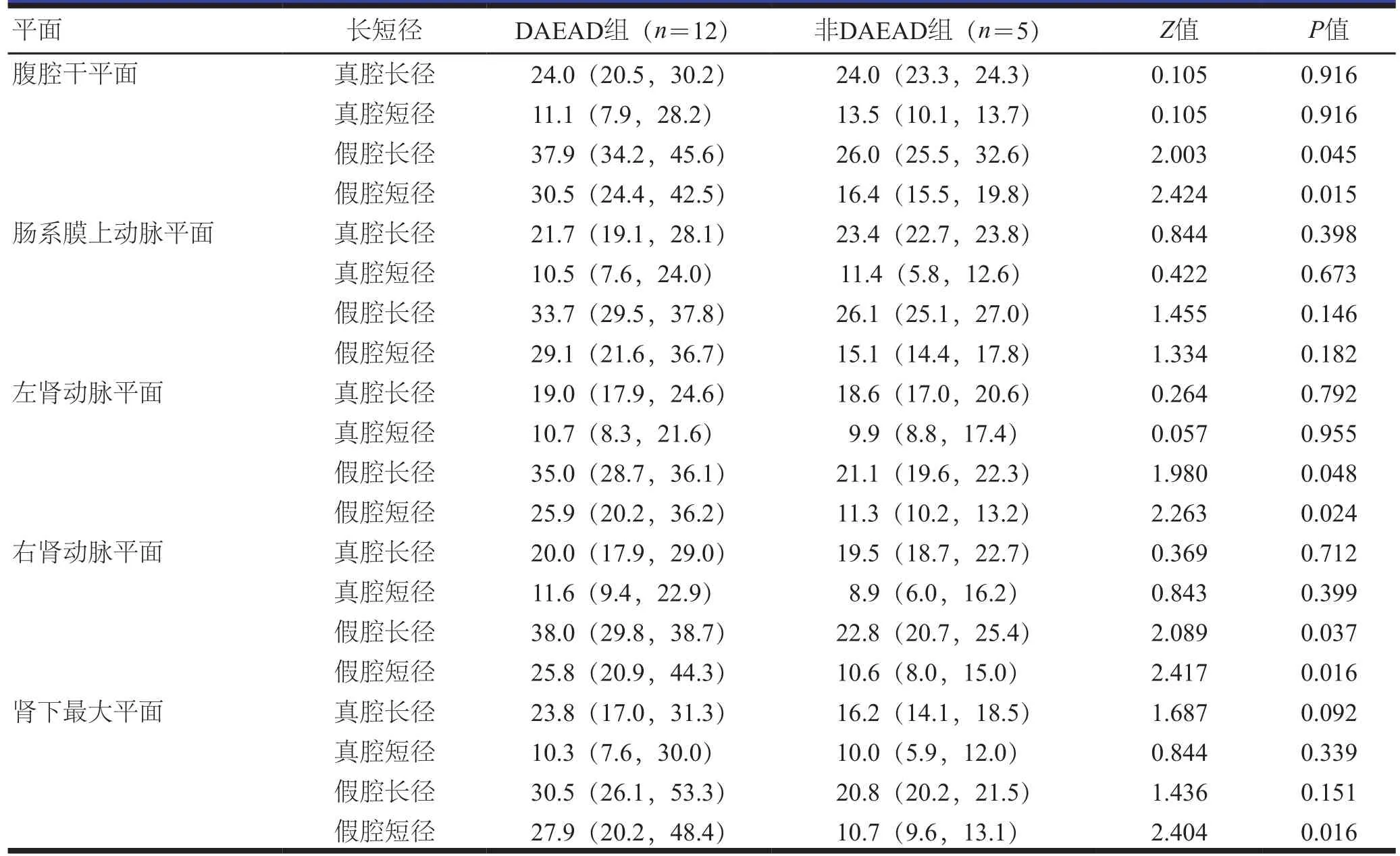
表2 DAEAD组和非DAEAD组患者不同平面的真假腔长短径比较[mm,M(P25,P75)]
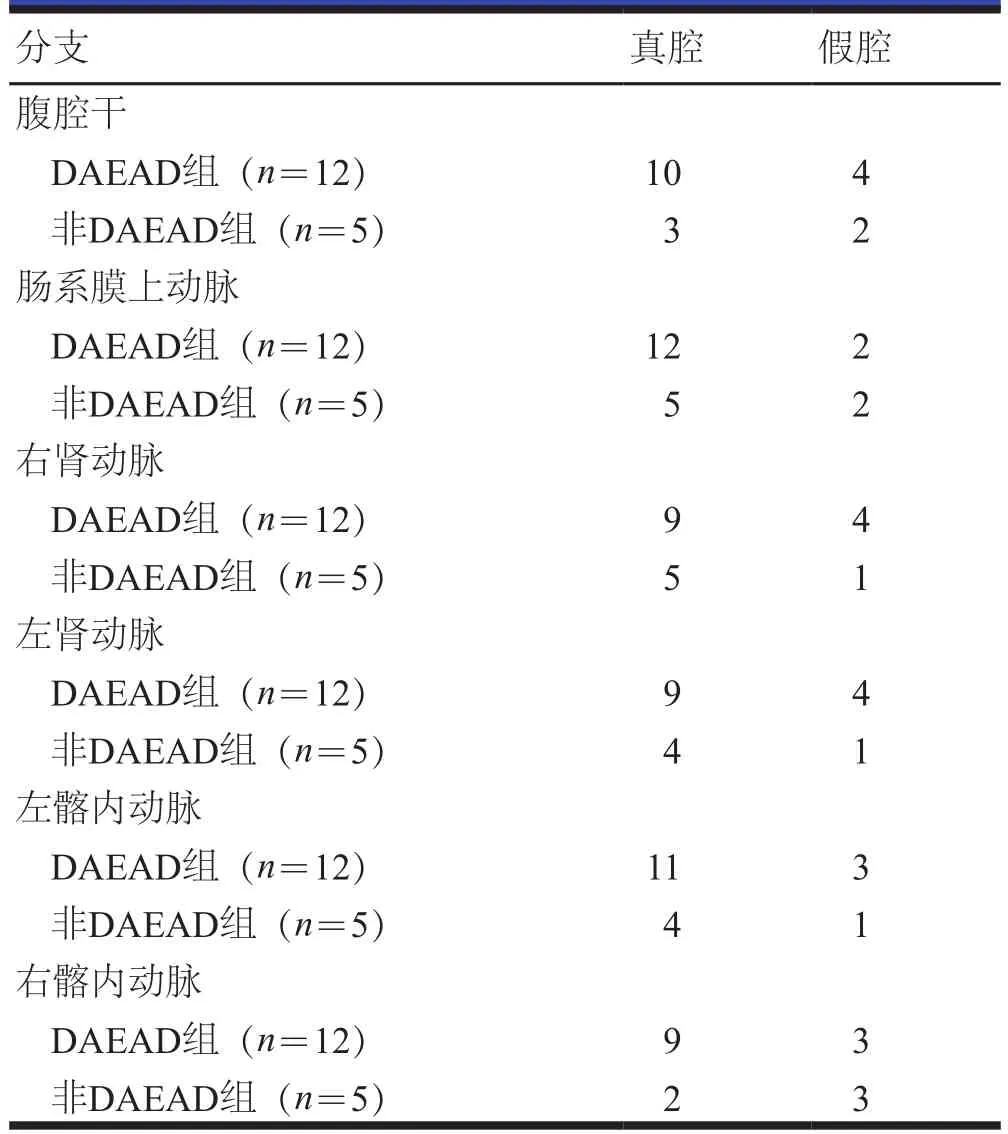
表3 DAEAD组和非DAEAD组患者不同分支血管的真假腔情况
2.2 DAEAD组与非DAEAD组的基因分析
2.2.1 全外显子组测序的致病变异
结合表型和遗传证据分析,在17例患者中发现共10个可能的致病/致病(likely pathogenic/ pathogenic,LP/P)变异和潜在未知意义的变异(variant of uncertain significance,VUS)(图1)。在DAEAD组患者中发现7个可能的致病/致病(likely pathogenic/pathogenic,LP/P) 变 异, 而 在 非DAEAD组中,没有发现致病变异。LP/P的变异体分布的基因[3个在原纤维蛋白-1(fibrillin 1,FBN1)中,2个在α-肌动蛋白(actin alpha 2,ACTA2)中,1个在转化生长因子β受体1(transforming growth factor beta receptor 1,TGFBR1)中,1个在转化生长因子β受体2(transforming growth factor beta receptor 2,TGFBR2) 中]。DAEAD组患者致病变异率为58.3%(7/12)。

图1 DAEAD组和非DAEAD组基因突变分布
2.2.2 潜在的未知意义的突变体
本研究获得7个LP/P变异外,还发现了3个潜在的未知意义的突变体。其中包括1例DAEAD患者在ClinVar数据库中报道的1个错义突变(ACTA2中的c.46T>C),1例DAEAD患者无菌α基序和组氨酸天冬氨酸结构域蛋白 1基因(sterile α motif and histidine-aspartate domain-containing protein 1,SAMHD1)突变(c.276-7A>G)以及腺嘌呤核苷三磷酸结合盒亚家族 C成员 6基因(adenosine triphosphate binding cassette subfamily C member 6,ABCC6)中的1个错义突变(c.4070G>A)。
进一步将VUS风险变量分析扩展到与主动脉瘤和夹层相关的3条重要途径中,结果显示,DAEAD组和非DAEAD组的ECM 途径的VUS变异多于健康对照组,差异有统计学意义(P<0.05)(图2);DAEAD组、非DAEAD组和健康对照组的SMC途径和TGF-β 途径的VUS变异比较,差异无统计学意义(P>0.05)(图3,图4)。

图2 DAEAD组、非DAEAD组和健康对照组的ECM途径的VUS变异情况
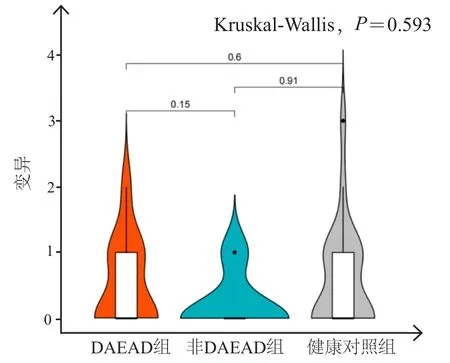
图3 DAEAD组、非DAEAD组和健康对照组SMC途径的VUS 变异情况

图4 DAEAD组、非DAEAD组和健康对照组的TGF-β 途径的VUS变异情况
3 讨论
随着主动脉夹层患者急性期开放手术治疗和微创腔内治疗技术和器具的发展,近端破裂口治疗的成功率显著提高。而近端破裂口治疗后的随访中,远端夹层继续进展为DAEAD的风险成为主动脉夹层研究的热点。DAEAD是一种需要及时治疗的疾病,因其病情复杂,预后不良,不管是胸腹主动脉置换的开放手术、杂交手术,还是腔内修复(八爪鱼技术、分支型移植物、开窗型移植物等),都难度较高和风险较大,且远期疗效仍需要进一步评估。因此,针对主动脉夹层治疗后仍是高危且可进展至DAEAD的患者需要进行早期干预,目前已成为临床亟需解决的问题。据报道,急性或亚急性期主动脉夹层腔内治疗后的主动脉重塑优于慢性主动脉夹层[13]。而DAEAD的形成原因也被广泛讨论,比如腔内移植物过短[14]和远端胸主动脉或腹主动脉大破裂口[15]也可能与DAEAD有关。
本研究结果显示,撕裂部位以降主动脉居多,DAEAD组腹腔干平面、左肾动脉平面和右肾动脉平面的假腔长径和短径长于非DAEAD组,肾下最大平面的假腔短径长于非DAEAD组,该现象可能与其在各分支区的血流动力学有关,也有可能与两组患者基因相关。但DAEAD组和非DAEAD组患者临床特征比较,差异无统计学意义,表明无法根据临床特征发现主动脉夹层近端破裂口治疗后患者是否会进展至DAEAD。结合表型和遗传证据分析,在17例主动脉夹层近端破裂口治疗后患者中发现10个致病变异、新的致病变异和潜在的未知意义的变异,根据ACMG指南证据水平,在DAEAD组患者中发现了7个可能的LP/P变异,而在非DAEAD组中,没有发现致病变异。DAEAD组患者致病变异率为58.3%,这一致病变异率与之前报道的主动脉瘤和夹层全外显子测序结果相比显著增高[16-18]。这是针对遗传因素对DAEAD发生的影响的报道,这有助于从遗传基因的角度去分析主动脉夹层近端破裂口治疗后患者的病因和预后,尤其是DAEAD发生发展的遗传病因,这有利于为主动脉夹层近端破裂口治疗后患者提供病因、预后和制定整体临床治疗策略的、更全面的、更关注远期疗效的数据和证据。
本研究遗传分析显示,LP/P的VUS主要分布于FBN1和ACTA2中,ACTA2相关的家族性胸主动脉6型是自体显性,临床表现包括升主动脉夹层、主动脉瘤、早期冠心病和烟雾现象。OMIM数据报道,ACTA2相关突变导致家族性胸主动脉瘤6型[19-20]。2007年,Guo等[21]研究显示,主动脉瘤合并主动脉夹层的家族中发现了ACTA2杂合突变Arg149CyS(RS121434526)。2009年,另一项研究显示,45例Arg149Cys突变患者中,24例患有胸主动脉瘤和主动脉夹层,12例患有冠心病[21]。这些临床发现均高度提示ACTA基因突变与主动脉病变的发生发展密切相关,针对其基因突变位点和类型仍需要深入研究。
FBN1基因突变是马方综合征的致病基因。1991年,在马方综合征患者中发现了第1例纤维蛋白原基因突变,并证实15号染色体上的纤维蛋白基因位点的突变与马方综合征有关[22]。目前已在马方综合征患者中发现了41 500个FBN1突变[23],许多FBN1等位基因突变通过显性-负效应导致马方综合征。马方综合征是一种全身性结缔组织病,主要累及眼、骨和心血管系统,具有高度的临床特异性。其中,心血管系统异常是马方综合征患者早期死亡的主要原因,包括升主动脉扩张、二尖瓣脱垂伴/不伴反流、三尖瓣脱垂、主动脉夹层和近端肺动脉扩张等。
主动脉夹层和动脉瘤疾病的遗传风险是复杂的[24]。这类疾病可能由于单基因遗传疾病中的高渗透性致病变异(如马方综合征中的FBN1基因),也可能是多基因中低渗透性VUS“风险变异”的联合作用[25-26]。本研究进一步分析基因突变和表达显示,将VUS风险变量分析扩展到与主动脉瘤和夹层相关的3条重要途径,ECM 途径,SMC 途径,TGF-β途径。DAEAD组和非DAEAD组的ECM 途径 VUS变异多于健康对照组,差异有统计学意义;这表明本研究对于主动脉夹层发生发展的基因突变仍需要进行更深入的研究,这些VUS突变可能会揭示新的主动脉夹层致病基因或是基因突变组合。
通过对主动脉瘤或夹层患者进行外显子全序列基因检测,可以准确地识别已知相关基因中的致病变异(包括以前报道的和识别新的相关变异)。本研究报道DAEAD这一主动脉夹层近端破裂口治疗后不良预后的遗传基因突变相关性的研究,提示了基于基因检测对主动脉夹层患者的临床意义。对于基因检测发现的携带高危致病基因突变的患者,可能需要更加加强随访,如半年一次,发现有DAEAD进展趋势,早期干预以简化治疗,阻断病理进展。在局限性方面,DAEAD组和非DAEAD组的患者数量较少,这是因为这一项初步研究在开始之初,为了确保患者确实是远端进展高危患者或是远期预后良好的患者,必须有长期随访的影像学支持,而且要有典型的测量数据和临床症状支持,从而严格入组,相当一部分难以判断其远期转归的患者排除在外。而在临床危险因素分析方面,影响DAEAD发生与否的因素仍不明确,可能不局限于本研究所分析的参数。
综上所述,本研究提示一些已知主动脉疾病的致病基因不仅与主动脉夹层发病有关,而且与其远期进展的不良预后有关。
