天麻总酚抗大鼠脑缺血再灌注损伤的转录组学分析及实验验证
2021-03-09夏霜莉张冰琳
夏霜莉,王 维,张冰琳,廖 陈,林 青,代 蓉
云南中医药大学 药理教研室,云南 昆明 650500
缺血性脑卒中(ischemic stroke)的发病率占所有脑血管疾病的60%~80%,具有较高的致残率和致死率,严重危害了人类的健康[1-2]。脑缺血再灌注损伤(cerebral ischemic reperfusion injury,CIRI)是IS 后重要的病理损伤之一,涉及氧化应激损伤、血脑屏障破坏、能量代谢异常和离子代谢紊乱等一系列复杂的病理过程[3-4]。课题组前期研究表明,天麻总酚(total polyphenols ofGastrodia elata,TPGE)中的多个酚性成分存在协同增效的作用,可通过干预CIRI 病理过程中的炎症反应、神经细胞凋亡、神经修复、血管新生等环节改善脑微环境[5-9]。由此可见,从单一角度去研究TPGE 抗CIRI 的作用难以完整地阐释其作用机制。随着近年来基因组学、转录组学、蛋白组学等组学技术的迅速发展,研究更注重生物系统的整体性,以反映机体在病理状态以及药物干预之后整体状态的变化。基于中药多成分、多靶点的特点,本研究借助转录组测序(RNA sequencing,RNA-seq)技术从基因水平进行研究,探寻正常、病变以及药物干预后组织中的差异表达基因,并对测序结果进行生物信息学分析及验证,以期阐明TPGE 改善CIRI 预后的可能靶基因及相关通路,进而阐明TPGE 治疗CIRI 的分子作用机制。
1 材料
1.1 动物
成年SPF 级雄性SD 大鼠,体质量250~300 g,8~10 周龄,共30 只,由成都达硕实验动物有限公司提供,许可证号SCXK(川)2015-030。适应性喂养1 周,自由进食进水,室温22~26 ℃,湿度55%,定时通风换气,模拟标准昼夜系统即12 h 光照/12 h 黑夜。实验中所有操作均获得云南中医药大学实验动物伦理委员会的批准(批准号R-06202003)。
1.2 药品、试剂
天麻购自云南省昭通市彝良县原生态天麻种植专业合作社,经云南中医药大学中药鉴定教研室张洁副教授鉴定为兰科植物天麻Gastrodia elataBlume 的干燥块茎;脑中动脉栓塞/再灌注损伤( middle cerebral artery embolization/reperfusion injury,MCAO/R)线栓(批号2838-50/A4,北京西浓科技有限公司);异氟烷(批号2017180101,瑞沃德生命科技有限公司);TRIzol(批号T101100,上海美吉生物医药科技有限公司公司);三氯甲烷(批号0706106,上海申博化工);异丙醇(批号20170901,天津市风船化学试剂科技有限公司);RNA 逆转录试剂盒(批号R123-01,赛默飞世尔科技公司);定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)检测试剂盒(批号31598800,Roche 公司)。
1.3 仪器
Illumina HiSeq 6000 型测序仪(美国Illumina公司);Centrifuge 5424 R 型低温离心机(德国Eppendorf 公司);Agilent Technologies 型生物分析仪2100 系统(美国CA 公司);V1824301 型小动物麻醉机(美国Matrx 公司);Microm HM 型石蜡切片机(日本Thermo 公司);Ti-S 倒置显微镜(日本尼康公司);XS125A 型赛多利斯分析天平(北京赛多利斯仪器系统有限公司)。
2 方法
2.1 TPGE 的制备及剂量设置
取干燥天麻500 g 粉碎,置于回流冷凝装置中,用3 倍生药量95%乙醇溶液浸取3 次,浸取时间为2、1、0.5 h,合并3 次滤液,回收乙醇,得总浸膏即为TPGE(经HPLC 测得天麻素质量分数为0.35%,对羟基苯甲醇质量分数为0.46%)。前期药效学实验分为TPGE 高(7.29 g/kg)、低(1.74 g/kg)2 个剂量组,连续ig 给予TPGE 14 d 后,结果显示高剂量组具有显著抗CIRI 的作用。故本实验选择7.29 g/kg 剂量,按提取率3.6%折算得本实验TPGE的剂量为262.3 mg/kg。
2.2 模型的制备[10-11]
大鼠ip 10%水合氯醛(3 mL/kg)麻醉,翻正反射消失后仰卧固定于手术台,手术过程中用智能恒温控制仪维持大鼠肛温37 ℃,颈部剃毛并进行常规消毒,在颈正中偏左0.5 cm 处纵切口长约1.5 cm,分离右侧颈总动脉,栓线经颈总动脉、颈内动脉插入大脑中动脉,微遇阻力时停止,栓线插入深度为18~20 mm,记录大鼠脑缺血开始时间,缺血2 h 后,将线栓缓慢拔出以恢复缺血区供血造成再灌注,涂抹青霉素后缝合伤口。假手术组不插入线栓,其余手术操作相同。在缺血及再灌注期间保持室温在25~30 ℃。
2.3 分组与给药
将SD 大鼠随机分为假手术组、模型组、TPGE组(262.3 mg/kg),每组10 只,于再灌注后6 h 首次ig 给予TPGE,给药体积均为1 mL/100 g 体质量,1 次/d,连续14 d,假手术组与模型组ig 给予同体积溶媒。30 只动物均进行神经行为学评分,其中每组随机选择3 只大鼠进行转录组测序分析,每组随机选择4 只大鼠进行qPCR 实验验证。
2.4 神经行为学评分
依据 Longa 5 分法[11]、改良神经功能(neurological severity scores,NSS)评分法[12]、平衡木行走实验、攀绳实验和步态分析[13-16],对大鼠神经功能及神经损害程度进行评分。
2.5 RNA-seq 转录组测序分析
麻醉后颈椎脱臼处死大鼠,手术获取各组大鼠缺血半球脑组织(含大鼠海马、纹状体、皮层区域),采用TRIzol 裂解液提取总RNA,利用RNA 6000 Nano kit检测试剂盒对所提RNA的浓度和纯度进行检测,RNA 浓度和纯度质检合格后,通过Oligo 磁珠富集带有poly A 尾的mRNA,以片段化的mRNA为模板,合成双链cDNA,对cDNA 进行末端修复、加A 尾并连接测序接头,进行片段大小选择,通过PCR 实验富集得到最终的cDNA 文库。最后在流动槽的各通道中加入cDNA 文库,使用Illumina HiSeq 6000 测序仪进行测序分析,计算质量分值。
2.6 基因本体(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析
对转录组测序的原始数据(raw data)进行过滤,筛选得到高质量数据信息,设定阈值为显著性水平P<0.05 和差异倍数︱log2Fold change︱≥2,对9个样品中的mRNA 进行差异基因的筛选。以大鼠全基因组为背景和参照,以P<0.05 为标准,对差异基因进行GO 富集分析和KEGG 代谢通路富集分析,从而获取关键通路信息,并通过R 语言将相关信息进行可视化。
2.7 qPCR 验证检测
取各组大鼠缺血半球脑组织标本,液氮速冻,−80 ℃保存至使用。用qPCR 验证预测的关键差异基因:Toll 样受体9(Toll-like receptor 9,TLR9),髓样分化因子88(myeloid differentiation factor 88,MyD88),核转录因子-κB(nuclear factor kappa B,NF-κB),肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α),单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1),白细胞介素-1β(interleukin-1β,IL-1β),白细胞介素-6(interleukin-6,IL-6),自噬相关基因Becn-1、P62,凋亡调节因子LC-3、LC3 I/II,半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,Caspase-3)和Bcl 2 相关X 凋亡调节因子(Bcl 2 associated X apoptosis regulator,Bax)。根据试剂盒说明书操作,使用TRIzol 提取脑组织中的总RNA,随后进行逆转录合成 cDNA。以 3-磷酸甘油醛脱氢酶( glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内源性参照基因,定量检测目的基因的表达水平。各引物序列见表1。反应条件为95 ℃变性15 s,60 ℃退火1 min,反应完毕,使用2-ΔΔCt法计算各基因的相对表达量。
3 结果
3.1 TPGE 对MCAO/R 模型大鼠行为学的影响
实验结果表明,与假手术组比较,模型组大鼠再灌注14 d Longa 5 分法、NSS 评分、平衡木行走实验、攀绳实验、步态分析实验评分均升高,差异具有统计学意义(P<0.01、0.001);与模型组比较,TPGE 组再灌注14 d Longa 5 分法、NSS 评分、平衡木行走实验、攀绳实验、步态分析实验评分均降低,差异具有统计学意义(P<0.05、0.01),提示TPGE 可改善CIRI 引起的神经功能损伤,恢复大鼠平衡能力,减轻恢复早期对称自体感觉缺失情况,提高大鼠恢复期前肢的运动协调能力(表2)。
3.2 RNA-seq 转录组测序分析
3.2.1 测序数据质量评估 本实验所建立的测序文库中,9 个样品的原始数据在4.5×107~6.1×107,总计5.01×108。每个cDNA 文库平均获得5.5×107个原始数据,对应于73.99 Gb 的原始数据。经过原始数据过滤后,约有4.95×108(98.9%)的原始数据作为高质量的读段(clean reads)被保留下来。9 个样品的reads差异较小,质量值≥20 的碱基所占百分比(Q20)≥97.43%,质量值≥30 的碱基所占百分比(Q30)≥92.82%,表明测序结果较好,可用于后续的分析(表3)。

表1 待测靶基因引物序列Table 1 Primer sequences of target genes to be measured
表2 TPGE 对MCAO/R 模型大鼠行为学的影响 (±s,n=10)Table 2 Effects of TPGE on behavioral change in MCAO/R model rats (±s,n=10)
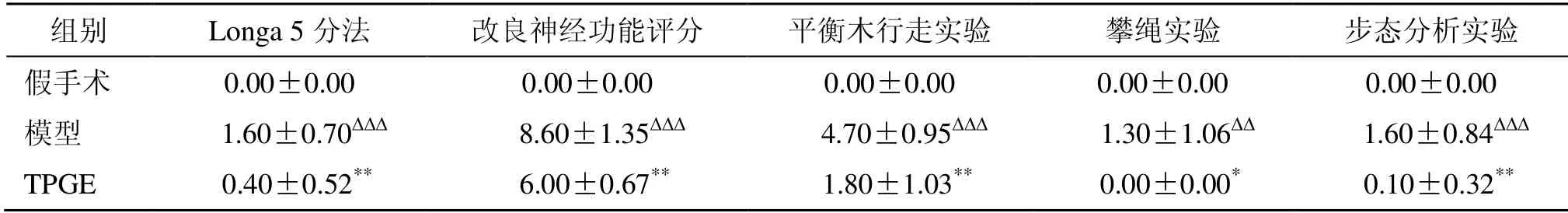
表2 TPGE 对MCAO/R 模型大鼠行为学的影响 (±s,n=10)Table 2 Effects of TPGE on behavioral change in MCAO/R model rats (±s,n=10)
与假手术组比较:∆∆P<0.01 ∆∆∆P<0.001;与模型组比较:*P<0.05 **P<0.01∆∆P < 0.01 ∆∆∆P < 0.001 vs sham group; *P < 0.05 **P < 0.01 vs model group
组别 Longa 5 分法 改良神经功能评分 平衡木行走实验 攀绳实验 步态分析实验假手术 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00模型 1.60±0.70∆∆∆ 8.60±1.35∆∆∆ 4.70±0.95∆∆∆ 1.30±1.06∆∆ 1.60±0.84∆∆∆TPGE 0.40±0.52** 6.00±0.67** 1.80±1.03** 0.00±0.00* 0.10±0.32**
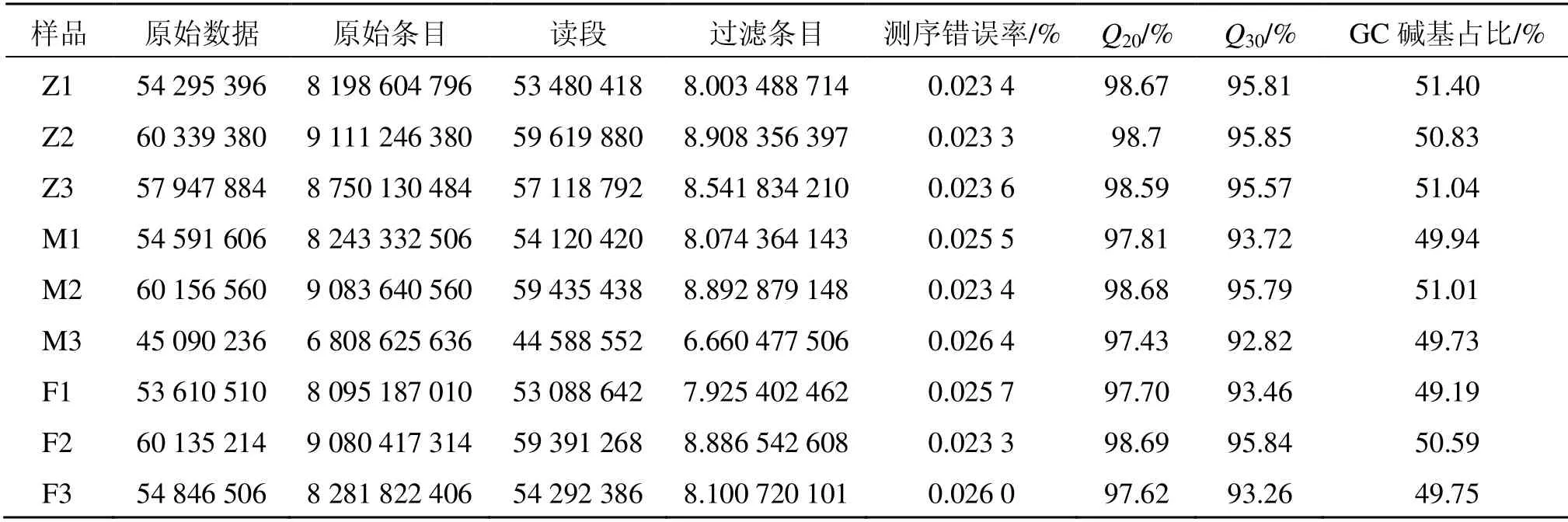
表3 各样本cDNA 文库测序数据Table 3 Sequencing data of each sample cDNA library
3.2.2 差异基因分析 采用DEseq 软件,筛选出具有统计学意义的差异表达基因(︱log2Fold change︱≥2,P<0.05)。数据分析结果表明(表4、5 和图1),与假手术组比较,模型组显著上调的差异基因为561 个,显著下调的差异基因为120 个;与模型组比较,TPGE 组显著上调的差异基因为10个,显著下调的差异基因为126 个。

表4 基因表达整体水平变化Table 4 Changes in overall level of gene expression
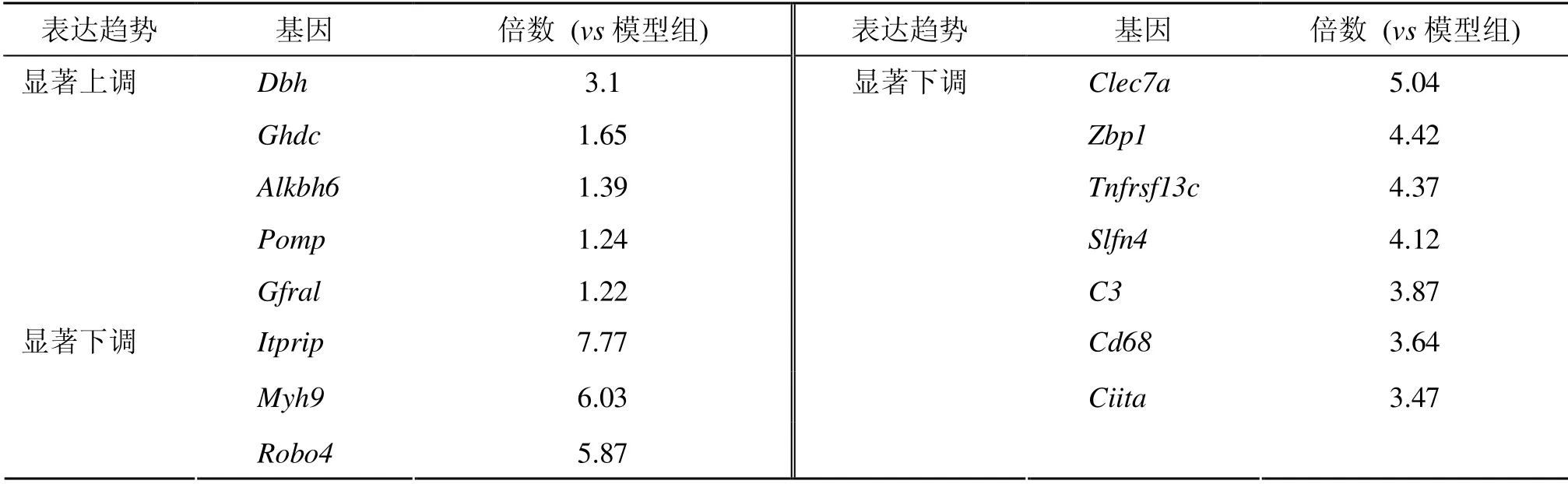
表5 TPGE 治疗CIRI 大鼠部分显著表达的差异基因Table 5 Some different significantly expressed genes in CIRI rats treated with TPGE
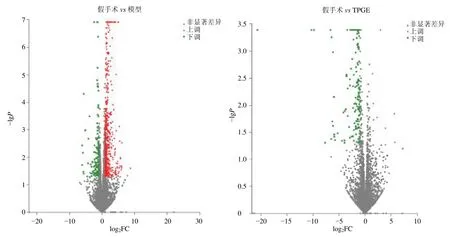
图1 差异表达的mRNA 火山图Fig.1 mRNA volcanogram of differential expression
3.3 GO 和KEGG 富集分析
对筛选出的136 个差异基因进行GO 和KEGG富集分析,并设置P<0.05 为筛选标准。GO 富集分析主要包括生物过程、细胞组分和分子功能,结果显示主要富集在免疫系统过程(immune system process)、炎症反应(inflammatory response)、调节刺激反应(regulation of response to stimulus)、调控肿瘤坏死因子的产生(regulation of tumor necrosis factor production)和调控Toll 样受体信号通路(regulation of Toll-like receptor signaling pathway)(图2)。KEGG 主要富集在NOD 样受体信号通路(NOD-like receptor signaling pathway)、Toll 样受体信号通路(Toll-like receptor signaling pathway)、趋化因子信号通路(chemokine signaling pathway)和肿瘤坏死因子信号通路(TNF signaling pathway),见图2。
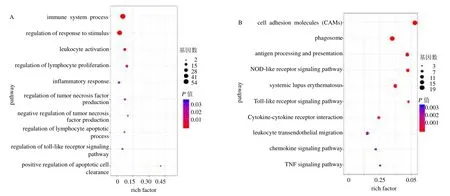
图2 TPGE 干预后差异基因的GO (A) 和KEGG (B) 富集分析Fig.2 Enrichment analysis of GO (A) and KEGG (B) of differential genes after TPGE intervention
3.4 TPGE 对MCAO/R 模型大鼠关键基因mRNA表达的影响
给予TPGE 14 d 后,以GAPDH为内参,采用qPCR 法对转录组测序分析结果的TLR-MyD88/NF-κB/TNF-α 通路中7 个炎症关键基因TLR9、MyD88、NF-κB、TNF-α、MCP-1、IL-1β、IL-6及与自噬相关的Becn-1、P62、LC-3、LC3-I/II及凋亡相关的Caspase-3、Bax关键基因进行mRNA 表达水平的验证。结果表明,与假手术组比较,模型组TLR9、MyD88、NF-κB、TNF-α、MCP-1、IL-1β、IL-6、Becn-1、P62、LC-3、LC3-I/II、Caspase-3、BaxmRNA 的表达上调,差异有统计学意义(P<0.05、0.01、0.001、0.000 1);与模型组比较,TPGE可降低MyD88、NF-κB、TNF-α、MCP-1、IL-1β、P62、LC-3、LC3-I/II、BaxmRNA 的表达,差异有统计学意义(P<0.05、0.01、0.001、0.000 1),TLR9、IL-6、Becn-1、Caspase-3mRNA 的表达有下降趋势,差异无统计学意义(P>0.05),见表6。
表6 TPGE 对MCAO/R 模型大鼠关键基因mRNA 表达的影响 (±s,n=4)Table 6 Effects of TPGE on mRNA expression of key genes in MCAO/R model rats (±s,n=4)
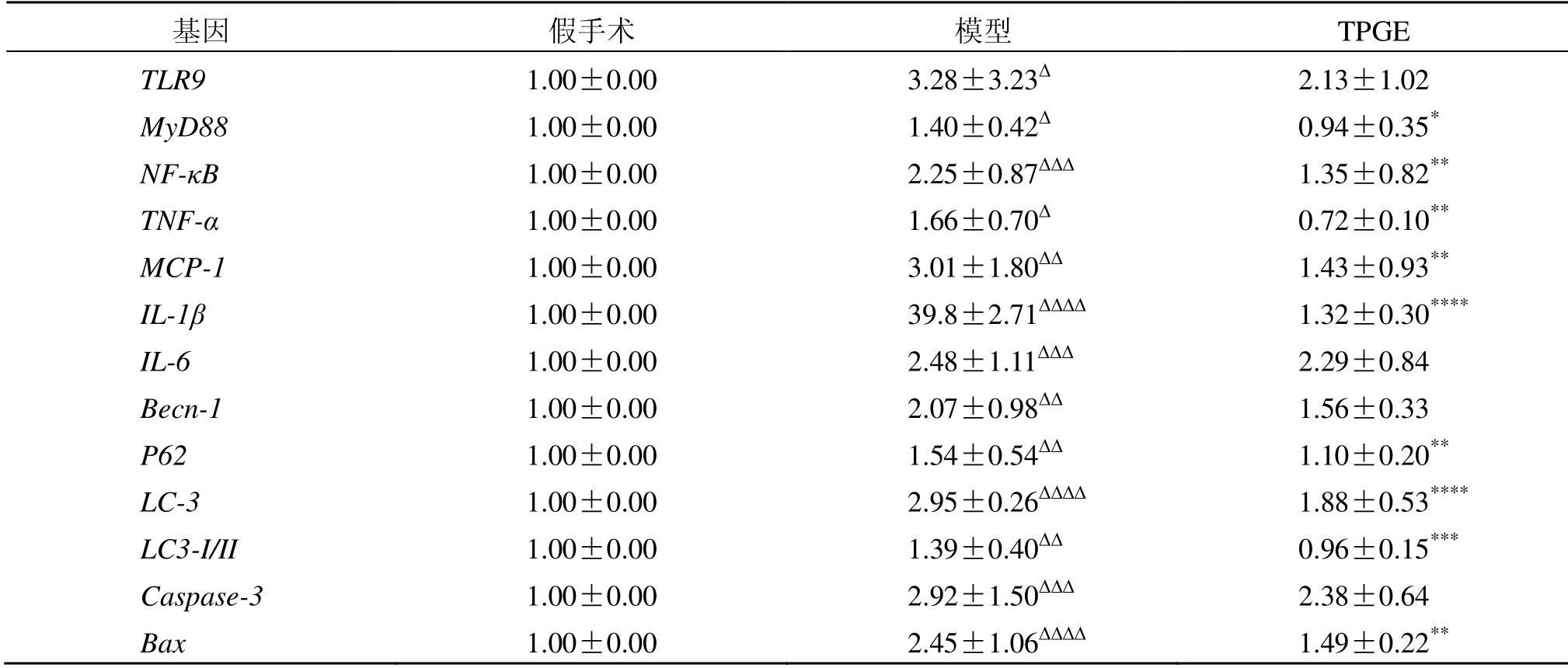
表6 TPGE 对MCAO/R 模型大鼠关键基因mRNA 表达的影响 (±s,n=4)Table 6 Effects of TPGE on mRNA expression of key genes in MCAO/R model rats (±s,n=4)
与假手术组比较:∆P<0.05 ∆∆P<0.01 ∆∆∆P<0.001 ∆∆∆∆P<0.000 1;与模型组比较:*P<0.05 **P<0.01 ***P<0.001 ****P<0.000 1∆P < 0.05 ∆∆P < 0.01 ∆∆∆P < 0.001 ∆∆∆∆P < 0.000 1 vs sham group; *P < 0.05 **P < 0.01 ***P < 0.001 ****P < 0.000 1 vs model group
基因 假手术 模型 TPGE TLR9 1.00±0.00 3.28±3.23∆ 2.13±1.02 MyD88 1.00±0.00 1.40±0.42∆ 0.94±0.35*NF-κB 1.00±0.00 2.25±0.87∆∆∆ 1.35±0.82**TNF-α 1.00±0.00 1.66±0.70∆ 0.72±0.10**MCP-1 1.00±0.00 3.01±1.80∆∆ 1.43±0.93**IL-1β 1.00±0.00 39.8±2.71∆∆∆∆ 1.32±0.30****IL-6 1.00±0.00 2.48±1.11∆∆∆ 2.29±0.84 Becn-1 1.00±0.00 2.07±0.98∆∆ 1.56±0.33 P62 1.00±0.00 1.54±0.54∆∆ 1.10±0.20**LC-3 1.00±0.00 2.95±0.26∆∆∆∆ 1.88±0.53****LC3-I/II 1.00±0.00 1.39±0.40∆∆ 0.96±0.15***Caspase-3 1.00±0.00 2.92±1.50∆∆∆ 2.38±0.64 Bax 1.00±0.00 2.45±1.06∆∆∆∆ 1.49±0.22**
4 讨论
MCAO/R 模型可引起大鼠海马、纹状体、皮层等区域的神经元损伤,导致感觉运动功能障碍,可模拟人CIRI 时感觉运动能力损伤,通过行为学评价可评估大鼠的感觉运动功能,预测脑损伤程度并进行药效评价[17]。Longa 5 分法可从整体上反映动物神经损伤程度,进行定性和半定量的评价,结合平衡木行走实验、攀绳实验、步态分析实验行为学评分可判断运动功能的整合性、协调性,综合评价感觉运动能力。本实验观察TPGE 对MCAO/R 模型大鼠干预14 d 的作用,与模型组比较,TPGE 组Longa 5 分法、NSS 评分法、平衡木行走实验、攀绳实验、步态分析实验行为学评分显著降低(P<0.05、0.01),表明TPGE 可减轻MCAO/R 模型大鼠的神经元损伤,促进运动功能恢复。
转录组学能从整体水平上探索细胞中所有基因转录及转录调控规律,通过基因表达比较正常、病变以及药物干预后的组织中大量相关基因的差异表达,以明确药物的主要作用靶点。本实验采用RNA-seq 高通量测序技术对假手术组、模型组、TPGE 干预14 d 组大鼠脑组织进行转录组测序,确定了在TPGE 作用下CIRI 大鼠缺血侧脑组织较为全面、动态的基因含量变化过程。通过对模型组与假手术组及TPGE 组与模型组数据进行深度挖掘分析,在2 个组合的差异表达基因中,找到了136 个重叠基因,对这些差异基因进行GO 功能注释和KEGG 通路富集分析,结果表明,模型组与假手术组比较,转录组数据分析共筛选出681 个差异表达基因,其中显著上调的差异基因为561 个,显著下调的差异基因为120 个;TPGE 干预后,可回调136个差异基因,其中,显著下调的差异基因为126 个,显著上调的差异基因为10 个,分析得到Itgam、Tnfsf13b、Itgb2、Cd86、Cxcl16、Cxcl10、Irf7、Tlr4、Csf2rb、Csf3r、TLR9等核心差异基因;差异基因显著富集于炎症反应、凋亡反应,趋化因子、肿瘤坏死因子、Toll 样受体等信号通路,提示TPGE 可能通过调控TLR9、MyD88、NF-κB等多个基因参与CIRI 后炎症、凋亡、自噬等修复过程。
已有的大量研究表明炎性损伤在CIRI 的发生和发展中起关键作用[18-19]。过度炎症反应是缺血后脑损伤重要的病理生理机制,脑缺血后小胶质细胞被激活,局部趋化因子、黏附分子及炎症因子表达上调促进了缺血性损伤向炎症性损伤转化[20]。近年研究发现,先天免疫系统的重要组成部分Toll 样受体(Toll-like receptors,TLRs)通过参与炎症反应介导了缺血性损伤,TLR9 是Toll 样受体家族的重要成员,定位在细胞内的内涵体膜上,在中枢神经系统中TLR9 主要表达于小胶质细胞,TLR9 可通过Toll/IL-1 受体结构域结合MyD88 衔接子样接头蛋白MAL(也称为TI-RAP),从而识别和募集MyD88,使 IL-1 受体相关激酶(IL-1 receptorassociated kinases,IRAKs)磷酸化,然后与下游的肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated factor 6,TRAF6)相互识别作用,从而激活NF-κB 信号通路,促进NF-κB 进入细胞核,增加促炎基因的转录与表达,促进炎症因子如TNF-α、IL-1 和IL-6 的释放,启动并放大炎症反应[20-23]。上调的炎症因子反过来可刺激NF-κB 的再次活化,引起炎性损伤,导致细胞凋亡,从而进一步加重脑损伤,因此应用药物抑制由于脑梗死导致的NF-κB 相关信号通路的激活,可减轻过度炎症反应所引起的神经元损伤[21-23]。本研究选取TLR-MyD88/NF-κB/TNF-α 通路中7 个关键基因TLR9、MyD88、NF-κB、TNF-α、MCP-1、IL-1β、IL-6及与自噬相关的Becn-1、P62、LC-3、LC3-I/II及凋亡相关的Caspase-3、Bax关键基因进行qPCR 验证。结果表明,模型组与假手术组相比TLR9、MyD88、NF-κB、TNF-α、MCP-1、IL-1β、IL-6mRNA 表达升高,提示MCAO/R 模型大鼠TLRs/NF-κB 信号通路被激活,引起了过度炎症反应,导致脑缺血损伤;TPGE 干预后MyD88、NF-κB、TNF-α、MCP-1、IL-1βmRNA 的表达显著减少,TLR9、IL-6mRNA 的表达有下降的趋势,提示TPGE 可通过抑制MyD88/NF-κB/TNF-α 信号通路减少相关炎症因子在缺血脑组织中的表达,发挥脑保护作用。MyD88上游的TLR9水平只有下降的趋势,因TLR2、3、4、7、9都可通过MyD88 依赖性和非依赖性信号传导途径激活脑缺血后的炎症通路,验证与分析的差异表明存在作用于其他TLRs的可能性,后续将继续进行研究。
脑缺血后炎症反应与细胞自噬和凋亡之间存在密切联系,多种TLR 通过连接蛋白MyD88 的配体在诱发炎症反应的同时,能够诱导细胞自噬,自噬激活对CIRI 的作用是双向的,在脑缺血的最初阶段,自噬作为一种修复机制,被激活以后可以消除在神经元细胞内积累的受损蛋白。然而,自噬被过度激活后,可促进细胞凋亡[22-23]。损伤变性、坏死或者凋亡的细胞这些危险信号刺激NF-κB 的再次活化,形成恶性循环[24-25]。Becn-1、P62、LC3是参与自噬的关键蛋白,调节自噬小体的形成和发展,是自噬检测的重要指标。LC3 包括LC3-I 和LC3-II 两种存在形式,LC3-I 与LC3-II 的比值改变可间接判断自噬是否发生,其比值下降提示自噬活性减弱;反之则说明自噬活性增强[26]。Bax 是促凋亡蛋白,可使线粒体的通透性增加,进而释放细胞色素C 进入细胞质,最终激活Caspase-3 后造成细胞凋亡。Caspase 家族是凋亡过程中最重要的蛋白酶,凋亡的最后实施是通过Caspase 的激活引发的“瀑布式”的级联反应而实现的,而Caspase-3 是Caspase 级联反应中下行的最重要的凋亡执行蛋白酶,在不同程序启动的细胞凋亡过程中起最后的“触发点”作用[27]。激活的Caspase-3 可以通过裂解DNA 依赖的蛋白激酶、细胞骨架蛋白及其他Caspase相关底物蛋白等机制,改变细胞结构,最终导致细胞凋亡的发生,加重了CIRI 的病理过程[28]。本研究结果表明,与假手术组比较,模型组Becn-1、P62、LC-3、LC3-I/II、Caspase-3、BaxmRNA 的表达上调;与模型组相比较,TPGE 可显著降低P62、LC-3、LC3-I/II、BaxmRNA 的表达,Becn-1、Caspase-3的表达有下降的趋势,提示TPGE 能够减轻由CIRI激活的自噬效应,抑制神经细胞凋亡,结合TPGE可抑制MyD88/NF-κB/TNF-α信号通路的作用机制,提示其作用可能与抑制该信号通路相关。
综上所述,研究表明TPGE 具有抗大鼠CIRI的作用,转录组学特征提示其抗CIRI 的关键差异基因及信号通路主要集中在炎症反应、自噬与凋亡、免疫应答过程,通过干预MyD88/NF-κB/TNF-α信号通路介导发挥作用。
利益冲突所有作者均声明不存在利益冲突
