基于HPLC指纹图谱结合化学模式识别的川芎炮制前后对比研究
2021-03-09张秋月曹丽珑赵婷婷张朔生王颖莉
裴 科,宁 燕,蔡 皓,郭 帅,张秋月,曹丽珑,赵婷婷,曹 岗,张朔生,王颖莉*
1.山西中医药大学中药与食品工程学院,山西省现代中药工程实验室,山西 晋中 030619
2.南京中医药大学药学院,国家教育部中药炮制规范化及标准化工程研究中心,江苏 南京 210023
3.浙江中医药大学药学院,中药炮制研究中心,浙江 杭州 310053
川芎(Chuanxiong Rhizoma,CR)为伞形科植物川芎Ligusticum chuanxiongHort.的干燥根茎,性温味辛[1],始载于《神农本草经》,被列为上品,具有活血行气、祛风止痛的功效。现代研究表明,川芎具有保护心脑血管[2]、抗肿瘤[3]、抗炎[4]、抗氧化[5]、保护神经系统[6]等药理作用,主要含有苯酞类[7]、生物碱类、有机酚酸及其酯类、多糖类等成分[8]。现《中国药典》收载的川芎饮片为生品川芎(rawChuanxiong Rhizoma,rCR),然而川芎的炮制历史悠久,据本草考证,酒炙川芎(wine processedChuanxiong Rhizoma,wpCR)自宋代以来一直沿用至今,酒炙能引药上行,增强川芎活血行气、散瘀止痛的作用[9-10]。川芎炮制后化学成分的变化是药效变化的重要因素[11-12]。有关川芎的炮制方法及炮制品的质量标准,《中国药典》还未进行收载,而且在《全国中药炮制规范》和各省、市、自治区的中药饮片炮制规范中对于川芎酒炙品的制备也只是简单表述,如黄酒拌匀,闷透,文火炒干。此外各地对于川芎酒炙过程中的监测指标及工艺的具体量化参数也没有统一标准。本研究根据“文火”的温度规定(80~120 ℃)以及前期条件的摸索,发现在实验条件下,100 ℃下炒制酒川芎,不易出现外焦里湿现象,且能达到饮片炒干颜色加深的效果。因此本实验的炮制不同程度均指100 ℃下的不同炒制程度。
中药指纹图谱技术是一种有效的中药质量评价方法,已被国内外广泛认可[13-14]。模式识别技术(pattern recognition)是化学计量学的重要组成部分,也是筛选中药质量标志物(Q-markers)的重要多元统计方法[15]。指纹图谱结合模式识别可有效对中药炮制前后的生品及制品进行判别分析和质量评价,并筛选出质量差异性成分[16-17]。
关于川芎药材指纹图谱的研究已有报道[18-20],但通过指纹图谱方法对川芎的炮制程度进行质量控制,并结合多元统计分析对生品和炮制品建模,且应用于炮制程度的判断还未见报道。本实验利用HPLC 法建立了川芎生品及不同程度炮制品的指纹图谱,对炮制前后的HPLC 指纹图谱进行对比,从整体水平表征炮制前后化学成分发生的变化。同时利用聚类分析(hierarchical cluster analysis,HCA)、主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)等模式识别方法,对生品和炮制品进行识别归类,并筛选导致二者差异性的主要标志物,为规范川芎炮制工艺提供新的视角,并为炮制品质量评价提供科学依据。
1 仪器与材料
1.1 仪器
e2695 高效液相色谱仪,包括2998 型PDA 检测器,Empower 工作站,美国Waters 公司;Hypersil Gold C18色谱柱(250 mm×4.6 mm,5 μm),赛默飞世尔科技有限公司;HC-2518 高速离心机,安徽中科中佳科学仪器有限公司;EX225D 十万分之一电子天平,上海奥豪斯仪器有限公司。
1.2 试剂
对照品阿魏酸(批号110773-201614,质量分数99.0%)购自中国食品药品检定研究院;对照品丁烯基苯肽(批号D-057-180321)、藁本内酯(批号G-010-171216)、洋川芎内酯A(批号Y-083-181011)、洋川芎内酯I(批号Y-085-181011)、阿魏酸松柏酯(批号A-001-171103),质量分数均>98.0%,均购自成都瑞芬思生物科技有限公司。雕王黄酒(批号GBIT13662,酒精度12%),绍兴吴越酿酒有限公司。甲醇、乙腈均为色谱纯,赛默飞世尔科技有限公司;水为超纯水,其余试剂均为分析纯。
1.3 试药
13 批生品川芎产地均为四川,来源于安国市万顺达药材行,批号分别为20190516、20190522、20190613、20190715、20190803、20190814、20190825、20190912、20190919、20191001、20191021、20191213、20191227,分别编号为rCR1~rCR13,其中10 批rCR1~rCR10 用来建立指纹图谱,并进行HCA、PCA 建模以及OPLS-DA 等,3批rCR11~rCR13 用来进行PCA 模型的预测;制备上述生川芎对应的最佳炮制时间下的酒川芎,分别编号为wpCR1~wpCR13,其中10 批wpCR1~wpCR10 用来建立指纹图谱,并进行HCA、PCA 建模以及OPLS-DA 等,3 批wpCR11~wpCR13 用来进行PCA 模型的预测;将批号为 20191021、20191213、20191227 的生川芎饮片分别制备炮制程度不及(炮制时间为10 min)样品,编号分别为wpCR11’~wpCR13’,以及炮制程度过度(炮制时间为 30 min)样品,编号分别为 wpCR14’~wpCR16’,用来进行炮制过程中炮制程度的建模控制。5 批市售酒川芎(marketed wine processedChuanxiong Rhizoma,mwpCR)产地也为四川,3批来源于亳州市谯城区康美中药材交易中心,批号分别为20201111、20201120、20201016,1 批来源于安徽广和中药股份有限公司,批号为200618,1批来源于揭阳市普宁市康美市场,批号为20200806,分别编号为mwpCR1~mwpCR5。植物基原经山西中医药大学中药与食品工程学院山西省现代中药工程实验室张朔生教授鉴定,均为伞形科藁本属植物川芎L.chuanxiongHort.的干燥根茎。
2 方法与结果
2.1 色谱条件
Hypersil Gold C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-0.3%甲酸水溶液,梯度洗脱:0~10 min,5%~30%乙腈;10~16 min,30%~40%乙腈;16~19 min,40%乙腈;19~60 min,40%~55%乙腈;60~64 min,55%~60%乙腈;64~68 min,60%乙腈;68~72 min,60%~90%乙腈;72~73 min,90%~100%乙腈;73~78 min,100%~5%乙腈;78~83 min,5%乙腈;检测波长254 nm;体积流量0.8 mL/min;柱温25 ℃;进样量10 μL。混合对照品及代表性样品(批号20190516)色谱图见图1。
2.2 酒炙川芎样品的制备
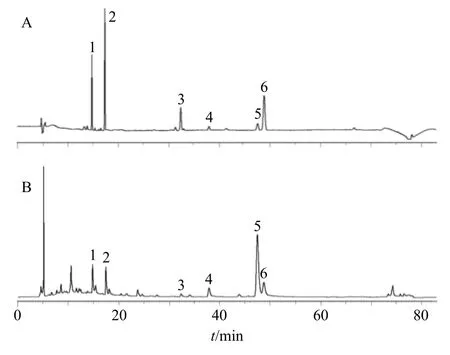
图1 混合对照品 (A) 及川芎酒炙品 (B) 的HPLC 图Fig.1 HPLC chromatogram of reference substances (A)and wine processed Chuanxiong Rhizoma (B)
称取生川芎饮片约200 g,加入黄酒拌匀,闷润至酒尽药透并分为7 份,其中1 份不经过加热炒制,在室温晾干(编号wpCR0min),其余6 份置于100 ℃炒制容器中分别炒制5、10、15、20、25、30 min,取出放凉备用(相对应的酒炙川芎编号为wpCR5min、wpCR10min、wpCR15min、wpCR20min、wpCR25min、wpCR30min)。不同炒制程度样品各制备10 批。
2.3 对照品及供试品溶液的制备
2.3.1 对照品溶液 取丁烯基苯酞、藁本内酯、洋川芎内酯A、洋川芎内酯I、阿魏酸、阿魏酸松柏酯对照品适量,精密称定,加甲醇溶解并稀释,摇匀,得到质量浓度分别为14.15、10.44、13.10、17.95、13.35、16.05 µg/mL 的混合对照品溶液。
2.3.2 供试品溶液 精密称取川芎生品及不同炮制品粗粉各约25 g,置于1000 mL 圆底烧瓶中,精密加入90%乙醇溶液500 mL,浸泡30 min,加热回流提取2 次,每次1.5 h,摇匀,滤过,合并滤液,减压浓缩,定容至50 mL 量瓶中,精密量取1 mL于10 mL 量瓶中,甲醇定容至刻度。进样前13 000 r/min 离心20 min,取上清液过0.22 μm 微孔滤膜,即得供试品溶液。
北京市已完成《关于规范提升邮政报刊亭的工作方案》,并提请市政府审议。方案提出了规范提升报刊亭的一揽子任务、措施,旨在将报刊亭打造成精致的城市家具、新型的阅读空间、便捷的服务载体。(据《北京青年报》11月4日报道)
2.4 方法学考察
2.4.1 精密度试验 取同一份生川芎供试品(批号20190516)溶液,按“2.1”项下色谱条件连续进样6 次,记录色谱图。结果表明,以保留时间、峰面积均适中且分离度较好的藁本内酯为参照峰,各共有峰相对保留时间和相对峰面积的RSD 均<3%,表明仪器精密度良好。
2.4.2 重复性试验 取同一批生川芎样品(批号20190516),按“2.3.2”项下方法平行制备6 份供试品溶液,按“2.1”项下色谱条件进样测定,记录色谱图。结果表明,以藁本内酯为参照峰,各共有峰相对保留时间和相对峰面积的RSD 均<3%,表明该方法重复性良好。
2.4.3 稳定性试验 取同一份生川芎供试品(批号20190516)溶液,分别于制备后0、2、4、6、8、16、24 h 按“2.1”项下色谱条件进样测定,记录色谱图。结果表明,以藁本内酯为参照峰,各共有峰相对保留时间和相对峰面积的RSD 均<3%,表明供试品溶液在24 h 内稳定。
2.5 指纹图谱的建立与分析
2.5.1 最佳炒制时间的确定 将“2.3.1”项下方法制备的混合对照品溶液,按“2.1”项下色谱条件进样测定,记录色谱图;将10 批川芎生品及炒制不同时间的炮制品,分别按“2.3.2”项下方法制备供试品溶液,按“2.1”项下的色谱条件进行测定,记录色谱图。将10 批生品和不同炮制时间炮制品各10批的指纹图谱导入“中药色谱指纹图谱相似度评价系统(2012.130723 版)”软件,采用中位数矢量法进行多点校正,生成川芎生品及不同炮制程度酒炙品的对照指纹图谱,结果见图2。结果发现9 个色谱峰响应值较大(占共有指纹峰面积的80%),且分离度较好,将其作为共有色谱峰。随着炮制程度的改变,其峰面积也发生改变。
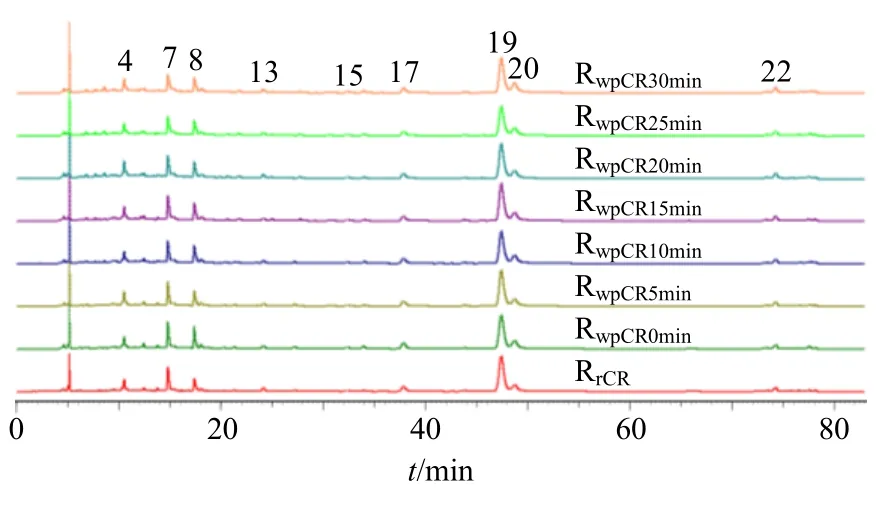
图2 川芎生品及不同程度炮制品HPLC 对照指纹图谱Fig.2 HPLC control fingerprints of Chuanxiong Rhizoma of raw and processed products at different degrees
将川芎生品及炮制品进行对比,分别比较这9个共有色谱峰在生品及不同炮制品中的峰面积,结果见表1。随着炒制时间的延长,除17 号峰逐渐降低外,其余峰多在15~20 min 达到最大峰面积,说明多数成分在炒制15~20 min 时含量最大,因此,15~20 min 为最佳的炮制时间。以下生品川芎、酒炙品川芎指纹图谱比较分析、HCA、PCA 中的酒炙川芎均指炒制20 min 下的川芎。
经与对照品比对,指认出6 个成分,其中7 号峰为阿魏酸,8 号峰为洋川芎内酯I,15 号峰为阿魏酸松柏酯,17 号峰为洋川芎内酯A,19 号峰为藁本内酯,20 号峰为丁烯基苯酞。
表1 9 个指纹峰在川芎生品及不同炮制程度下酒炙品中的峰面积 (±s,n=10)Table 1 Peak area of nine fingerprint peaks of Chuanxiong Rhizoma between raw and processed products at different processing degrees (±s,n=10)
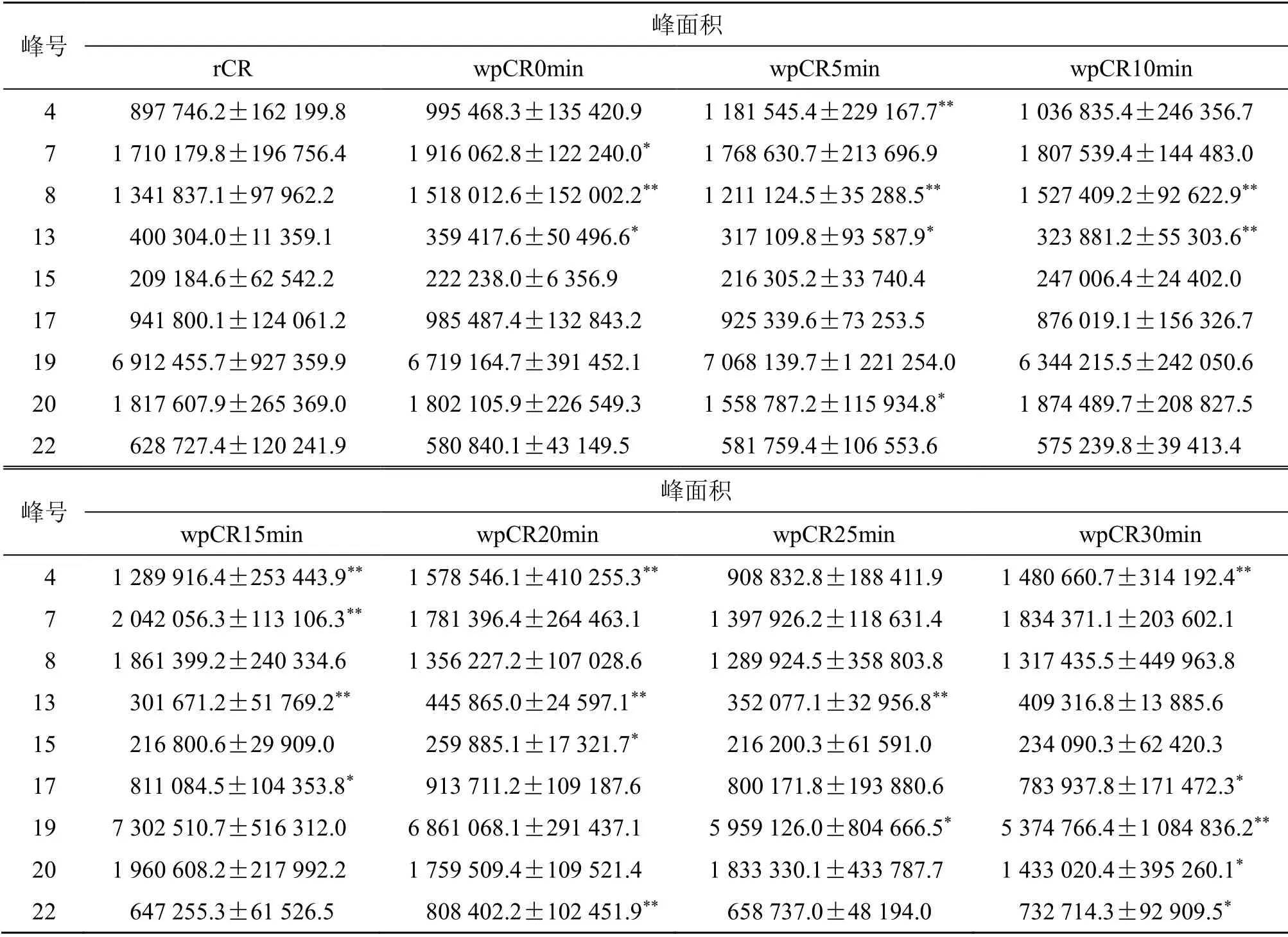
表1 9 个指纹峰在川芎生品及不同炮制程度下酒炙品中的峰面积 (±s,n=10)Table 1 Peak area of nine fingerprint peaks of Chuanxiong Rhizoma between raw and processed products at different processing degrees (±s,n=10)
与rCR 比较:*P<0.05 **P<0.01*P < 0.05 **P < 0.01 vs rCR
峰号 峰面积rCR wpCR0min wpCR5min wpCR10min 4 897 746.2±162 199.8 995 468.3±135 420.9 1 181 545.4±229 167.7** 1 036 835.4±246 356.7 7 1 710 179.8±196 756.4 1 916 062.8±122 240.0* 1 768 630.7±213 696.9 1 807 539.4±144 483.0 8 1 341 837.1±97 962.2 1 518 012.6±152 002.2** 1 211 124.5±35 288.5** 1 527 409.2±92 622.9**13 400 304.0±11 359.1 359 417.6±50 496.6* 317 109.8±93 587.9* 323 881.2±55 303.6**15 209 184.6±62 542.2 222 238.0±6 356.9 216 305.2±33 740.4 247 006.4±24 402.0 17 941 800.1±124 061.2 985 487.4±132 843.2 925 339.6±73 253.5 876 019.1±156 326.7 19 6 912 455.7±927 359.9 6 719 164.7±391 452.1 7 068 139.7±1 221 254.0 6 344 215.5±242 050.6 20 1 817 607.9±265 369.0 1 802 105.9±226 549.3 1 558 787.2±115 934.8* 1 874 489.7±208 827.5 22 628 727.4±120 241.9 580 840.1±43 149.5 581 759.4±106 553.6 575 239.8±39 413.4峰号 峰面积wpCR15min wpCR20min wpCR25min wpCR30min 4 1 289 916.4±253 443.9** 1 578 546.1±410 255.3** 908 832.8±188 411.9 1 480 660.7±314 192.4**7 2 042 056.3±113 106.3** 1 781 396.4±264 463.1 1 397 926.2±118 631.4 1 834 371.1±203 602.1 8 1 861 399.2±240 334.6 1 356 227.2±107 028.6 1 289 924.5±358 803.8 1 317 435.5±449 963.8 13 301 671.2±51 769.2** 445 865.0±24 597.1** 352 077.1±32 956.8** 409 316.8±13 885.6 15 216 800.6±29 909.0 259 885.1±17 321.7* 216 200.3±61 591.0 234 090.3±62 420.3 17 811 084.5±104 353.8* 913 711.2±109 187.6 800 171.8±193 880.6 783 937.8±171 472.3*19 7 302 510.7±516 312.0 6 861 068.1±291 437.1 5 959 126.0±804 666.5* 5 374 766.4±1 084 836.2**20 1 960 608.2±217 992.2 1 759 509.4±109 521.4 1 833 330.1±433 787.7 1 433 020.4±395 260.1*22 647 255.3±61 526.5 808 402.2±102 451.9** 658 737.0±48 194.0 732 714.3±92 909.5*
将10 批川芎生品及酒炙品指纹图谱分别导入“中药色谱指纹图谱相似度评价系统(2012.130723版)”软件,计算各批次样品指纹图谱与各自生成的对照图谱的相似度,其相似度结果见表2。由表可知,10 批川芎生品指纹图谱以及10 批川芎酒炙品指纹图谱的相似度均较好,均在0.98 以上。
2.6 化学模式识别研究
2.6.1 HCA 以生川芎和酒川芎共有峰的相对峰面积为变量,导入SPSS 26.0 统计软件进行聚类分析。Z 标准化后采用瓦尔德法,以平方欧式距离作为样品相似度的距离公式,结果见图4。聚类分析结果表明,当平方欧式距离为10 时,川芎样品可分为2 类,rCR1~rCR10 号川芎生品聚为一类,wpCR1~wpCR10 号酒炙品聚为一类。说明川芎生品与酒炙品的化学指纹峰差异,可以采用聚类方式进行识别,并进行分类。
2.6.2 PCA 将10 批生川芎和酒川芎作为研究对象,把共有峰的相对峰面积作为变量导入SIMCA 14.1 统计软件进行无监督模式的PCA 建模,分析结果见图5。由图5可知,生川芎和酒川芎沿着t1 轴方向各自聚为一类,生川芎位于得分图的左边,酒川芎位于得分图的右边,与聚类分析结果相互佐证,说明炮制处理对川芎化学成分的总体特征构成了明显影响。前5 个主成分的累积贡献率R2X达到93.842%,预测能力参数Q2为0.754,说明该模型的拟合程度和预测程度都较好,通过PCA 降维处理后所提取的主成分能反映川芎指纹图谱中22 个共有峰的主要信息。成分载荷矩阵可说明各个变量对主成分的贡献率,载荷的绝对值越大,对主成分的贡献越大,主成分载荷矩阵见表3。第1 主成分(PC1)信息量最大,独立贡献率为50.771%,峰12(0.296)、峰1(0.295)、峰13(−0.293)、峰2(0.289)和峰3(0.289)载荷值较大。第2 主成分(PC2)独立贡献率为20.253%,峰15(0.376)、峰18(−0.356)、峰11(0.298)、峰4(−0.295)和峰22(−0.293)载荷值较大。第3 主成分(PC3)独立贡献率为9.851%,峰21(0.429)、峰8(0.394)、峰9(0.394)、峰19(−0.390)和峰16(0.311)载荷较大。第4 主成分(PC4)独立贡献率为8.811%,峰17(0.526)、峰7(0.340)和峰15(−0.333)有较大载荷。第5 主成分(PC5)独立贡献率为4.156%,峰9(0.681)、峰7(0.362)和峰15(−0.312)的载荷较大。结果表明,多种化学成分共同引起川芎的质量差异。
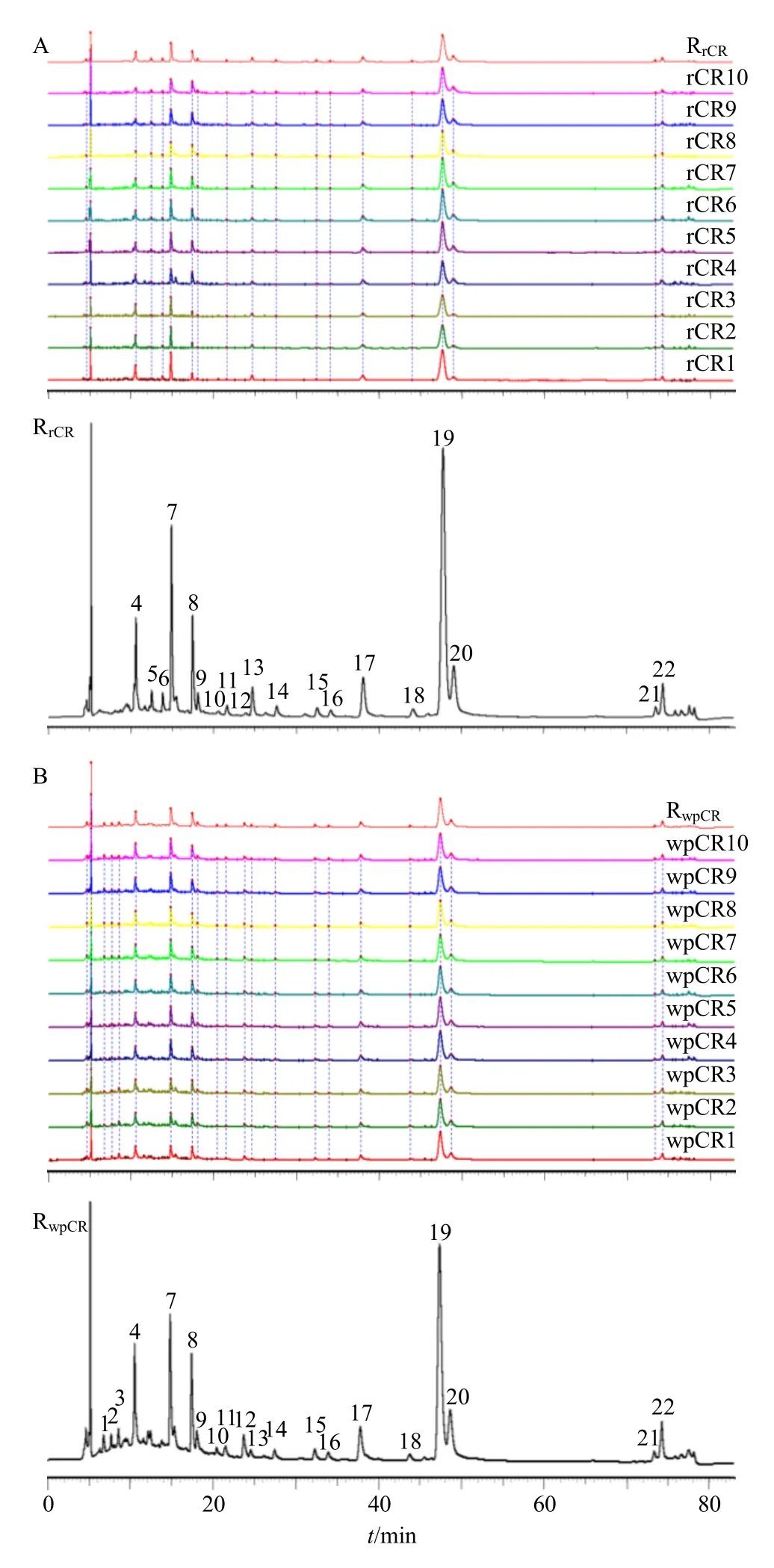
图3 10 批生川芎HPLC 指纹图谱 (A) 及其对照指纹图谱(RrCR) 和10 批酒炙川芎HPLC 指纹图谱 (B) 及其对照指纹图谱 (RwpCR)Fig.3 HPLC fingerprints (A) and control fingerprints(RrCR) of 10 batches of raw Chuanxiong Rhizoma,and HPLC fingerprints (B) and control fingerprints (RwpCR) of 10 batches of wine processed Chuanxiong Rhizoma
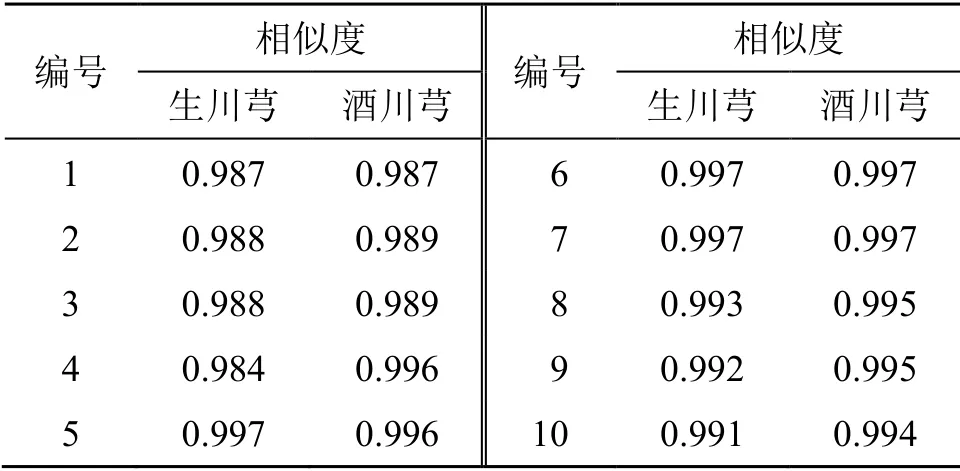
表2 10 批川芎生品和酒炙品指纹图谱相似度结果Table 2 Fingerprint similarity results of 10 batches raw and wine processed Chuanxiong Rhizoma

图4 川芎生品和酒炙品聚类分析Fig.4 HCA of raw and wine processed Chuanxiong Rhizoma
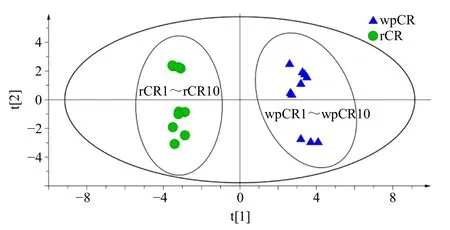
图5 川芎生品和酒炙品PCA 得分图Fig.5 PCA score plot of raw and wine processed Chuanxiong Rhizoma
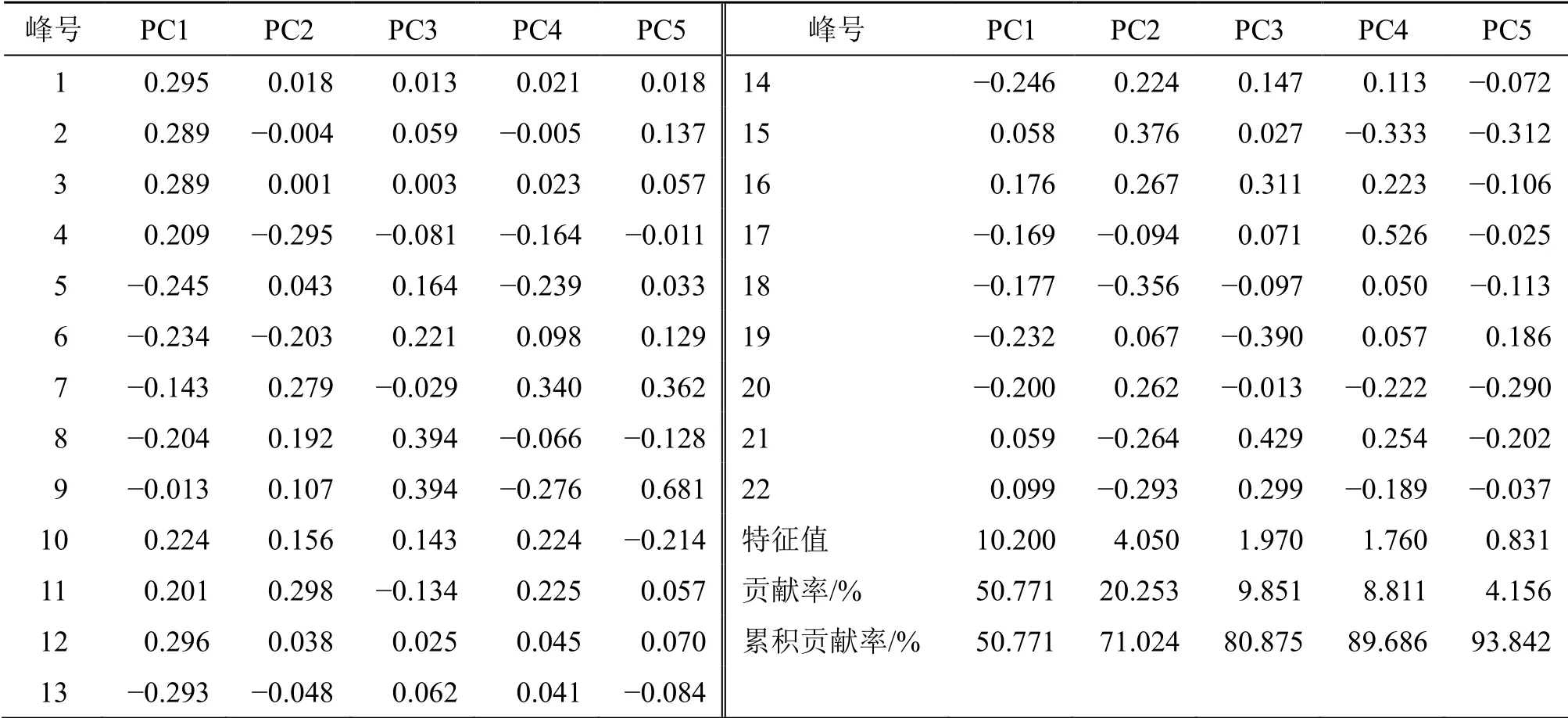
表3 主成分载荷Table 3 Principal component load
为分析炮制过程中成分变化的整体规律,将10批川芎生品和不同炮制程度酒炙品作为研究对象,把共有峰的相对峰面积作为变量导入SIMCA 14.1统计软件进行无监督模式的PCA 建模分析,结果见图6。由图可知,随着炮制程度的加深,从生品到不同炮制程度酒炙品的PCA 得分图基本呈顺时针方向迁移,炮制过程中虽然各个化学成分的变化趋势不尽相同,整体体现一定的复杂性,但PCA 可将这种复杂性变得较为简单和可视化,可以体现化学成分的整体变化特征。
2.6.3 采用PCA 模型进行酒炙工艺预测 在以上PCA 的基础上,另外制备生品3 批,分别为rCR11~rCR13;制备上述最优炮制程度下酒炙品3 批,分别为wpCR11~wpCR13;制备市售酒川芎5 批,分别为mwpCR1~mwpCR5,此11 批样品作为预测集。采用“2.6.2”项下建立的PCA 模型对3 批生品、3 批酒炙品以及5 批市售酒炙品进行预测,预测得分图见图7-A。由图可知,3 批生品和3 批自制酒炙品分别落在了PCA 模型的生品和酒炙品的范围内,说明建模良好,可以用于炮制品工艺预测。市售5 批酒炙品,有3 批落在酒炙品范围内,2 批落在了生品和酒炙品之间,说明3 批工艺与本实验的工艺相符合,2 批与本实验的工艺存在一定的差异,此2 批川芎的来源以及炮制工艺均有可能是造成差异的原因。
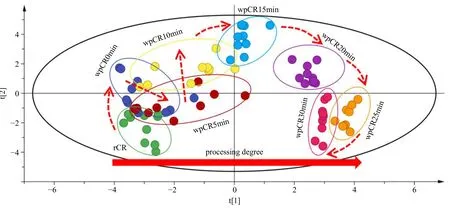
图6 川芎生品及不同炮制程度酒炙品的PCA 得分图Fig.6 PCA score plot of raw and processed Chuanxiong Rhizoma at different processing degrees
为了对炮制过程中的炮制程度进行控制,及时发现不合格炮制品,用最佳炮制程度下的10 批样品指纹图谱共有峰进行建模,对3 批炮制时间为10 min(炮制程度不及,wpCR11’~wpCR13’)、3 批炮制时间为30 min(炮制程度过度,wpCR14’~wpCR16’)的酒炙品进行预测,其DModX 图见图7-B,由图可以发现此6 批样品均偏离了最佳炮制程度下的10 批样品,说明炮制不及和过度均不得当。
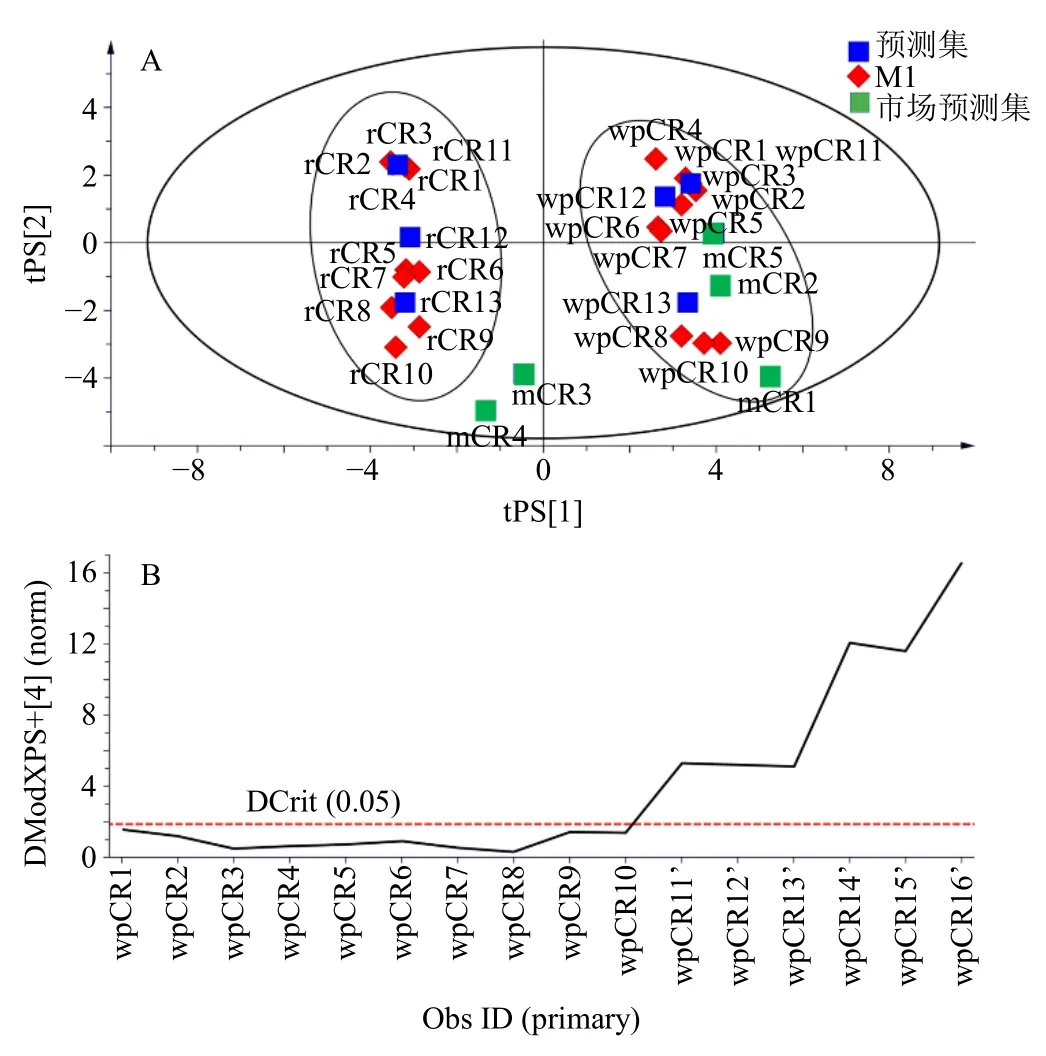
图7 川芎生品、酒炙品和市售酒炙品PCA 预测得分 (A)及酒炙工艺预测DModX (B) 图Fig.7 Predicted PCA of raw,wine processed and market Chuanxiong Rhizoma (A) and DModX of wine processing prediction (B)
2.6.4 OPLS-DA 分析 将川芎生品和酒炙品作为研究对象,以共有峰的相对峰面积作为变量,导入SIMCA 14.1 进行有监督模式的OPLS-DA 分析,获得相应的模型,见图8-A。结果表明累积解释能力参数(R2X)为0.738,累积解释能力参数(R2Y)为0.994,预测能力参数(Q2)为0.988,均大于0.5,表明该模型稳定可靠、预测能力强,可用于区别生川芎与酒川芎。由OPLS-DA 得分图可知,生川芎和酒川芎明显分为2 类,说明川芎酒炙前后化学成分的含量存在差异。
对建立的OPLS-DA 模型进行200 次置换检验,结果见图8-B。由图可知,位于最右边的R2和Q2值均大于0.9,高于左边的R2和Q2值,且Q2回归线的截距为负值,表明所构建的OPLS-DA 模型没有出现过拟合,具有较好的预测能力,能够用于川芎生品和酒炙品的判别分析。
S-Plot 图(图8-C)体现了各变量的贡献度与样品间的相关性,图中每个点代表1种化合物,对角线两端的变量是影响2 样本差异性的潜在标志物。由图8-C 可知,峰1~4、12、13、19(藁本内酯)、20(丁烯基苯酞)可能是引起川芎生品和酒炙品质量差异的标志化合物。其中,1~3 号峰为酒炙后新增加的峰。
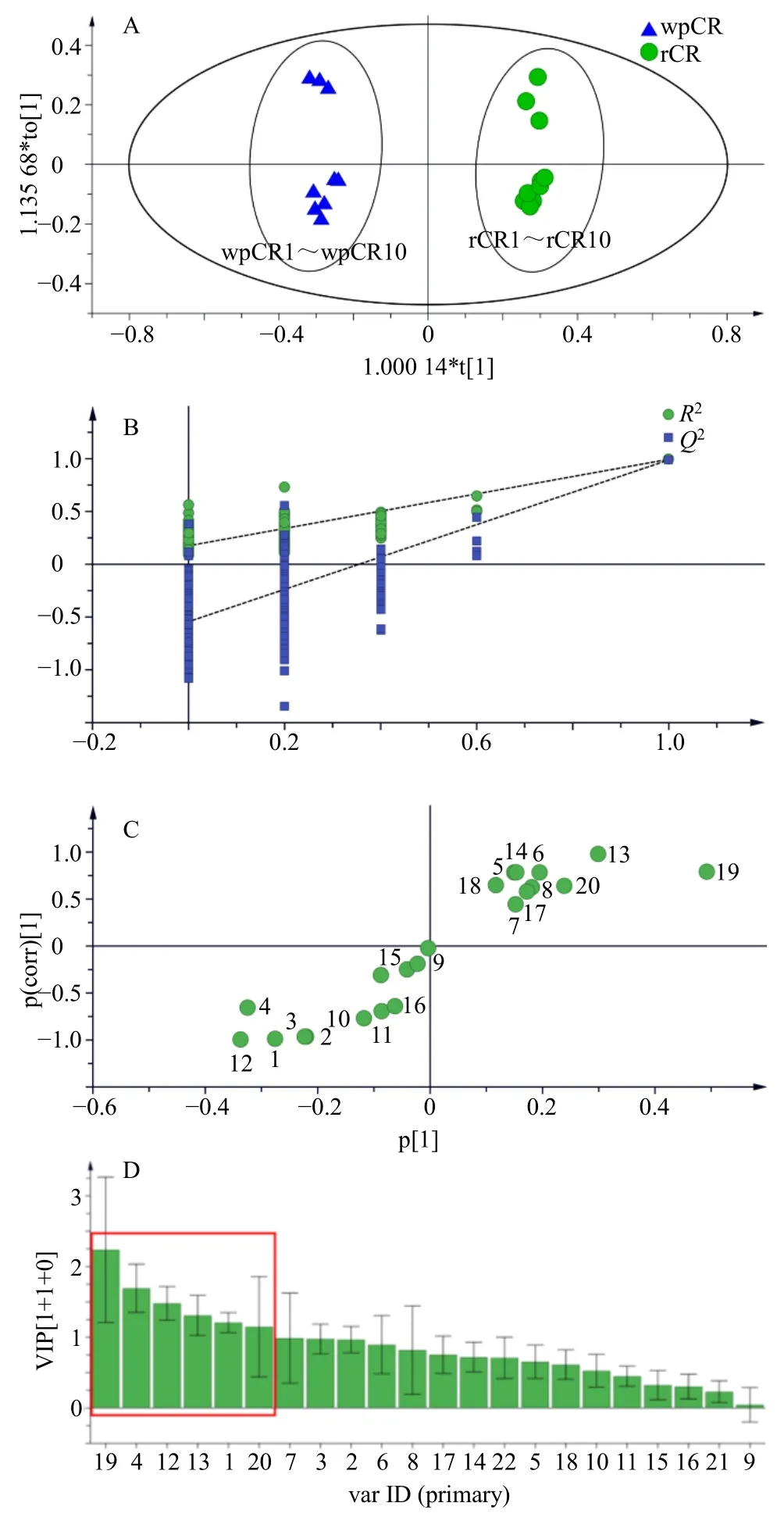
图8 川芎生品与酒炙品的OPLS-DA 得分 (A)、模型的置换检验 (B)、S-plot (C) 及VIP 值图 (D)Fig.8 OPLS-DA score plot (A),permutation test (B),S-plot(C) and VIP (D) of raw and wine processed Chuanxiong Rhizoma
提取OPLS-DA 模型中变量重要性投影(VIP)图,见图8-D。对22 个共有峰峰面积VIP 值大小进行排列,以VIP 值>1.0 为标准筛选质量差异标志物,共得到6 个VIP 值大于1 的共有峰,分别为19号峰(藁本内酯,VIP 值为2.237)、4 号峰(VIP值为1.693)、12 号峰(VIP 值为1.479)、13 号峰(VIP值为1.309)、1 号峰(VIP 值为1.208)、20 号峰(丁烯基苯酞,VIP 值为1.147)。说明这些化学成分对川芎生品和酒炙品分类具有显著影响,是引起川芎酒炙前后质量差异的主要潜在标志性成分。因此,在建立川芎酒炙品质量标准时,此差异标志性成分可以考虑作为指标成分,来控制酒炙品的质量。
3 讨论
本实验对川芎生品以及酒炙品进行全波长扫描,提取各个波长下的指纹图谱进行比较,发现在254 nm 波长下各色谱峰响应较高,峰数目较多,峰形对称,各色谱峰分离度较好,基线较平稳。因此,确定254 nm 作为建立川芎生品及酒炙品指纹图谱的检测波长。在建立提取方法时,前期实验比较了水提法以及醇提法,发现在200~400 nm 全波长扫描下,水提样品指纹峰的数目较醇提少,为了获得更多的指纹峰,选择乙醇提取,并比较了不同浓度乙醇提取的效果,最终确定提取浓度为90%的乙醇。
《中国药典》没有收载川芎炮制品,各地方标准对川芎炮制品的质量标准没有具体规定,因此不能有效控制川芎炮制品的质量。本研究采用HPLC 法,建立了川芎生品及其炮制品随炒制时间的动态变化指纹图谱,选择峰面积较大的9 个共有峰,通过9个峰的动态变化,最终确定在本实验条件下,最佳炮制时间为15~20 min。其原因为,可以观察到大多数色谱峰在炒制15~20 min 时,含量达到最大,在超过20 min 时,可观察到峰面积的降低。虽然指纹图谱具有其自身的缺陷,不同产地川芎建立的指纹图谱也会有一定的差异,甚至可能会超过炮制造成的差异,但实验中进行炮制程度控制时,是在生品指纹图谱的基础上进行同批炮制,建立炮制过程中的动态指纹图谱,指纹图谱动态变化的影响因素只来自炮制过程,因此,各个时间点间的指纹图谱具有一定的可比性。
通过对川芎生品及最佳炮制时间酒炙品的指纹图谱进行比较,发现川芎经酒炙以后,有新产生的色谱峰,可能为黄酒中带入的新成分,也可能由部分消失成分转化而来。通过OPLS-DA 进行差异性标志物的筛选,这些新产生的成分也在其差异性质量标志物中,所有的差异性质量标志物都可能与酒炙川芎增加活血化瘀作用有关,但未知成分及新生成成分的定性尚待进一步研究。
本实验通过HPLC 指纹图谱结合化学模式识别方法揭示了川芎炮制前后化学成分的变化规律,为酒炙川芎可能发生的药效变化提供化学基础,也为川芎及其炮制品的质量评价及炮制过程的在线控制提供思路和方法。
利益冲突所有作者均声明不存在利益冲突
