基于液质联用和核磁共振的龙葵茎化学成分研究
2021-03-09高淑红苏珍枝杨琳娇李震宇
高淑红,苏珍枝,杨琳娇,李震宇*
1.山西药科职业学院,山西 太原 030031
2.山西大学中医药现代研究中心,山西 太原 030006
龙葵为茄科植物龙葵Solanum nigrumL.的干燥全草,别名苦葵、水茄、老鸦酸浆草等[1]。性寒,味苦、微甘,归肺、胃、膀胱经,具清热解毒、活血散瘀、利水消肿、止咳祛痰之功效,临床广泛用于抗炎、抗休克、抗病毒及抗肿瘤等方面[2]。
近年来对龙葵的化学成分进行了大量研究,显示龙葵全草中含有多种甾体生物碱,其中以澳洲茄碱和澳洲茄边碱的含量最高[3];此外,从龙葵全草分离得到了以薯蓣皂苷元和替告皂苷元为母核的甾体皂苷化合物,以及黄酮类化合物、小分子有机酸类等化合物[4-5]。另有针对龙葵果、龙葵叶等进行化学成分研究,显示龙葵果中含有生物碱、氨基酸、色素等化学成分[6],叶中含有生物碱、甾体皂苷类化合物等[7-8]。龙葵的药用部位是全草,通过本课题组的调查分析,全草中包括龙葵茎、叶、果,其中以茎为主,占到龙葵药材质量的60%以上。但目前化学研究未见对茎化学成分的单独报道。鉴于茎在龙葵药材中占有较大比重,有必要对其化学成分进行系统分析。
近年来液质联用技术在中药化学成分快速识别中得到了广泛的应用,如有研究采用UPLC-QTOF-MS 技术从刺梨籽中鉴定55 个化学成分[9];运用UHPLC-Q-Orbitrap MS 技术从红花中鉴定出135个次生代谢物[10]。核磁共振氢谱(1H-NMR)具有重现性好、分析时间短、备样方法简单、可以检测大部分含氢化合物等优势,尤其适用于检测色谱柱上不保留的强极性化合物,与液质联用分析具有互补性。因此本实验拟采用UHPLC-Q Exactive 高分辨质谱与核磁共振氢谱(1H-NMR)结合对龙葵茎的化学成分进行快速识别。
1 仪器与试剂
Thermo fisher U3000 超高效液相色谱仪,配置在线脱气机、四元梯度泵、柱温箱、自动进样器(美国赛默飞世尔科技公司),ThermoScientificTMQ Exactive 组合型四极杆Orbitrap 质谱仪(美国赛默飞世尔科技公司);Bruker 600 MHz Avance III NMR波谱仪(德国布鲁克公司),十万分之一天平(梅特勒−托利多仪器有限公司);KQ5200E 超声波清洗器,XK-80A 快速混匀器(江苏新康医疗器械有限公司)。
龙葵2019年8月采集于山西省五台县蒋坊乡,由山西药科职业学院刘林凤教授鉴定为茄科茄属植物龙葵S.nigrumL.的全草。NMR 试剂重水(Norell,Landisville,美国)、氘代甲醇(99.8%,Merck,德国)、氘代三甲基硅烷丙酸钠盐(TSP,Cambridge Isotope Laboratories Inc,MA,美国),甲醇(分析纯,天津市大茂化学试剂厂),甲酸、乙腈(质谱纯,美国Thermo 公司),超纯水由Milli-Q 纯净水系统(美国Millipore 公司)制备。对照品澳洲茄胺(批号19121-58-5,质量分数≥94.5%)、澳洲茄碱(批号20318-30-3,质量分数≥95%)均购于上海安奈德化学技术中心;绿原酸(批号YJ-141004,质量分数≥98%)购自江苏永健医药有限公司。
2 方法
2.1 色谱及质谱条件
2.1.1 色谱条件 Waters Acquity UPLC HSS T3 色谱柱(100 mm×2.1 mm,1.8 µm),流动相为0.1%甲酸水溶液(A)-乙腈(B);梯度洗脱(0~15 min,5%~20% B;15~20 min,20%~35%B;20~30 min,35%~55% B)。柱温为35 ℃,体积流量为0.25 mL/min,进样量为1 μL。
2.1.2 质谱条件 Full MS/DD MS2(TOPN):采用电喷雾离子源(HESI);扫描方式采用正负离子同时扫描;毛细管温度为320 ℃;鞘气体积流量为241.5 kPa(35 psi),辅助气体积流量为69 kPa(10 psi);正离子模式下喷雾电压为3.5 kV,负离子模式下喷雾电压为2.5 kV,透镜电压为55 kPa;探头加温器温度为300 ℃;最大喷雾电流为100 V;NEC:20,40,60;扫描质量范围为m/z80~1200,质量分辨率为70 000。
2.2 核磁测定条件
样品于600 MHz(25 ℃)NMR 仪(Bruker,Germany)上测定,采样次数为64,谱宽12345.7 Hz,脉冲时间14 μs,采样时间2.654 s,弛豫时间1.0 s,采样数据点65 536,FID 分辨率0.188 Hz,采样间隔40.5 μs,手动进行相位调节、基线调节及峰校正。提取物核磁测定采用noesygppr1d 序列压制水峰,内标为TSP。
2.3 供试品溶液的制备
取中等宽度的龙葵茎适量,粉碎,过80 目筛,精密称取粉末0.50 g,置于10 mL 玻璃管中,加50%甲醇水溶液6 mL,涡旋1 min,超声提取25 min,放冷至室温,3500 r/min 离心25 min,取上清液经0.22 µm 微孔滤膜滤过,用于UPLC-Q Exactive MS分析。
精密称取液氮研磨后的药材粉末0.50 g,过80目筛,置于10 mL 离心管中,加蒸馏水及甲醇各3 mL,涡旋混匀1 min,超声提取25 min,室温下3500 r/min 离心25 min,提取液减压浓缩蒸干。测定前加入氘代甲醇300 μL 与氘代重水300 μL,复溶后转移至1.5 mL 离心管中,13 000 r/min 离心10 min,移取上清液500 μL于5 mm核磁管中,用于1H-NMR分析。
2.4 对照品溶液制备
称取澳洲茄胺和澳洲茄碱对照品适量,精密称定,转置于5 mL 量瓶中用甲醇溶解,定容,分别配制质量浓度为2.040、2.030 mg/mL 的母液,取适量母液,稀释10 倍置于4 ℃冰箱,备用。
2.5 化合物结构分析
采用Xcalibur3.2软件对采集到的原始质谱数据进行峰提取、峰匹配分析处理。采集到的原始数据导入Compound Discover 3.0 软件中,保留时间设置在0~33 min,m/z80~1200,偏差为5×10−6,信噪比为3,保留时间偏移值为0.1 min;通过峰提取、搜索在线及本地数据库、化合物预测等数据处理,导出样品名称、保留时间、分子式、质荷比以及对应的离子强度组成的数据集。核磁图谱采用MestReNova(Version,8.0.1,Mestrelab Research,Santiago de Compostella,西班牙)软件进行处理。
3 结果
3.1 采用UHPLC-Q Exactive MS 表征龙葵茎中的化学成分
采用Xcalibur3.2 数据软件进行分析处理,正、负模式下的总离子流图见图1,各峰获得良好分离,从龙葵茎中共鉴定出68 个化合物(表1),包括生物碱5 个,皂苷28 个,游离氨基酸9 个,咖啡酰基奎尼酸类、脂肪酸类以及核苷类等其他化合物26 个。
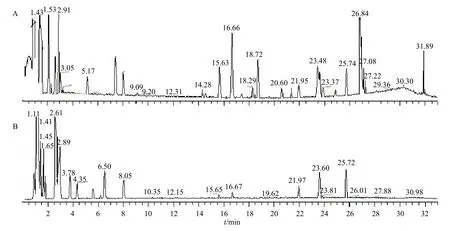
图1 龙葵茎正 (A)、负 (B) 离子模式下总离子流图Fig.1 Base peak ion chromatogram of stems of S.nigrum in positive mode (A) and negative mode (B)
3.1.1 生物碱类 根据文献报道[2],龙葵中的生物碱主要为胆甾烷类生物碱,代表性成分主要为澳洲茄胺、澳洲茄碱和次勒帕茄碱I(leptinine I)。在正离子模式下,化合物32 的保留时间为17.87 min,准分子离子峰为m/z884.499 5 [M+H]+,在二级质谱中失去1 个Rha 得到m/z738.429 9 [M+H-Rha]+,进一步失去2 个Hex 得到m/z414.336 8 [M+H−Rha−2Hex]+,再进一步失去1 分子水和C8H15N,得到m/z271.204 8 [M+H-Rha-2Hex-H2OC8H15N]+,最后失去1 分子H2O 得到m/z253.195 1[M+H-Rha-2Hex-H2O-C8H15N-H2O]+,与文献报道的二级碎片一致[17],进一步通过对照品对照,鉴定化合物32 为澳洲茄碱。澳洲茄碱的裂解途径见图2。
在正离子模式下,化合物40 的保留时间为18.51 min,准分子离子峰为m/z868.505 3 [M+H]+,在二级质谱失去1 分子H2O 得到m/z850.494 6 [M+H-H2O]+,再失去1 个Rha 得到m/z704.441 9 [M+H-H2O-Rha]+,进一步失去1 个Rha 和Hex 得到m/z396.326 2 [M+H-H2O-Rha-Hex-Rha]+,再进一步失去C8H15N,得到m/z271.204 8 [M+HH2O-Rha-Hex-Rha-C8H15N]+,最后失去1 分子H2O 得到m/z253.195 1 [M+H-H2O-Rha-Hex-Rha-C8H15N-H2O]+,与文献中次勒帕茄碱I 数据一致[18]。采用类似方法,从龙葵茎提取物中共鉴定胆甾烷类生物碱5 个,除澳洲茄碱和次勒帕茄碱I,还包括γ-澳洲茄边碱及其异构体、β1-澳洲茄碱。
结合文献报道[19]分析胆甾烷类生物碱二级质谱裂解规律:首先在ESI 源的轰击下生成正离子,失去糖链生成母核离子澳洲茄胺或茄次碱,进一步失去1 分子水与C8H15N,最后再失去1 分子水。因此,龙葵中胆甾烷类生物碱特征离子有m/z414.33(C27H44NO2+)、396.32(C27H42NO+)、271.20(C19H27O+)、253.19(C19H25+),中性碎片有m/z162.05(Hex)、146.05(Rha)等。
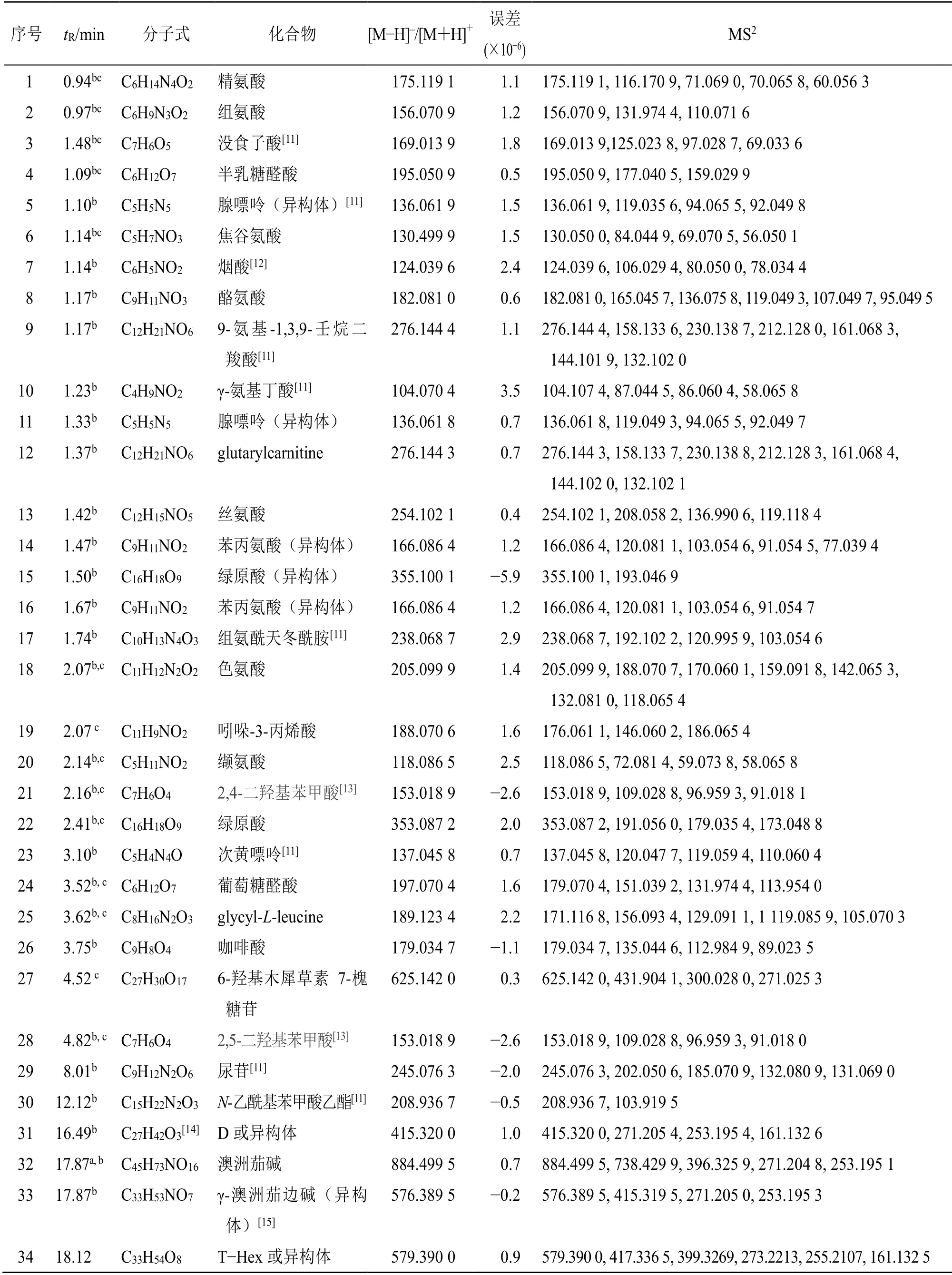
表1 龙葵中鉴定化学成分的质谱数据Table 1 MS results of constituents identified in S.nigrum
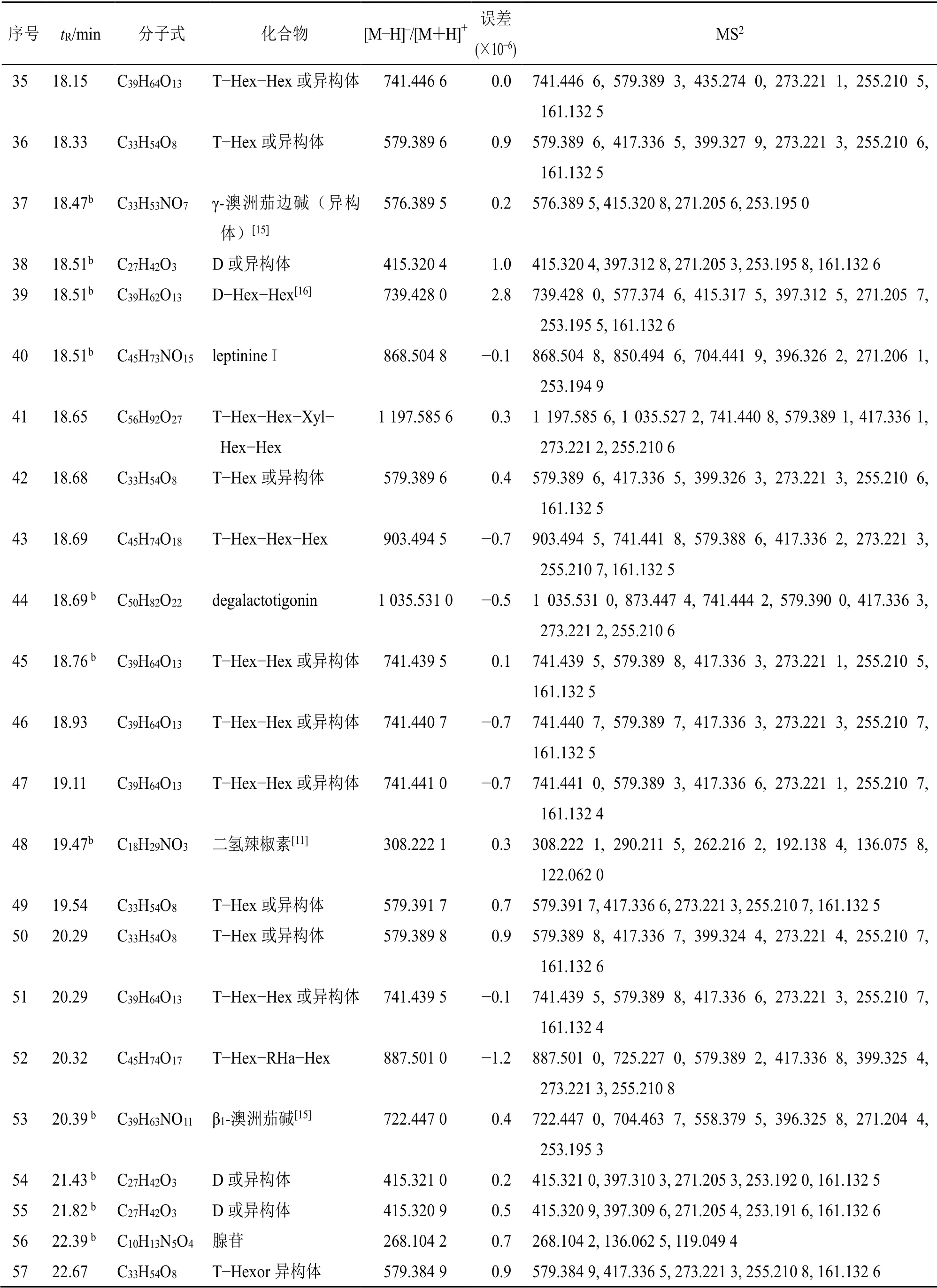
续表1
龙葵中胆甾烷类生物碱母核主要为澳洲茄胺(C27H43NO2)、双键被还原的澳洲茄胺(C27H45NO2),以及澳洲茄胺 C-27 位甲基被氧化成羧基(C27H41NO4)[20],主要衍生化方式有鼠李糖基化、己糖基化(葡萄糖基化、半乳糖基化)、木糖基化等。根据龙葵中已经报道的胆甾烷类生物碱的结构变化规律,使用Cytoscape 对其分子式进行关联分析,建立胆甾烷类生物碱分子网络(图3)。菱形代表文献中已报道过的化合物[20-22],椭圆形代表根据结构特征预测的可能结构。该分子网络图包括31 个胆甾烷类生物碱分子式,其中文献已报道的12 个,预测的19 个。将构建的胆甾烷类生物碱进行母离子提取,并在二级质谱图中寻找二级离子碎片,根据上述分析确定的质谱特征碎片,除了上述已经鉴定的5 个生物碱,未筛查到其余生物碱的特征质谱信号。在分子网络图中,蓝色代表在本研究中鉴定到的化合物,粉色代表未鉴定到的化合物。
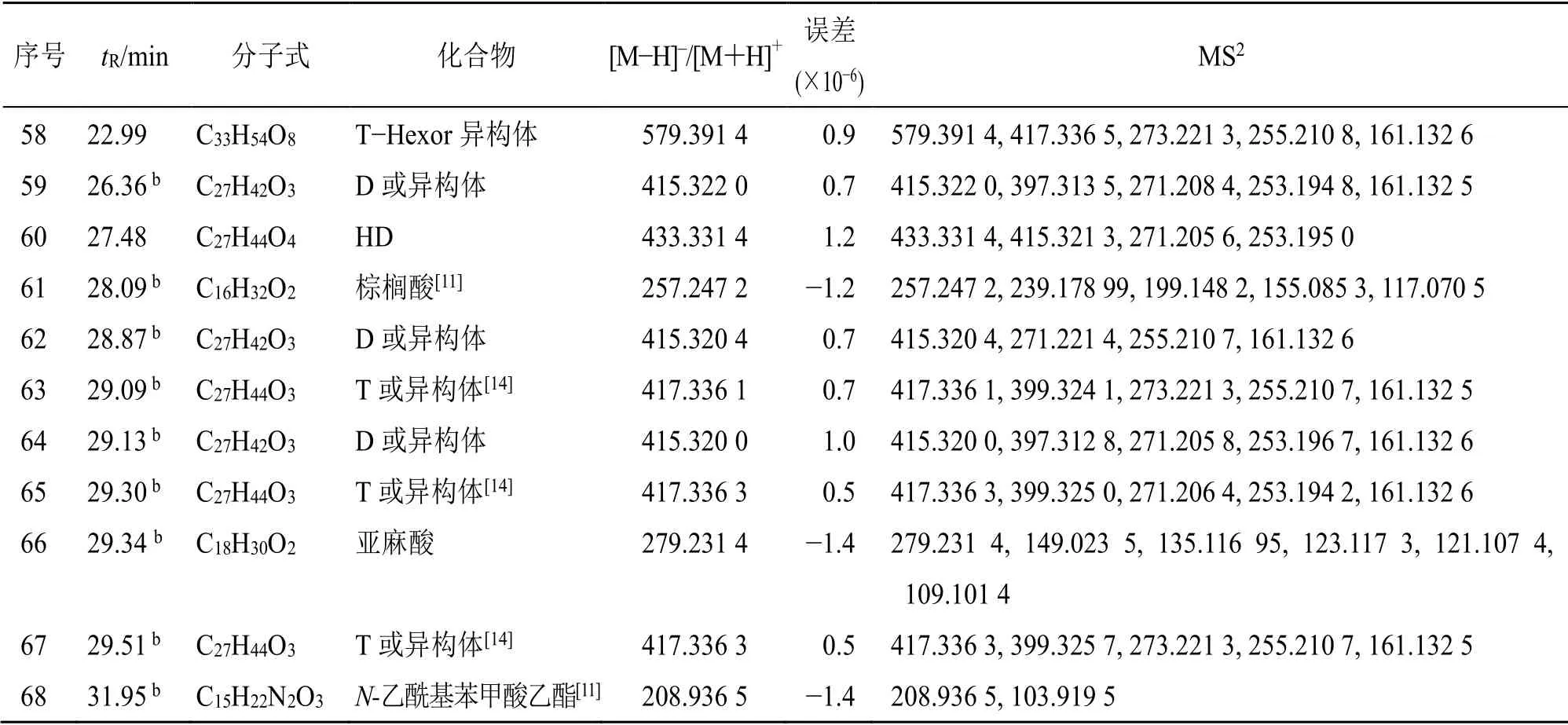
续表1
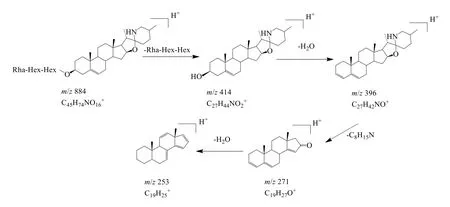
图2 澳洲茄碱的裂解途径Fig.2 Fragmentation pathways of solasonine
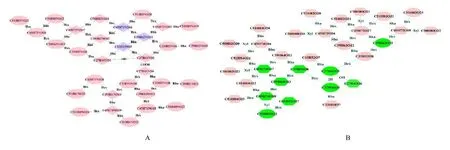
图3 龙葵茎中生物碱 (A) 和甾体皂苷 (B) 的分子网络Fig.3 Structural network of alkaloids (A) and steroidal saponins (B) from stems of S.nigrum
3.1.2 甾体皂苷类 龙葵中另一类重要的次级代谢产物为甾体皂苷类[4]。在正离子模式下,化合物54 的保留时间为21.43 min,准分子离子峰为m/z415.321 0 [M+H]+,母离子脱去1 分子水得到m/z397.310 3 [M+H-H2O]+,失去C8H16O2得到m/z271.205 6 [M+H-H2O-C8H16O2]+,进一步失去1 分子水得到m/z253.195 1 [M+H-H2O-C8H16O2-H2O]+,与薯蓣皂苷元数据一致[16]。
化合物44:保留时间为18.69 min,在正离子模式下,准分子离子峰为m/z1 035.537 1 [M+H]+,在二级质谱中失去1 分子Hex 得到m/z873.447 4[M+H-Hex]+,再失去1 分子Xyl 得到m/z741.442 2[M+H-Hex-Xyl]+,进一步失去Hex 得到m/z579.390 0 [M+H-Hex-Xyl-Hex]+,再失去1 分子Hex 得到m/z417.336 3 [M+H-Hex-Xyl-Hex-Hex]+,最后失去C8H16O2得到m/z273.221 4 [M+H-Hex-Xyl-Hex-Hex-C8H16O2]+,与文献中去半乳糖替告皂苷数据一致[7]。它的裂解途径见图4。
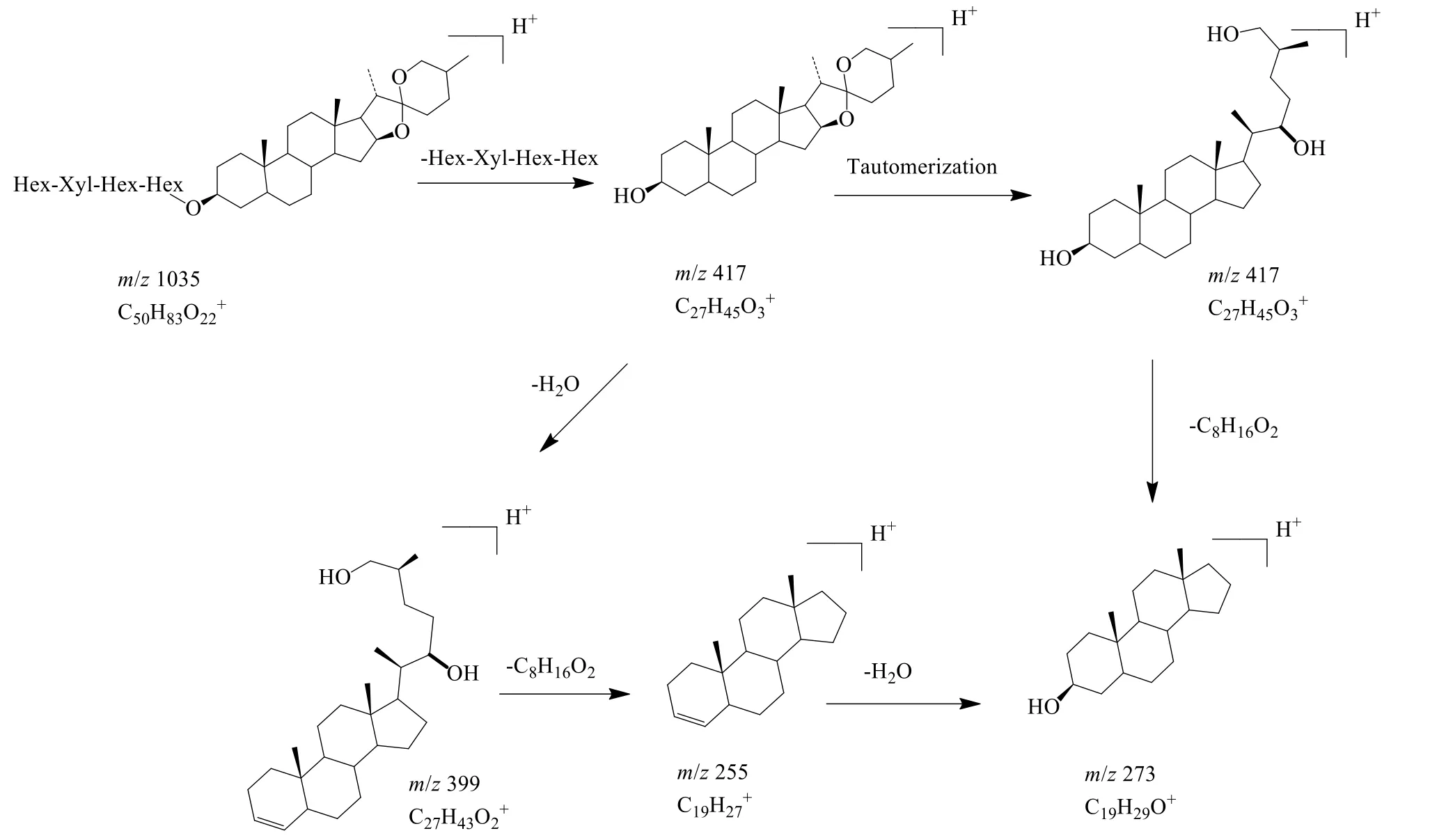
图4 去半乳糖替告皂苷的裂解途径Fig.4 Fragmentation pathways of degalactotigon
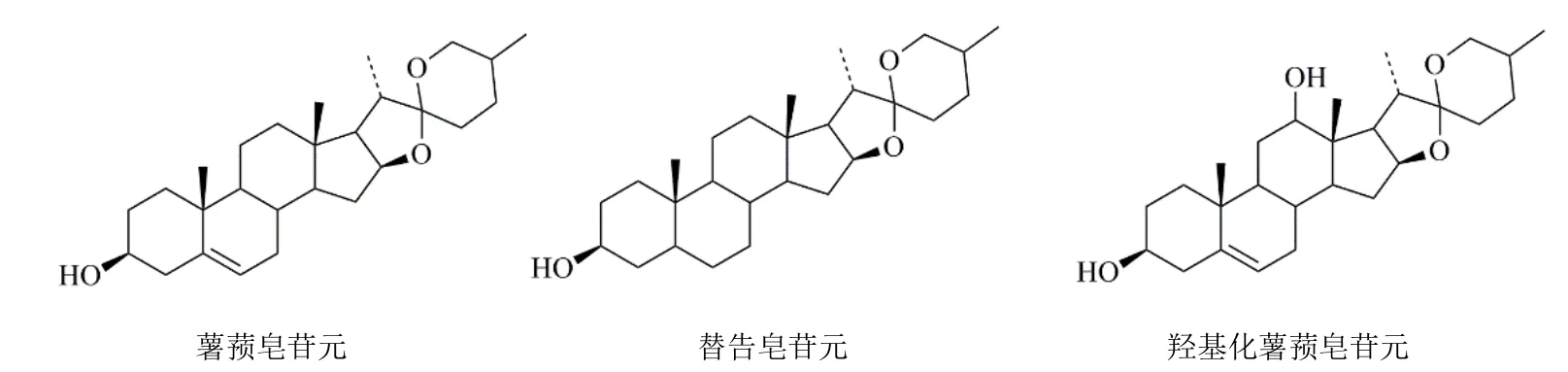
图5 龙葵中皂苷元的结构Fig.5 Structures of saponin aglycone of S.nigrum
通过分析该类化合物的结构特点及文献报道[16]的二级质谱碎片,龙葵中不同皂苷元类型(图5)的甾体皂苷类化合物存在一定裂解规律:(1)首先失去糖基等中性片段,生成母核离子;(2)母核离子发生异构化或者失去1 分子H2O;(3)异构化的母核离子先失去C8H16O2中性碎片,并脱掉1 分子H2O;(4)母核离子脱掉1 分子H2O 后进一步失去C8H16O2中性碎片。因此,该类皂苷化合物共有的中性丢失碎片有 Hex(m/z162.05)、Rha(m/z146.05)、Xyl(m/z132.05);不同母核的甾体皂苷类化合物有不同的特征离子,薯蓣皂苷元(diosgenin,D)为母核的化合物的特征离子包括m/z397.32(C27H41O2+)、271.22(C19H27O+)、253.21(C19H25+)等;替告皂苷元(tigogenin,T)为母核的特征离子包括m/z417.33(C27H45O3+)、399.32(C27H43O2+)、273.22(C19H29O+)、255.21(C19H27+);羟基化薯蓣皂苷元(hydroxydiosgenin,HD)[23]为母核的化合物的特征离子包括m/z415.33(C27H43O3+)、397.32(C27H41O2+)、271.22(C19H27O+)、253.21(C19H25+)等。
龙葵中皂苷类化合物主要的苷元结构如图5所示,连接的糖基主要有己糖基(葡萄糖及半乳糖)、鼠李糖基以及木糖基。根据这3 种皂苷元的结构,以及不同的糖链连接方式,使用Cytoscape 进行关联分析,建立皂苷结构分子网络(图3-B)。椭圆形代表文献中报道过的皂苷化合物分子式,六边形代表根据结构特征所预测的潜在皂苷类分子式。该分子网络包括32 个皂苷类分子式,其中文献已报道的皂苷分子式有9 个,预测的皂苷分子式23 个[17-19]。根据上述皂苷质谱特征,对网络图中的皂苷化合物进行筛查。在正离子模式下共鉴定出17 个皂苷类化合物,其中以薯蓣皂苷元为母核的有1 个化合物,包括D−Hex−Hex(C39H62O13);替告皂苷元为母核的化合物有15 个,包括T−Hex(C33H54O8)及其异构体,T−Hex−Hex(C39H64O13)及其异构体,T−Hex−Hex−Hex(C45H74O18)、T−Hex−Hex−Rha(C45H74O17)、T−Hex−Hex−Xyl−Hex−Hex(C56H92O27)等;以及HD 苷元,即hydroxydiosgenin(C27H42O4)。图3-B 中绿色代表在龙葵茎中鉴定的皂苷类化合物,粉色代表未鉴定,即在龙葵茎中排除的皂苷类化合物。
3.1.3 咖啡酰奎尼酸类 绿原酸为常见的咖啡酰奎尼酸类化合物,其分子式为C16H18O9。在负离子模式下,化合物22 的准分子离子峰为m/z353.087 8[M-H]−,保留时间为2.41 min,准分子离子峰酯键断裂失去C9H7O3,得到m/z191.056 0 [M-C9H7O3-H]−,进一步失去1 分子H2O 得到m/z173.048 8 [MC9H7O3-H2O-H]−,另外还有脱掉奎尼酸产生的m/z179.035 4 [M-C7H11O5-H]−碎片峰,推测化合物22 为绿原酸[12]。化合物15 在正离子模式下产生准分子离子峰m/z355.102 3 [M+H]+,保留时间为1.50 min,二级质谱离子包括:准分子离子峰失去C9H7O3,得到m/z192.039 4 [M-C9H7O3+H]+,进一步失去H2O 得到m/z177.016 2 [M-C9H7O3-H2O+H]−,推测化合物15 可能是绿原酸的单咖啡酰奎尼酸异构体[24]。
3.1.4 氨基酸类 龙葵茎中还鉴定到氨基酸类化合物。如化合物1 在正离子模式下产生准分子离子峰m/z175.119 8 [M+H]+,二级碎片有m/z116.170 9[M-CH4N3+H]+、m/z71.069 0 [M-COOHCH4N3+H]+、m/z70.065 8 [M-CO2-H2OCH4N3+H]+、m/z60.056 3 [M-NH3-COOHC4H5+H]+,通过文献对照[24]确定为精氨酸。龙葵茎中鉴定的其他氨基酸还包括缬氨酸、焦谷氨酸、色氨酸、组氨酸、苯丙氨酸和酪氨酸等。
3.1.5 脂肪酸类 龙葵中鉴定到2 种脂肪酸,分别为亚麻酸和棕榈酸。化合物61 在正离子模式下,保留时间为28.09 min,准分子离子峰为m/z257.247 2[M+H]+,二级碎片含有m/z239.178 9 [M-H2O+H]+、m/z199.148 2 [M-C4H9+H]+、m/z155.085 3[M-COOH-C4H8+H]+、m/z117.070 5 [M-COOHC10H9+H]+,鉴定为棕榈酸[11]。
3.1.6 核苷类 文献报道龙葵中含有少量的核苷类化合物[5],本研究在正离子模式下共鉴定出5 个核苷类化合物,主要包括腺苷、尿苷、腺嘌呤和次黄嘌呤等。以化合物56 为例,在正离子模式下,保留时间为22.39 min,准分子离子峰为m/z268.104 2[M+H]+,失去1 分子C5H8O4得到m/z136.062 5[M+H-C5H8O4]+,然后失去1 分子NH3得到m/z119.049 4 [M+H-C5H8O4-NH3]+,参照文献报道[11]鉴定其为腺苷。
3.1.7 Compound Discover 3.0 鉴定 将样品和空白溶剂的谱图导入Compound Discover 3.0 软件,设置预测化合物的分子组成为C、H、O、N,将化合物碎片匹配值设置在50%以上,通过CD 数据库进行自动结构指认,导出345 个可能的化合物,手动去除非天然产物、未提取到准分子离子峰的化合物、匹配度低于70%的化合物且没有二级质谱图的化合物,经过二级质谱碎片信息核对,共指认14 个化合物,其中包括上述鉴定的化合物12 个,新鉴定化合物2 个,包括吲哚-3-丙烯酸和6-羟基木犀草素-7-槐糖苷。
3.2 1H-NMR 结果与分析
通过与文献报道、BMRB 数据库中的标准物质图谱对照,并对1H-NMR 图进行分析(图6),共指认出27 个化合物(表2)。1H-NMR 图谱可以分为3个区域:高场区(δ0.00~3.56)主要包括有机酸、氨基酸,如乳酸δ1.35 (d,J=6.0 Hz)、丙氨酸δ1.48(d,J=7.2 Hz),异亮氨酸δ1.02 (d,J=6.6 Hz)、δ0.94(t,J=7.2 Hz),亮氨酸δ0.96 (d,J=6.0 Hz)、δ0.98(d,J=6.0 Hz) 等;碳水化合物区 (δ3.56~5.50) 主要为糖基,包括α-葡萄糖基δ5.21 (d,J=3.6 Hz)、β-葡萄糖基δ4.59 (d,J=7.8 Hz)、蔗糖基δ5.41 (d,J=4.2 Hz);低场区 (δ5.50~9.16) 指认的化合物主要含氮或芳香类化合物,如葫芦巴碱δ9.16 (s),8.10 (t,J=6.6 Hz),8.87 (t,J=8.4 Hz),尿嘧啶δ5.75 (d,J=7.8 Hz),7.52 (d,J=7.8 Hz),尿苷δ5.85 (d,J=4.2 Hz),5.91 (d,J=4.8 Hz),7.93 (d,J=8.4 Hz) 等。通过核磁共振鉴定的27 个化合物中,有6 个化合物(精氨酸、酪氨酸、缬氨酸、苯丙氨酸、尿苷和腺苷)已在质谱中鉴定,另外21 个化合物仅在核磁分析中鉴定。
4 讨论
本研究采用高分辨液质联用技术结合代谢组学技术对龙葵茎进行了化学成分分析。从龙葵茎中共鉴定到化合物89 个,包括甾体生物碱5 个、甾体皂苷28 个、游离氨基酸16 个、咖啡酰基奎尼酸类、脂肪酸类以及核苷类等其他化合物40 个。其中,有54 个化合物在龙葵中首次报道。
甾体生物碱和甾体皂苷是龙葵的特征成分,通过分析已报道的甾体生物碱和甾体皂苷结构变化规律,本研究分别构建了这两类成分的分子网络,并预测了龙葵茎中可能存在的甾体生物碱和甾体皂苷。通过对预测化合物的质谱筛查和碎片特征分析,虽然未检测到新的生物碱,但筛查到新的甾体皂苷分子式6 个,由于皂苷糖链可有多种连接方式,这些皂苷分子式对应潜在的皂苷类化合物16 个。这些皂苷类可能都是未见文献报道的新化合物,但需要进一步通过植物化学分离鉴定手段进行验证。
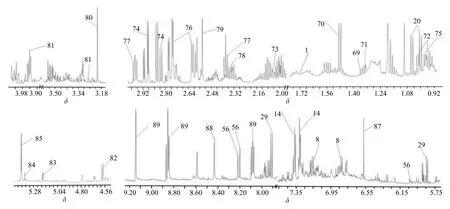
图6 龙葵茎提取物的1H-NMR 图谱Fig.6 1H-NMR spectra of extracts from stems of S.nigrum

表2 龙葵中鉴定化合物1H-NMR 数据归属Table 2 1H-NMR assignments of identified compounds from stems of S.nigrum
此外,本研究使用的核磁共振分析是一种非选择性检测技术,不受液质分析中化合物是否容易离子化和在色谱柱上保留强弱的影响。因此,在中药复杂体系鉴定中,核磁共振与液质联用分析具有互补性。本研究通过核磁图谱分析,进一步鉴定了龙葵茎中27 个化合物,不仅验证了已经在质谱中鉴定的6 个化合物,而且还鉴定21 个未在质谱中鉴定的化合物。核磁共振与液质联用的整合分析,进一步丰富了我们对龙葵茎的化学认识。甾体生物碱是龙葵的特征成分,然而本研究仅在茎中检测到生物碱5 个,说明茎中生物碱的多样性明显低于龙葵果。鉴于龙葵茎在龙葵药材中占有较大的比重,今后的研究还应对龙葵茎的生物活性进一步分析。
利益冲突所有作者均声明不存在利益冲突
