院内多重耐药大肠埃希菌肺炎的耐药现状及影像学特征分析
2021-03-09徐建秀杨春莉徐丽娜刘春梅
刘 婷, 徐建秀, 杨春莉, 徐丽娜, 刘春梅
院内获得性肺炎(hospital acquired pneumonia,HAP)在院内感染中一直占有相当比例,其中因大肠埃希菌所致HAP较常见,尤其因其容易产生超广谱β-内酰胺酶(extended spectrum beta-lactamases,ESBLs)导致多种抗生素耐药,给临床治疗带来困难[1]。本研究回顾性分析了我院2018-07-01~2020-06-30因多重耐药大肠埃希菌(multidrug-resistant Escherichia coli,MDR-ECO)感染所致HAP的情况,对其发生的危险因素进行探讨,总结其影像学特征,以期为临床用药提供参考。
1 资料与方法
1.1一般资料 选择2018-07-01~2020-06-30我院经呼吸道或者血标本分离检测确认的大肠埃希菌所致HAP患者178例的病历资料,根据致病菌是否为多重耐药菌将其分为MDR-ECO组(153例)和非MDR-ECO组(25例)。其中,HAP诊断符合中华医学会呼吸病学分会制定的《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)》[2];多重耐药菌符合《多重耐药菌医院感染预防与控制中国专家共识》的标准[3]。
1.2纳入与排除标准 纳入标准:(1)送检的呼吸道标本(晨起口腔漱口后咳痰标本、气管插管处吸取痰标本或气管镜肺泡灌洗液)或者血标本,均经≥3次痰菌半计量培养或者血培养确认为大肠埃希菌生长;(2)痰标本符合于低倍镜视野下多核白细胞在25个以上,上皮细胞则低于10个。血培养标本均在发热寒战前抽取,抽血部位取双侧肘静脉,每侧均在需氧瓶及厌氧瓶中各留取血样8~10 ml;(3)病例胸影像学资料完整。排除标准:(1)单纯1~2次培养出大肠埃希菌;(2)同一患者重复菌株。
1.3菌株鉴定及药敏试验 采用法国生物梅里埃公司VITEK—2Compact全自动细菌鉴定系统鉴定菌种,抗菌药物敏感试验使用Kirby-Bauer法。质控菌株为大肠埃希菌ATCC25922。操作和结果判读依据2017年美国临床实验室标准化研究所标准[4]。
1.4影像学评估方法 (1)CT检查方法:患者入院时均行Simens 64排高分辨率CT检查,仪器参数设置:电压120 kV,电流240~480 mA,层厚6 mm,矩阵512×512,薄层厚设置为1 mm,窗宽参数为1 500 Hu,窗位参数为-700 Hu;扫描范围自胸廓入口至肾上腺水平。(2)图像质量评价:分别由两名资深影像医师采用3级评分标准分别对患者的CT图像质量进行评价。若存在异议则由一名副主任医师参与讨论并统一最终意见。
1.5一般病历资料收集 通过医院病历系统收集研究对象所在科室、年龄、性别、是否存在基础疾病(包括慢性阻塞性肺病、糖尿病、肾病等)、住院天数、住院期间是否存在侵袭性操作(包括留置尿管、留置深静脉置管、气管插管等)、是否入住重症监护病房(Intensive Care Unit,ICU)以及病情转归等资料信息。
2 结果
2.1MDR-ECO的检出情况与药敏结果 在178例标本中共检出MDR-ECO标本153株(85.96%)。痰培养发现混合感染35例,其中合并肺炎克雷伯菌感染12例,合并假丝酵母菌感染7例,合并铜绿假单胞菌感染3例,合并鲍曼不动杆菌感染3例,合并甲氧西林敏感金黄色葡萄球菌感染3例,合并阴沟肠杆菌感染2例,合并耐甲氧西林金黄色葡萄球菌感染2例,合并克柔念珠菌感染2例,合并曲霉菌感染1例。血培养发现混合感染9例,其中合并白色假丝酵母菌感染4例,合并肺炎克雷伯杆菌感染2例,合并肠屎球菌感染1例,合并鲍曼不动杆菌感染1例,合并曲霉菌感染1例。转归:164例好转,14例死亡。分布科室以呼吸科检出最多(29/153,18.95%),其他主要检出科室还包括血液内科(21/153,13.73%)、神经外科(15/153,9.80%)、急诊科(14/153,9.15%)、肿瘤内科(13/153,8.50%)。药敏试验结果显示,MDR-ECO对多种抗生素有较高的耐药率,对头孢唑林、头孢呋辛及青霉素类耐药率达95%以上,对庆大霉素、氨曲南及环丙沙星耐药率均高达50%以上,对三代头孢菌素头孢他啶、头孢噻肟的耐药率分别为46.41%和83.01%,对四代头孢菌素头孢吡肟的耐药率为30.07%。MDR-ECO对厄他培南耐药率最低,为0.65%;其次为亚胺培南西司他丁和美罗培南,均为1.31%。本研究还分离到了5株对碳青霉烯类抗生素(亚胺培南西司他丁、美罗培南、厄他培南)耐药的大肠埃希菌株。见表1。

表1 153株MDR-ECO的药敏情况

续表1
2.2两组一般病历资料比较 MDR-ECO组合并基础疾病、侵袭性操作、入住ICU、使用免疫抑制剂的人数比例大于非MDR-ECO组,差异有统计学意义(P<0.05)。见表2。

表2 两组一般病历资料比较
2.3影响MDR-ECO感染发生的多因素logistic回归分析结果 以是否感染MDR-ECO为应变量(1=感染,0=未感染),将表2中有统计学意义的指标作为自变量(合并基础疾病、侵袭性操作、入住ICU、使用免疫抑制剂,赋值方式均为1=是,0=否)进行多因素logistic回归分析,结果显示,合并基础疾病、入住ICU是发生MDR-ECO感染的危险因素(P<0.05)。见表3。
2.4两组影像学特征比较 与非MDR-ECO组比较,MDR-ECO组病变多累及双侧肺部,有斑片渗出、实变、间质改变、空洞的比例以及无结节的比例较高,差异均有统计学意义(P<0.05)。见表4。
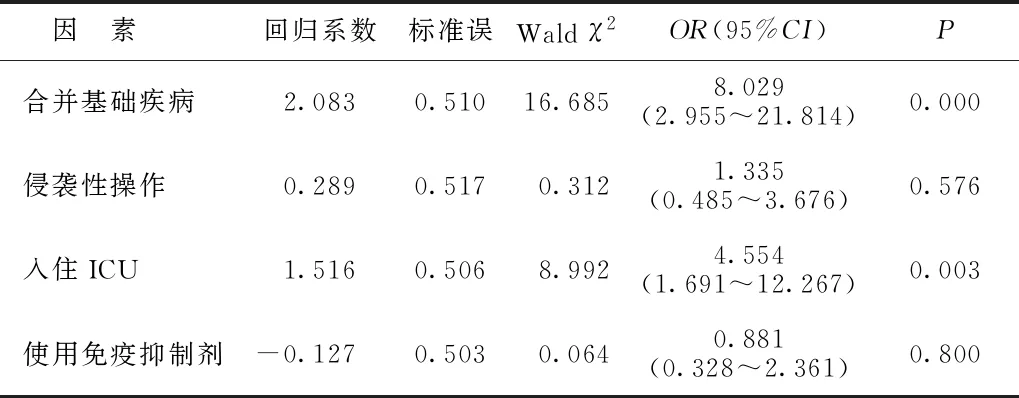
表3 影响MDR-ECO感染发生的多因素logistic回归分析结果

表4 两组影像学特征比较(n)
3 讨论
3.1大肠埃希菌是肠道中的重要正常菌群,为宿主提供一些具有营养作用的合成代谢产物,但当宿主免疫力或细菌侵入肠道外组织器官后,其可成为机会致病菌,引起肠道外感染[5]。CHINET 2019年共临床分离菌株249 758株,其中主要来自呼吸道分泌物(40.7%),在分离出的107 575株肠杆菌科细菌中,大肠埃希菌占44.2%(位居第1位),可见大肠埃希菌致肺部感染仍不能小觑[6]。本研究结果显示,MDR-ECO占分离到大肠埃希菌的85.96%,提示MDR-ECO在临床上仍较多见。MDR-ECO耐药率最低的前三种药物分别为厄他培南(0.65%)、亚胺培南西司他丁(1.31%)和美罗培南(1.31%);其他耐药率较低的药物还有头孢替坦(3.28%)、头孢哌酮舒巴坦(5.88%)、阿米卡星(7.84%)和头孢西丁(11.11%);对三代和四代头孢菌素耐药率为30%~83%;对庆大霉素、复方新诺明、氨曲南及环丙沙星耐药率均高达50%以上,这与谢景锋和段俊林[7]的报道相似。本研究中发现5株耐碳青霉烯类药物的大肠埃希菌(3.26%),较陈胜男等[8]的研究报道高,提示耐碳青霉烯类药物大肠埃希菌有增高趋势。
3.2生产ESBLs是大肠埃希菌对β-内酰胺类抗菌药产生耐受的决定性机制,其中耐药基因类别较多,包括CTX-M、TEM、SHV和OXA等基因型及其他不常见基因型[9],这也提示我们在今后的研究中要注意MDR-ECO耐药基因型的分析。本研究发现引起HAP的MDR-ECO对哌拉西林他唑巴坦的耐药率为3.28%,对头孢哌酮舒巴坦耐药率为5.88%,考虑是由于他唑巴坦为不可逆β-内酰胺酶抑制剂,稳定性较好,对ESBLs的抑制作用比舒巴坦强,而且对ESBLs有不可逆的竞争抑制作用,从而大大增强哌拉西林的疗效[10]。
3.3大肠杆菌耐碳青霉烯类药物的机制主要由于碳青霉烯酶的产生以及细胞膜渗透性的改变[11]。为应对多重耐药菌所致感染,近年来已有学者对新型药物进行临床研究以替代碳青霉烯类药物。Chakravorty和Arun[12]应用新型抗生素佐剂实体[头孢曲松+舒巴坦+乙二胺四乙酸二钠盐(CSE-1034)]作为经验疗法对患有HAP、呼吸机相关性肺炎和复杂尿路感染的老年患者进行治疗,MDR-ECO为主要病原,结果表明CSE-1034的敏感度为86%,且对大肠杆菌的敏感度达94%。
3.4本研究显示,MDR-ECO对环丙沙星的耐药率达71.90%,处于较高水平。MDR-ECO对氟喹诺酮类药物耐药机制是药物作用靶位改变、膜通透性降低及主动外排活跃、质粒介导等多种因素可单独或协同作用的结果[13]。另外,本研究中MDR-ECO对阿米卡星耐药率为7.84%,而对同为氨基糖苷类的庆大霉素的耐药率高达59.48%,产生差异的原因可能与丁胺卡那霉素的结构有关,其经过改造后能够抵抗氨基糖苷修饰酶的分解,从而降低了耐药性[14]。
3.5本研究显示,MDR-ECO主要检出于呼吸科,其他主要检出科室还包括血液内科、神经外科、急诊科、肿瘤内科,这与白晓等[15]的报道相似,其原因可能与呼吸内科住院患者普遍为年老体弱者,常合并多种基础疾病且自身免疫功能较低下有关。展冠军等[16]的报道显示,检出大肠埃希菌耐药率较高的科室主要是泌尿外科、ICU和呼吸内科,而后两者主要以下呼吸道感染标本为主,提示MDR-ECO仍是HAP的主要致病菌之一。本研究结果显示,合并基础疾病、入住ICU、侵袭性操作、使用免疫抑制剂与MDR-ECO感染可能相关,其中合并基础疾病、入住ICU是发生MDR-ECO感染的独立危险因素,这与临床相关报道结果相似[17]。首先,气管插管以及留置胃管、尿管等侵入性操作会损伤机体黏膜,形成创口[18]。其次,经气管插管使用呼吸机的患者由于口咽部、鼻部、胃肠道的定植菌移位、机械通气时间长和呼吸机管道污染等因素易导致呼吸机相关肺炎[19]。第三,管道有利于细菌依附,且不易清除。因此,应根据患者病情及时拔除置管,有利于控制HAP的发生。免疫抑制剂可抑制人体的免疫功能,长期应用,尤其是应用剂量较高时,可诱发或加重感染。有报道显示,在住院患者中,产ESBLs(-)组大肠埃希菌的三代头孢菌素使用率显著低于产ESBLs(+)组(40.3% vs 81.1%),提示减少三代头孢菌素用量有利于降低产ESBLs菌株的出现[20],合理用药对于控制MDR-ECO感染的发生意义重大。
3.6MDR-ECO所致HAP的影像学检查结果显示,与非MDR-ECO组比较,MDR-ECO组病变多累及双侧肺部,有斑片渗出、实变、间质改变、空洞以及无结节的比例较高。这应与金黄色葡萄球菌肺炎以双肺实变影、合并磨玻璃影为最常见征象相区别,金黄色葡萄球菌肺炎常见结节合并空洞、气-液平面和胸腔积液[21]。毛旖川等[22]对18例多重耐药肺炎克雷伯杆菌肺部感染的病例进行分析发现,其影像学征象以胸腔积液最多见,并以双侧为主,其中77.8%为少量。本研究中MDR-ECO组有62例(40.52%)患者出现胸腔积液,但与非MDR-ECO组比较差异无统计学意义(P>0.05)。信瑞强等[23]发现鲍曼不动杆菌肺感染胸部CT最常见的3种变化是弥漫磨玻璃改变、实变、胸腔积液。可见大肠埃希菌肺炎影像改变与以上其他肺炎的影像学改变有所差异,临床中应鉴别诊断,当然确诊的关键还有赖于病原学检查。
综上所述,HAP中MDR-ECO发生情况严峻,对多种抗生素耐药率高。合并基础疾病、入住ICU、侵袭性操作、使用免疫抑制剂与MDR-ECO感染发生相关。MDR-ECO多在呼吸内科检出,其次为血液内科、神经外科、急诊科、肿瘤内科。MDR-ECO致HAP患者影像学检查多见病变累及双侧肺部,斑片渗出。为了更好地应对院内MDR-ECO肺炎,应联合药敏试验及临床流行病学证据,积极与微生物实验室和影像科沟通,及时确诊,遏制细菌耐药。
