焦亡的分子机制及其在血液肿瘤中的研究进展
2021-03-09赵明一杨明华
郑 虹, 赵明一, 杨明华
根据细胞死亡的分子机制特点,细胞死亡命名委员会(Nomenclature Committee on Cell Death,NCCD)于2018年将细胞死亡分为凋亡、坏死、程序性坏死、焦亡和铁死亡等[1]。近来,在各种细胞死亡方式中,焦亡受到越来越多的关注。NCCD将其划分为程序性细胞死亡(programmed cell death,PCD)的一种:经炎症性Caspase激活启动,由Gasdermin蛋白家族形成质膜孔介导产生。焦亡的研究始于20世纪90年代。1992年,Zychlinsky等[2]首先发现了细胞焦亡现象,他们观察到福氏志贺菌感染的巨噬细胞中有一种溶解形式的细胞死亡。由于这种细胞死亡与凋亡非常相似,因此在当时被误认为是“细胞凋亡”。1997年,Hilbi等[3]发现福氏志贺菌可以激活宿主细胞中的Caspase-1。1999年,Hersh等[4]进一步发现,敲除Caspase-1后,可以阻断该种细胞死亡。2001年,Cookson和Brennan[5]发现这种细胞死亡明显区别于凋亡,并将其正式命名为焦亡(pyroptosis)。在那之后,关于焦亡的研究逐渐增加。2015年,第一个焦亡相关蛋白——Gasdermin-D(GSDMD)被发现。研究[6~8]显示,GSDMD蛋白被Caspase-1/4/5/11裂解,释放N端片段,转移至胞膜形成孔道,从而引起细胞焦亡。随着研究的深入,其他的Gasdermin家族成员,如GSDMA、GSDMB、GSDMC、DFNA5/GSDME和DFNB59等逐渐被发现[8,9]。Wang等[7]证实,GSDME在Caspase-3的作用下裂解释放N端片段也能诱导细胞焦亡,其机制与GSDMD诱导焦亡是类似的。此外,2018年有研究表明,在耶尔森氏菌感染的过程中,Caspase-8可诱导GSDMD裂解,从而导致细胞焦亡[10,11]。Kambara等[12]报道中性粒细胞弹性蛋白酶(neutrophil elastase,NE)能裂解GSDMD,诱导中性粒细胞焦亡。2020年,Liu等[13]发现在嵌合抗原受体(chimeric antigen receptor,CAR)T细胞治疗过程中,肿瘤细胞的焦亡会触发细胞因子释放综合征(cytokine release syndrome,CRS)。细胞焦亡研究的时间表见图1,细胞焦亡的分子机制见图2。焦亡与多种人类疾病密切相关,其中包括血液肿瘤。深入研究焦亡的机制及其与血液肿瘤的关系,将拓宽我们对血液肿瘤的认识。本文综述了焦亡的机制及其在血液肿瘤中的研究进展,为焦亡和血液肿瘤的后续研究提供参考。

图1 焦亡研究进展图
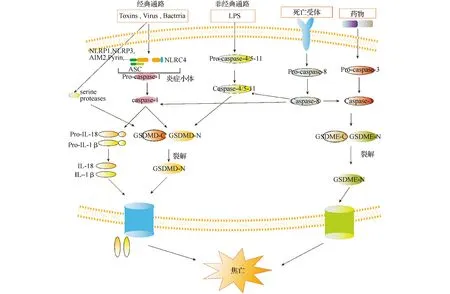
图2 焦亡的分子机制图
1 焦亡的信号通路
1.1炎症小体的活化 炎症小体是一种多分子复合体,其重要组成部分是模式识别受体(pattern recognition receptors,PRRs),即膜相关受体样激酶或受体样蛋白[14]。PRRs可以识别多种病原体相关分子模式(pathogen-related molecular patterns,PAMPs)和损伤相关分子模式(damage-related molecular patterns,DAMPs)[15]。在识别PAMPs和DAMPs后,PRRs直接或通过凋亡相关斑点样蛋白(apoptosis-related spot-like protein,ASC)募集Caspase-1[16]。经典途径由Caspase-1介导,而非经典途径由Caspase-4/5/11介导。
1.2Caspase-1介导的经典焦亡途径 构成炎症小体的PRRs包括NOD样受体NLRP1(NLR family pyrin domain-containing 1)、NLRP3、NLRC4(NLR family CARD domain-containing 4),Toll样受体(Toll-like receptors,TLRs)和AIM2样受体(AIM2-like receptors,ALRs)。不同的PRR识别特定的PAMPs和DAMPs,并启动组装以招募和最终促进Caspase-1的活化[17]。当PRR被刺激后,Caspase-1被直接或通过ASC招募,形成Caspase-1依赖的炎症小体[16]。炎症小体组装后,Caspase-1被激活,从酶原转换成蛋白酶,发挥进一步的重要作用。活化的Caspase-1可以将前IL-1β和前IL-18裂解为IL-1β和IL-18,并促进其分泌,起促进炎症作用。根据目前的研究,GSDMD是引发焦亡的关键效应分子[18]。活化的Caspase-1可以将GSDMD裂解为22 kDa的C末端片段(C-terminal fragment,GSDMD-CT)和31 kDa的N末端片段(N-terminal fragment,GSDMD-NT)[6,18]。GSDMD-NT可以转移到细胞膜,与磷脂酰肌醇、磷脂酸和磷脂酰丝氨酸特异性结合,形成由16个生物小体组成的内径为10~14 nm的孔[8]。相反,GSDMD-CT可以抑制GSDMD-NT的活性[8]。
1.3Caspase-4/5/11介导的非典型焦亡途径 研究[19]表明,存在非Caspase-1介导的焦亡途径。非经典途径由Caspase-4/5/11介导,他们是由革兰阴性菌中的脂多糖(lipopolysaccharide,LPS)刺激而活化。与Caspase-1作用相同,激活的Caspase-4/5/11作用于GSDMD使其裂解。此外,研究[20]表明,活化的Caspase-4/5/11还可在NLRP3和ASC的介导下促进Caspase-1的功能,活化的Caspase-1可以通过经典途径进一步增强细胞焦亡。值得注意的是,非经典途径不能直接活化IL-1β和IL-18,他们的活化是由Caspase-1介导的。Caspase-1对于GSDMD的裂解不是必需的。
1.4焦亡的其他调节途径 2017年,Rogers等[21]发现在凋亡过程中激活的Caspase-3可以通过从DFNA5(deafness,autosomal dominant 5)/GSDME裂解产生的N末端片段诱导焦亡。随后,Wang等[7]证实了GSDME的裂解是由Caspase-3介导的,并且是由某些化疗药物的副作用引起,GSDME可以将Caspase-3介导的凋亡转化为焦亡。有报道[22]二甲双胍也可在焦亡中发挥作用,其机制是通过直接激活AMPK/SIRT1/NF-κB通路或引起线粒体功能障碍,促凋亡蛋白Bax的积聚和细胞色素-C的释放,进而凋亡蛋白Bax和细胞色素-C激活可裂解GSDME的Caspase-3。有研究[10]表明,鼠疫耶尔森氏菌毒力蛋白J(YopJ)通过抑制致病性鼠疫菌感染中的转化生长因子β激活激酶-1(TGF β-activated kinase 1,TAK1),激活Caspase-8,介导GSDMD和GSDME的裂解,从而导致细胞焦亡。有研究[12]表明,中性粒细胞弹性蛋白酶(neutrophil elastase,ELANE)可以介导GSDMD的裂解并产生GSDMD-eNT(elastase-cleaved GSDMD)。GSDMD-eNT作用机制与GSDMD-cNT(Caspase-cleaved GSDMD)相同。值得注意的是,中性粒细胞中GSDMD的裂解不依赖于Caspase。
2 细胞焦亡与血液肿瘤
血液系统恶性肿瘤的发病率在全世界癌症总发病率中位居第6位,在青少年恶性肿瘤病死率中位列第1位[23]。血液肿瘤是一系列血液恶性疾病的总称,主要包括急/慢性白血病、恶性淋巴瘤、多发性骨髓瘤、恶性组织细胞病、骨髓增生异常综合征(myelodysplastic syndrome,MDS)等。传统治疗血液肿瘤的方式主要是化疗和放疗,但这两种方法不能完全杀灭肿瘤细胞,多数患者最终会复发。尤其是这两种方法都缺乏特异性,在杀灭肿瘤细胞的同时,也损伤正常组织细胞,产生严重的毒副作用,甚至危及患者生命。因此,如何对血液肿瘤精准、高效的治疗成为血液肿瘤治疗学领域的热点问题。而随着精准医学的兴起,具有特异性强、毒副反应小特点的生物治疗逐渐取代传统治疗。诱导肿瘤细胞凋亡,是生物治疗的有效方式之一。1992年英国科学家Hickman[24]首次正式提出了可通过诱导肿瘤细胞凋亡的途径治疗肿瘤。至今,诱导肿瘤细胞凋亡逐渐成为研制、开发抗癌药物的重要途径之一。但有些肿瘤具有抗凋亡的特性,且部分肿瘤在治疗一段时间后会出现耐药性。针对这些问题,学者们试图寻找一种可以替代凋亡的细胞死亡方式诱导肿瘤细胞死亡,现在研究热点有铁死亡、坏死性凋亡、焦亡等。焦亡已被证实与多种人类疾病相关,其中就包括血液肿瘤。目前的研究成果展示出肿瘤细胞焦亡治疗具有广阔的应用前景,或将成为人类根治血液肿瘤的有效手段。
2.1细胞焦亡与急性白血病 细胞焦亡在白血病的研究中进展有限。Johnson等[25]发现,DPP8/9抑制剂Val-boroPro可以在人类急性粒细胞白血病(acute myeloid leukemia,AML)细胞系中诱导焦亡,但在其他谱系中则不能。这项研究从细胞焦亡的角度为AML提供了一种新的治疗策略,非常有希望应用于AML临床治疗。三氧化二砷(arsenic trioxide,ATO)是治疗急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)的有效药物。有研究[26]发现抗坏血酸(ascorbic acid,AA)和ATO联合使用可激活Caspase-3诱导细胞凋亡,并可上调Caspase-1的表达,促进炎症小体的形成,从而诱导焦亡。研究证据表明,常规剂量的ATO和AA联合用于结直肠癌(clorectal cancer,CRC)治疗,优于单独使用高剂量的ATO或AA疗法。ATO是APL的典型药物,这项研究的发现为APL或急性白血病的治疗提供了新的角度。Liu等[13]发现,在CAR T细胞治疗B-ALL期间,肿瘤细胞发生焦亡,引发CRS,这抵消了CAR T细胞治疗癌症患者的有效性。本研究发现识别CD19+的CAR T细胞通过释放大量穿孔素和颗粒酶B,激活B-ALL白血病细胞中的Caspase3-GSDME途径,导致细胞焦亡,引发CRS。当前研究揭示了由CAR T细胞诱导靶细胞焦亡,并引发CRS的机制,这为在CAR T疗法中如何减少CRS提供了方向和方法。
2.2细胞焦亡与MDS 先前的研究认为,细胞凋亡是MDS细胞减少的原因。然而,最近越来越多研究表明,细胞凋亡并不能完全解释在MDS看到的细胞死亡。Langemeijer等[27]在比较MDS患者和健康受试者的93个凋亡基因表达情况的研究中,结果没有差异。此外,与细胞凋亡相关的Caspase-3在MDS中也是正常的,相反,Caspase-1则升高[28]。MDS中最具特征性的焦亡炎症小体是NLRP3炎症小体[28]。NLRP3主要由活性氧(reactive oxygen species,ROS)激活。在ROS的作用下,NLRP3募集ASC形成炎症小体,进而激活Caspase-1。Caspase-1激活促进IL-1β和IL-18的激活以及细胞孔道的形成。该过程导致产生更多的DAMPs和ROS,进一步增强MDS细胞焦亡。抑制NLRP3或Caspase-1,能有效改善MDS造血功能[28]。Basiorka等[29]通过流式细胞术对MDS患者的外周血或骨髓浆中的ASC定量实验证实了ASC和焦亡的关系。ASC可作为细胞焦亡的一个灵敏度和特异度都较高的生物标志物,在未来治疗研究中有关炎症小体抑制方面有潜在应用价值。未来的研究应关注:ASC是否可作为MDS进展的标志物,“炎症”是克隆造血的驱动因素,还是克隆造血导致炎症状态,目前这两种机制都有研究支持。鉴于NLRP3在MDS焦亡中的作用,抑制NLRP3炎症小体是MDS的一种有效治疗策略。IRAK1、IRAK4是NLRP3的小分子抑制剂,对MDS的造血干/祖细胞(hematopoietic stem/progenitor cell,HSPC)具有选择性细胞毒作用,并与B淋巴细胞瘤-2(B-cell lymphoma-2,BCL-2)拮抗剂具有协同作用[30]。在MDS,IRAK4的另一个作用方式是抑制NF-κB的激活,从而抑制NLRP3转录启动。1型干扰素可以通过双重机制抑制IL-1β的产生,包括STAT1介导的抑制NLRP3的激活,以及通过增加IL-10,继而减少前IL-1β。但有促进NF-κB通路激活,产生炎性细胞因子的风险[31]。最典型的NLRP3炎症小体抑制剂是磺酰脲衍生物MCC950(也称CP-456,773)。MCC950对NLRP3活化的经典和非经典途径都高度特异[32]。尽管MCC950在临床前模型疗效良好,但其临床应用受到肝毒性的限制。Bruton′s酪氨酸激酶(Bruton′s tyrosine kinase,BTK)通过与ASC和NLRP3直接相互作用,是调节NLRP3炎症小体的关键分子[33]。Liu等[34]通过蛋白质组学研究表明,BTK是NLRP3炎症小体激活的有效调节因子。BTK抑制剂ibrutinib可以抑制ASC的募集和Caspase-1的活化。在MDS治疗中,ibrutinib与lenalidomide(NCT03359460)和azacitidine(NCT02553941)的联合疗效研究正在进行。
3 结论与展望
细胞焦亡是一种新的程序性细胞死亡类型,由Gasdermin蛋白家族介导。诱导癌细胞凋亡是治疗恶性肿瘤的有效方法,但肿瘤的一个重要特征是抗凋亡。因此诱导癌细胞焦亡,在抗凋亡肿瘤的治疗中尤为重要。然而,对于焦亡在癌症研究中的作用,尤其是在血液肿瘤中的作用,人们的认识才刚刚开始。近年来,由于焦亡在治疗肿瘤中的巨大潜在价值,许多研究都集中于抑制或促进细胞焦亡。然而,细胞焦亡中释放的炎性因子,会引起机体过度炎症反应。因此,在诱导肿瘤细胞焦亡的同时,如何避免炎性休克是一个非常重要的课题。此外,由于DFNA5/GSDME mRNA的甲基化,在许多肿瘤中DFNA5/GSDME的表达均低于正常细胞[35~40],这使得在这些肿瘤中难以实现焦亡。上调肿瘤的DFNA5/GSDME,可以降低化疗药物耐药性并增强化疗药物敏感性。因此,上调肿瘤DFNA5/GSDME表达的药物将成为未来研究的热点。总的来说,与细胞凋亡、自噬和铁死亡相似,焦亡在癌症的诊断和治疗方面具有巨大的潜在应用价值。为研发基于细胞焦亡的抗癌疗法,需要进行更多的基础研究和临床试验。焦亡在急性白血病中的研究成果相对欠缺,未来对急性白血病相关焦亡机制进行深入研究,将有助于更好地开发有效的抗癌药物。血液肿瘤中焦亡的研究集中在急性白血病和MDS,还未有淋巴瘤相关进展,其中的潜在价值有待研究。
