癫痫清颗粒对阿尔茨海默病模型小鼠血脑屏障的影响
2021-03-09杨彩瑜明彩荣
李 荧,杨彩瑜,贾 冬,明彩荣,齐 越∗
(1.辽宁中医药大学研究生学院,辽宁沈阳 110847;2.辽宁中医药大学附属第二医院,辽宁沈阳 110034)
阿尔茨海默病(Alzheimer disease,AD)是一种以β-淀粉样蛋白(Aβ)异常沉积、tau 蛋白过度磷酸化和神经纤维缠结为主要病理特征的中枢神经退行性疾病,主要表现为学习记忆能力减退和认知功能障碍。血脑屏障由脑微血管内皮细胞、内皮细胞间的紧密连接、星形胶质细胞终足和周细胞组成。研究表明,AD 患者存在血脑屏障损伤[1]。Aβ 作为一种公认的与AD 病理相关的小分子肽,体外研究显示Aβ25-35能够破坏血脑屏障紧密连接结构,引起血脑屏障渗漏[2]。当血脑屏障结构和功能的完整性出现缺失时,会引起中枢与外周分子交换异常、神经元与神经胶质细胞受损、血管氧化应激[3]、脑微血管Aβ 沉积增加等[4],可能会进一步加剧认知功能障碍。
Sigma-1 受体(σ1R)广泛存在于中枢神经系统的神经元、神经胶质细胞和相关的免疫和内分泌组织中。多种研究表明,σ1R 在改善AD 模型动物学习记忆能力方面表现出积极的作用。癫痫清颗粒是临床经验处方,具有豁痰息风、活血化瘀、开窍益智的功效。本研究利用Aβ25-35致AD小鼠模型,并给予癫痫清颗粒和σ1R 拮抗剂,观察癫痫清颗粒对于AD 模型小鼠血脑屏障功能的影响及其相关机制,旨在为AD 防治提供更广泛的理论基础。
1 材料
1.1 动物 96 只SPF 级ICR 雄性小鼠,体质量为20~24 g,购于辽宁长生生物技术股份有限公司,许可证号SYXK(辽)2013-0009。
1.2 药物与试剂 癫痫清颗粒(辽宁中医药大学附属第二医院,批号20140110,生药含量为5.31 g/g);盐酸多奈哌齐片[卫材(中国)药业有限公司,5 mg/片,批号140 606 A];Aβ25-35(美国Sigma 公司,货号A4559,批号038M4822 V);BD1047(TOCRIS 公司,货号138356-21-5,批号4A/219731);EB(伊文斯蓝,上海瑞永生物科技有限公司,货号RS1049-5 g,批号RS18B1116);鼠抗胶质纤维酸性蛋白(GFAP,北京博奥森生物技术有限公司,货号bsm-33065 M,批号AH03099387);兔抗血管内皮生长因子(VEGF,北京博奥森生物技术有限公司,货号bs-1313R,批号AB9071709);TRIzol(武汉谷歌生物科技有限公司,批号171025);逆转录试剂盒(悠扬生物科技有限公司,货号RT-01001,批号095634);Cx43、 occludin 引物由华大基因生物科技有限公司提供;实时定量PCR 扩增预混合液[2×SYBR qPCR Master Mix(Universal)](悠扬生物科技有限公司,货号R-01001,批号190601)。
1.3 仪器 DW-200 型脑立体定位仪(成都泰盟科技公司);微量进样器(上海安亭微量进样器厂,规格10 μL);Y 迷宫(辽宁中医康复中心);MT-200 型Morris 水迷宫(成都泰盟科技公司)。
2 方法
2.1 分组 96 只雄性小鼠适应性饲养1 周,按体质量随机分为假手术组、模型组、癫痫清颗粒组、盐酸多奈哌齐组、BD1047 组和癫痫清+BD1047 组,每组16 只。
2.2 造模 350 mg/kg 水合氯醛麻醉小鼠后,固定,剪毛,碘伏、酒精消毒头部皮肤。切开小鼠头部皮肤约2 cm,找到囟门位置,以囟门为原点,向右移动1 mm,向后移动0.5 mm,深度为3 mm,微量进样器缓慢注射3 μL 老化的Aβ25-35,弥散5 min。消毒后伤口处涂抹适量青霉素钠粉末,缝合伤口,涂抹火棉胶。置于鼠笼中饲养,注意术后保暖。假手术组注射等体积无菌生理盐水。
2.3 给药 造模第2 天开始灌胃给药癫痫清颗粒(12.48 g/kg,按生药量计,每克含有5.31 g 生药)和盐酸多奈哌齐(1.3 mg/kg),给药量为20 mL/kg,拮抗剂BD1047(1 mg/kg),为腹腔注射给药,每日1 次,连续给药21 d,各组动物无死亡,小鼠状态良好。假手术组和模型组小鼠灌胃等体积蒸馏水并腹腔注射等体积无菌生理盐水。
2.4 Y 迷宫实验 Y 迷宫可用于评估小鼠的短期记忆能力[5],第15 天给药结束后1 h 对所有实验动物进行Y 迷宫实验。Y 迷宫装置由长40 cm、宽15 cm、上口9 cm、下底5 cm 的3 个互为120 °夹角的木质支臂组成,依次标为A、B、C。将小鼠放在Y 迷宫交叉点,任其自由探索8 min,记录小鼠进入3 个臂的总次数(N)和进臂顺序。以连续进入3 个不同支臂为1 次正确交替反应,记录正确交替反应次数。用自发交替反应率反映实验动物的空间工作记忆能力。自发交替反应率=正确交替反应次数/(N-2)×100%[6]。
2.5 水迷宫定位航行实验 对所有动物进行水迷宫实验。Morris 水迷宫定位航行实验考察动物空间学习的记忆能力。Morris 水迷宫为直径80 cm、高33 cm 的白色圆桶状装置。将水迷宫装置分为4 个等面积的扇形区域,分别记为第一至四象限。平台为俯视圆形,侧视工形的白色金属装置。平台位于第一象限扇形区域中间位置。桶内装水,水中混匀可食用白色素掩盖平台位置,保持水面高于平台1 cm。第16 天给药结束后1 h 所有实验小鼠进行Morris 水迷宫定位航行实验。将小鼠面壁腹部朝内放入水中,1 min 内小鼠从入水到登上平台的时间为潜伏期。若小鼠在1 min 内未能成功登台,则潜伏期为60 s。每天游泳2 次,间隔4 h,连续游泳5 d。
2.6 伊文斯蓝渗漏实验 空间探索实验结束后,在每组动物中随机选取6 只小鼠,尾静脉注射2%的伊文斯蓝溶液(4 mL/kg),全身循环3 h 后,用350 mg/kg 水合氯醛麻醉,心脏灌流生理盐水至流出液体透明为止,断头取脑,称量大脑湿重。将大脑置于有锡纸包裹的离心管中,每例样本加入3 mL 甲酰胺,剪碎大脑,45 ℃水浴孵育72 h 后离心取上清。酶标仪(632 nm)测定吸光度值。
将伊文思蓝溶解于甲酰胺中,终质量浓度分别为8、4、2、1、0.5、0.25、0.125 μg/mL,45 ℃避光水浴72 h。空白孔为等体积甲酰胺溶液,酶标仪(632 nm)测定吸光度,制作标准曲线。根据标准曲线计算每克脑组织含伊文斯蓝的质量(μg/g)。
2.7 免疫组化染色检测VEGF、GFAP 表达 空间探索实验结束后,在每组动物中随机选取6 只小鼠制备常规石蜡切片,切片经过脱蜡水化、内源性过氧化氢酶灭活后,进行抗原修复、封闭、4 ℃孵育一抗过夜。次日PBS 冲洗、孵育生物素化二抗,DAB 染色,苏木素复染。中性树胶封片。显微镜镜下观察目标抗原表达。每只小鼠各取10 张冠状切片,每张切片随机选取5 个不同的视野。阳性结果为细胞内表达棕黄色颗粒。用JEOA 801D 形态学图像分析系统,计算各组阳性细胞平均光密度值。
2.8 Cx43、 occludin mRNA 检测 每组动物随机选取4 只小鼠,用TRIzol 法提取皮层组织总RNA,使用紫外吸收测定法、变性琼脂糖凝胶电泳法测定总RNA 浓度和纯度。浓度和纯度测定结束后,进行逆转录反应,反应1,5×gDNase Mix 2.0 μL,Template(RNA)5 μL,RNase-Free ddH2O 3 μL,42 ℃2 min,4 ℃+∞;反应2,反应液1 取10 μL,5×RO-Easy Mix 4 μL,RNaseFree ddH2O 6 μL,37 ℃15 min,85 ℃5s,4 ℃+∞;将cDNA 配置于Realtime quantitative PCR 反应体系中。cDNA 0.4 μL,正向引物(10 μmol/L)0.4 μL,反向引物(10 μmol/L)0.4 μL,2×SYBR Green Fast qPCR Mix with Low Rox 10 μL,ddH2O 8.8 μL,95 ℃2 min;95 ℃15 s,60 ℃1 min,72 ℃1 min,40 cycles;95 ℃15 s,60 ℃1 min,95 ℃15 s,60 ℃15 s。得到Ct值,以β-actin 作为内参基因进行校准,以2-△△Ct进行分析。引物序列,Cx43 正向(5′to 3′)CTAGGTGTGGATGGACCTTATG,反 向(5′ to 3′)ATCATTTGGTGAGGGTGAGG;occludin 正向(5′to 3′)GCCCTCAGGTGACTGTTATTTA,反向(5′ to 3′)CTGCCTTAGTTTCA GTTTG;β-actin-正 向(5′ to 3′)GTCCCTCACCCTC CCAAAAG,反向(5′to 3′)GCTGCCTCAACACCTCAACCC。
2.9 统计学分析 采用SPSS 17.0 软件进行数据分析,实验结果以()表示,多组间比较单因素方差分析或双因素方差分析,以P<0.05 表示差异具有统计学意义。
3 结果
3.1 Y 迷宫实验 Y 迷宫用于评估空间识别记忆能力,各组小鼠进入支臂总次数无差异,说明癫痫清颗粒对小鼠自发活动没有明显影响。与假手术组比较,模型组自发交替反应率下降(P<0.05);与模型组比较,癫痫清颗粒组和盐酸多奈哌齐组自发交替反应率增加(P<0.05),BD1047组和癫痫清+BD1047 组自发交替反应无差异。见图1。

图1 癫痫清颗粒对AD 小鼠Y 迷宫实验的影响(,n=16)
3.2 水迷宫定位航行实验 水迷宫前3 天各组小鼠游泳潜伏期无差异;第4 天,与假手术组比较,模型组小鼠游泳潜伏期增加(P<0.01);与模型组比较,癫痫清颗粒组和盐酸多奈哌齐组小鼠游泳潜伏期缩短(P<0.01,P<0.05),BD1047 组和癫痫清+BD1047 组潜伏期比较模型组虽有降低,但差异无统计学意义;第5 天,与假手术组比较,模型组游泳潜伏期增加(P<0.01);与模型组比较,癫痫清颗粒组和盐酸多奈哌齐组潜伏期缩短(P<0.01),BD1047组和癫痫清+BD1047 组潜伏期相比模型组虽有降低,但差异无统计学意义。见图2。
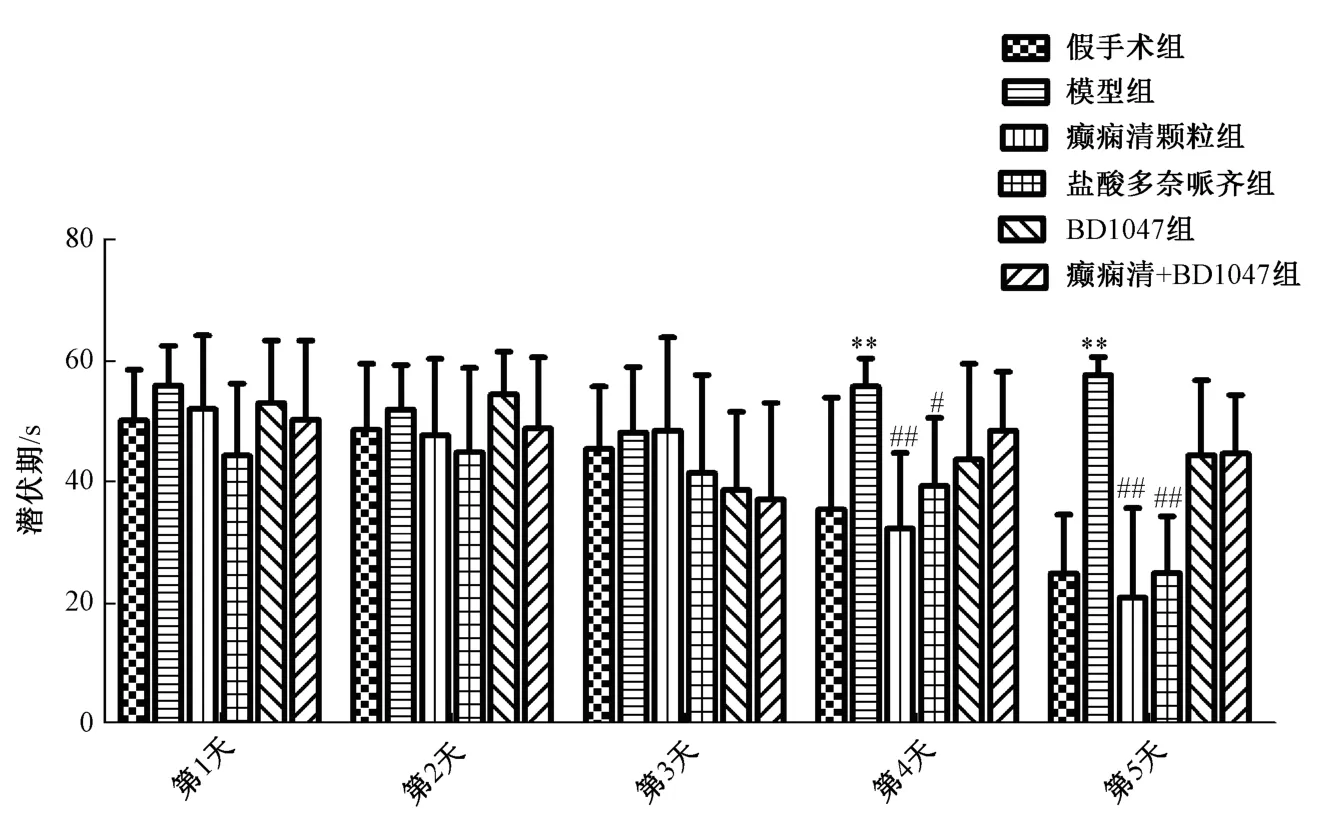
图2 癫痫清颗粒对AD 小鼠潜伏期的影响(,n=16)
3.3 伊文斯蓝渗漏实验 与假手术组比较,模型组伊文思蓝的含量增加(P<0.01);与模型组比较,癫痫清颗粒组和盐酸多奈哌齐组的伊文斯蓝渗漏量减少(P <0.01),BD1047 组和癫痫清+BD1047 组的伊文斯蓝渗漏量与模型组比较差异无统计学意义。见表1。
表1 各组AD 小鼠脑组织伊文斯蓝含量(,n=6)

表1 各组AD 小鼠脑组织伊文斯蓝含量(,n=6)
注:与假手术组比较,∗∗P<0.01;与模型组比较,##P<0.01。
3.4 GFAP 和VEGF 免疫组化染色 与假手术组比较,模型组小鼠海马区域GFAP 表达增多(P<0.01),VEGF 表达减少(P<0.01);与模型组比较,癫痫清颗粒组和盐酸多奈哌齐组海马区域GFAP 阳性表达降低(P<0.01),VEGF阳性表达增加(P<0.01,P<0.05);BD1047 组和癫痫清+BD1047 组的GFAP 和VEGF 表达与模型组比较差异无统计学意义。见图3~4、表2。
表2 各组小鼠海马组织中GFAP 和皮质中VEGF 的表达(,n=6)
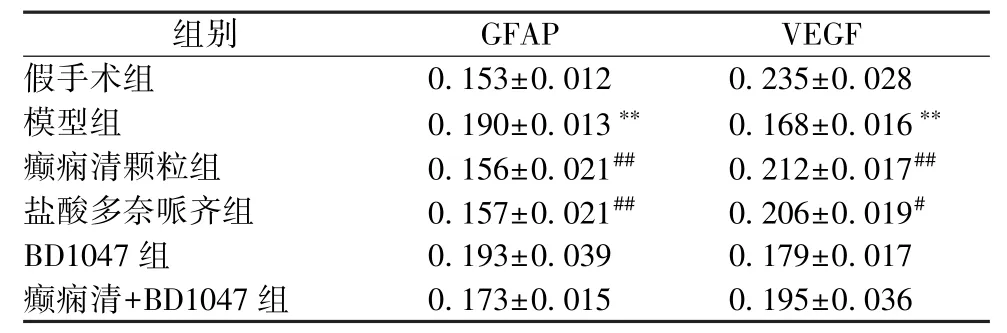
表2 各组小鼠海马组织中GFAP 和皮质中VEGF 的表达(,n=6)
注:与假手术组比较,∗∗P <0.01;与模型组比较,#P <0.05,##P<0.01。

图3 各组小鼠海马组织GFAP 表达(ICH,×400)

图4 各组小鼠皮质部位VEGF 表达(ICH,×400)
3.5 癫痫清颗粒对AD 小鼠皮层Cx43、 occludin mRNA 的影响 与假手术组比较,模型组小鼠皮层Cx43、 occludin mRNA 表达降低(P<0.05,P<0.01)。与模型组比较,癫痫清颗粒组Cx43、 occludin mRNA 的表达升高(P<0.01),BD1047 组Cx43、 occludin mRNA 表达虽有增加,但差异无统计学意义;癫痫清颗粒+BD1047 组Cx43 mRNA 表达,与模型组比较,差异无统计学意义,但occludin mRNA 表达增加(P<0.05)。见图5。
4 讨论
Zlokovic 等[7]首次提出了AD 的神经血管假说,该假说认为Aβ 在血脑屏障清除的障碍,异常血管生成和脑血管系统的老化可能会引发神经血管退化、脑灌注不足和神经血管炎症,最终导致血脑屏障损伤、内环境失衡以及突触和神经元功能损伤和丧失。保护血脑屏障结构与功能的完整性是改善AD 病理的可能途径之一。
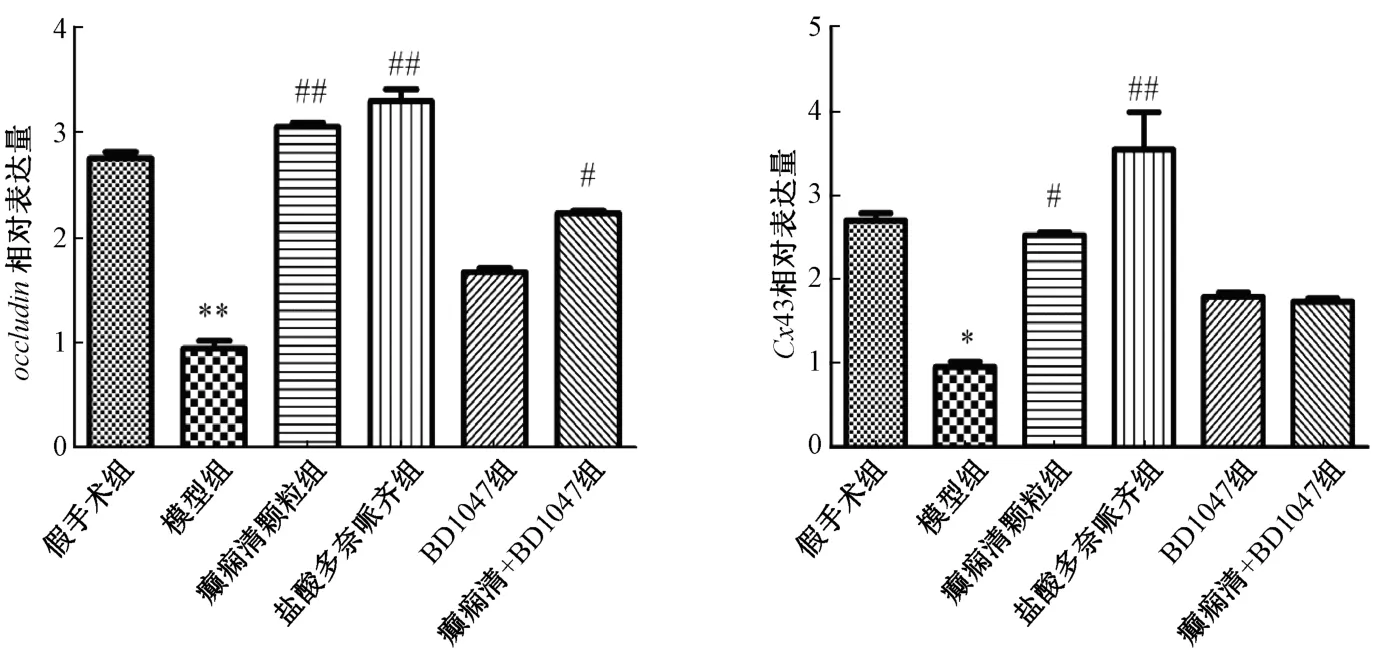
图5 癫痫清颗粒对AD 小鼠皮层Cx43、 occludin mRNA 的影响(,n=4)
脑微血管内皮细胞通过紧密连接结构相互联系是构成血脑屏障的基础。紧密连接结构包括occludin、连接黏附分子(Junction adhesion molecule,JAM)、claudins 和胞质附着蛋白(ZO-1、ZO-2 和ZO-3),其中occludin 是紧密连接结构的主要组成部分[8]。星形胶质细胞作为血脑屏障的重要组成部分,对于调节突触功能、参与脑能量代谢[9]和维持神经元生长等具有重要意义。缝隙连接蛋白43(Cx43)作为星形胶质细胞之间的主要连接蛋白,与血脑屏障通透性密切相关[10]。AD 发生时常伴随着occludin 及Cx43 等多种连接蛋白的丢失和分布异常,星形胶质细胞的过度活化,神经元损伤加重以及血脑屏障的通透性增加[11]。GFAP 是星形胶质细胞的特异性标志物,且在星形胶质细胞活化状态下表达增加。VEGF 主要由星形胶质细胞产生,可特异性的促进血管内皮细胞有丝分裂,参与血管形成[12]。研究表明,AD 中VEGF 含量显著降低[13];增加VEGF 可降低血脑屏障通透性[14],较高的VEGF 水平与记忆改善相关[15]。
癫痫清颗粒处方由石菖蒲(Acorus tatarinowii Schott.)、胆南星(Arisaema cum Bi)、红花(Carthamus tinctorius L.)等11 味中药组成。前期研究结果显示,癫痫清颗粒可通过减少BACE1、PS1 的蛋白表达,抑制Aβ 的生成[16],保护海马神经元[17],进而改善AD 模型动物的学习记忆障碍。在本研究中,AD 模型小鼠VEGF、 Cx43 和occludin mRNA表达显著降低,GFAP 水平显著升高,伊文斯蓝渗漏增加,提示血脑屏障受损。癫痫清颗粒给药干预后,小鼠VEGF、occludin 和Cx43 mRNA 表达显著升高,GFAP 水平显著降低,伊文斯蓝向脑实质渗漏减少,说明癫痫清颗粒可能通过调节脑内VEGF 水平;增加血脑屏障中连接蛋白的表达;抑制星形胶质细胞过度活化,维护血脑屏障功能,进而发挥抗AD 的作用。
σ1R 主要定位于内质网和线粒体相关的内质网膜(MAM),激活时,可通过调节离子通道、蛋白激酶和G 蛋白偶联受体发挥作用[18]。在本研究中,课题组给予AD 模型小鼠σ1R 拮抗剂BD1047 后发现,BD1047 组连接蛋白表达降低,胶质细胞活性增强,说明σ1R 与AD 模型血脑屏障功能有关联。癫痫清颗粒和BD1047 联合用药后,与模型组比较,星型胶质细胞活性、血脑屏障通透性及连接蛋白表达,差异无统计学意义,说明癫痫清颗粒可通过σ1R 降低AD 模型小鼠的血脑屏障通透性,改善其学习记忆能力,发挥抗AD 的作用。
