甲烷选择氧化制甲醇研究进展
2021-03-09孙兰兰武光军关乃佳李兰冬
王 玉,孙兰兰,武光军,关乃佳,李兰冬
南开大学材料科学与工程学院,天津 300350
随着化石能源日益枯竭,可再生能源技术逐渐进入快速发展阶段,开发储量丰富的天然气资源作为当今世界能源需求的过渡解决方案非常重要。几十年来,甲烷作为天然气的主要成分,被用于生产增值化学品,并作为能源载体广泛应用于取暖、运输和发电等方面。水力压裂技术的进步使研究人员对甲烷资源进行了更深入地开发与利用,但在中国37 000 亿立方米的天然气总产量中,由于产地偏远且钻井平台缺乏储存和运输的基础设施,其中约1 500 亿立方米的甲烷气体直接作燃烧处理,浪费量相当于美国天然气消费量的20%,生成的二氧化碳被释放到大气中,占到全球二氧化碳排放量的3%,每年能量损失巨大(>30 EJ)[1-3]。可通过将甲烷直接氧化成常温常压下为液体的高附加值化学品(甲醇)解决该问题[4-5]。
目前甲烷利用的主要工业途径是甲烷转化生成合成气(CO 和H2)、再将合成气催化转化为甲醇[1],这是一条间接的高能耗路线。虽然该路线已经工业规模化验证,但对地方性小规模的设施却不适用[6]。这主要是由于甲烷的间接氧化过程需要蒸汽重整或部分氧化的大型炉式反应器和空气分离装置,高温(>1 200 K)和频繁的合成气清洗步骤使整个操作过程成本极高[7]。因此,开发一种将甲烷直接转化为液体能量载体和化学品的方法至关重要。从液体均相系统到非均相化学循环,研究人员提出了多种方法来解决这个问题,但有效的工业过程仍未实现,这主要归因于三个方面:(1)甲烷活化所需的高势垒(ΔGa>1.2 eV,300 K,101 kPa)[8];(2)甲醇中C—H 键的活性比甲烷中的更高,其键解离能(BDE)比甲烷低0.4 eV,很难阻止甲醇C—H 键被进一步氧化[9-11];(3)甲烷在通常条件下能抵抗大多数氧化还原活性试剂、酸和碱的攻击,这使得高温或高活性反应试剂成为其转化的必要条件[9]。
一个世纪以来,有众多催化体系和化学计量体系应用于不同氧化剂氧化甲烷过程,尽管低温下甲烷的C—H 键活化在热力学和动力学上是可行的,但这些体系都面临初级氧化产物(甲醇)过度氧化的热力学挑战。近年来,研究发现含铜材料可以在一定条件下实现对甲烷的转化且甲醇解吸反应在较低的温度(约473 K)下即可进行,这为甲烷的低温选择性催化氧化提供了可能。但由于甲烷的活化通常要在673 K 以上进行,因而要捕获甲醇作为产物或中间体,必须找到能在低温下有效活化甲烷的方法[12]。随着甲醇需求不断增长,甲烷的低温选择催化氧化也越来越受到研究者的关注。本文详细介绍了以甲烷为原料,模拟甲烷单加氧酶氧化的简单化学反应过程,综述了贵金属及仿生非贵金属催化剂在低温催化氧化甲烷合成甲醇及其衍生物的研究进展,以期对未来甲烷低温活化催化剂的设计开发提供借鉴和参考。
1 酶催化甲烷选择性氧化制甲醇
自然界中甲烷营养细菌可以将甲烷作为其唯一的碳和能量来源进行分解与利用,尽管甲烷中的C—H 键能非常强(ΔH298为416 kJ/mol),这些细菌依旧能够在近室温环境条件下利用甲烷单加氧酶(MMOs)将甲烷氧化为甲醇[13]。甲烷单加氧酶存在两种形式,即可溶性甲烷单加氧酶(sMMO)和颗粒型甲烷单加氧酶(pMMO),如图1 所示,其中,sMMO 的活性中心包含双核Fe 中心,而pMMO 则以Cu 为活性中心[14]。生物酶活性中心结构的精确解析对于仿酶甲烷活化催化剂的设计具有重要的启发作用。

图1 铁和铜基甲烷单加氧酶及分子筛的活性位点结构[14]Fig.1 Active site motifs for Fe-and Cu-based enzymes and zeolites[14]
sMMO 的甲烷氧化活性依赖于羟化酶、调节组分蛋白和还原酶三种蛋白质。sMMO 中的活性位点是一个μ-1,2过氧桥连的Fe-物种,如图2所示,该活性位点也被称为氧活化和甲烷氧化的双铁位点[15-16]。sMMO 中双铁位点、羟化酶蛋白和调节组分的协同作用将羟基转移到甲基并形成甲醇。然后甲醇被甲醇脱氢酶转化为甲醛,甲醇脱氢酶进一步氧化形成甲酸盐并吸收碳。为了复制sMMO 中存在的Fe 位点,研究人员对Fe 交换分子筛进行了大量研究[17]。Dubkov 等[18-20]首次观察到铁交换分子筛中甲烷的部分氧化,证明甲醇可以在循环过程中产生,即铁活性位点首先在高温下(523 K)被N2O 活化形成α-O 位点,之后甲烷在这些活性位点上被活化形成CH3O—和—OH,最后甲醇在水的存在下被萃取。尽管需要利用水来提取甲醇,但表面结合的甲醇证明其可以从α-位点迁移并落位到其他位点上,从而使准催化过程中的活性位点再生。在温度高于473 K 时,甲醇自发解吸完成整个连续过程。Snyder等[21]使用磁圆二色性技术证明活性位点为单核、高自旋的Fe(IV)=O 物种,同时还强调了分子筛拓扑结构的重要性,它在Fe 的周围提供了适当的几何约束以保持空缺的α-O 跨轴位置并产生焓态。但迄今为止,尚未有研究证明温和条件下Fe 中心上O2的活化。
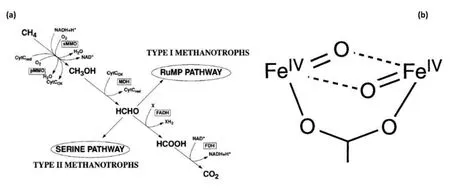
图2 自然界中甲烷氧化菌的甲烷反应机理:(a)甲烷单加氧酶中双铁活性位点氧化甲烷制甲醇机理过程;(b)甲烷单加氧酶中双铁活性位点的结构[15]Fig.2 Methane consumption in nature by methanotrophs (MMO)(a) Proposed catalytic mechanism of di-iron active site in soluble methane monooxygenase (sMMO),which consumes methane to methanol.Methanol produced further converts to formaldehyde and CO2 using enzymes,such as methanol dehydrogenase (MDH),formaldehyde dehydrogenase (FADH),and formate dehydrogenase (FDH).(b) The structure of the di-iron active site in sMMO[15]
与sMMO 中的铁基活性中心相比,pMMO 含有活性铜中心。该酶由三个亚基组成,即pmoA(β),pmoB(α)和pmoC(γ),组装在一个圆柱形α3β3γ3三聚体结构中[22-23]。在该结构中存在三个铜结合位点:(1)单铜位点,该位点仅在荚膜甲球菌pMMO 结构中观察到,因此不认为其在催化中起关键作用[24];(2)pmoB 亚基中的单核和双核铜位点(CuB 位点),纯化或结晶过程中铜的丢失表明CuB 可以作为单铜中心;(3)pmoC 亚基中的铜离子。Ross 等[25]利用生化和电子顺磁共振谱表征,证明pMMO存在两个单铜活性位点:一个位于先前指定的活性位点(CuB)上的可溶性pmoB 亚基上,另一个位于膜结合pmoC 亚基(CuC)约2 nm 处,而这些单铜位点能够催化pMMO 中的甲烷氧化。除此之外,双核活性中心被确定为是具有Cu(I)和Cu(II)氧化态的活性位[25],密度泛函理论(DFT)计算证实了双铜位点对甲烷的活化作用。研究表明pMMO 中混合价态[Cu2(μ-O)2]2+和[Cu2(μ-O)(μ-OH)]2+对甲烷的氢原子抽提具有很高的活性,其反应势垒小于84 kJ/mol[26-27]。为了模拟这个反应过程,Rosenzweig 等[28]提出可以在pMMO 中建立一个双核铜反应区和一个单核铜反应区,Chan 等[29]提出了建立三核铜反应区。鉴于生物催化过程对低碳烷烃活化的催化剂设计具有极大的指示作用,多个研究团队模拟甲烷单加氧酶对甲烷的活化机制,成功开发了金属仿生催化剂并实现了低温条件下连续生产甲醇的过程,但这些催化剂离商业化应用还有一定的距离。下面将重点总结目前仿生催化体系的研究进展,希望可以对未来甲烷活化工业催化剂的设计开发产生一定帮助。
2 甲烷选择氧化制甲醇催化剂的设计开发
甲烷高效催化转化为甲醇是一个非常重要的过程,具有工业应用前景,它提供了一条可持续的路线,并实现了甲烷从丰富且清洁的天然气成分到基础化学合成原料的转变。然而,为这一过程所开发的催化剂仍面临着多重挑战,而其关键在于产物选择性的控制。早期,研究者对催化剂的研究主要集中在金、铂和汞等催化体系,近二十年来分子筛催化剂由于其独特的拓扑结构、择形效应以及配位环境受到越来越多的关注。
2.1 贵金属催化剂上甲烷选择氧化制甲醇
甲烷高效催化转化为甲醇和其他含氧化合物的方法具有极大潜在应用价值。然而,这个反应过程通常要用到价格昂贵且腐蚀性强的氧化剂或反应介质,不适合工业化[30]。据报道,均相催化剂(如汞[31]、铂[32]和钯[33]络合物)可以催化甲烷氧化成甲醇,在大多数情况下,该反应需在高压(2 020~7 070 kPa)、强酸性介质(如发烟硫酸)或相对高温(523 K)下进行。另外,有部分贵金属非均相催化剂用于催化甲烷氧化成甲醇,但大多数催化剂只有在相对较高的温度(423~823 K)和高压(2 020~4 040 kPa)下才有活性[5],在某些情况下,还需要活性位点的预氧化,这在一定程度上增加了过程的复杂性。
Periana 等[31]以HgSO4为催化剂的均相体系,用于甲烷经硫酸氢甲酯选择性催化氧化制甲醇,其中汞离子HgII催化的反应过程是浓硫酸氧化甲烷,生成硫酸甲酯、水和二氧化硫;随后,硫酸甲酯与水反应生成甲醇。当甲烷转化率为50%时,硫酸氢甲酯的选择性为85%(产率为43%,主要的副产物是二氧化碳),产率达到107 mol/(cm3·s)。硫酸氢甲酯的单独水解和二氧化硫与空气的再氧化过程为利用分子氧氧化甲烷制甲醇提供了一个潜在的实用方案。随后,Periana 等[34]进一步设计了一种新的催化剂(联嘧啶基PtII配合物)来取代HgSO4,用于在发烟硫酸中转化CH4。铂催化剂是由双二嗪与两个硫酸氢配体在水中连接形成的一个稳定催化剂。其中一个硫酸氢配体失配后进行C—H 活化,铂中心氧化,SO3还原为SO2,再还原消除硫酸氢甲酯。获得高收率的关键是整个过程中没有游离甲醇(见图3)。硫酸氢盐起着保护基团的作用,这使甲氧基物种比甲醇更不易被过度氧化。因此,可以通过稳定产物来获得高转化率和高选择性。Jones 等[35]开发了一种具有独特的高效亲电甲烷转化催化剂,其阳离子金以SeVI离子作为化学计量氧化剂,在强酸溶剂中催化甲烷低温选择性氧化为甲醇。反应未通过自由基进行,DFT 计算表明AuI或AuIII物种都是可行的催化剂,其机制包括整体亲电C—H 活化和氧化功能化。这与几种基于阳离子HgII,PdII和PtII的体系不同,其对甲醇的选择性超过90%。
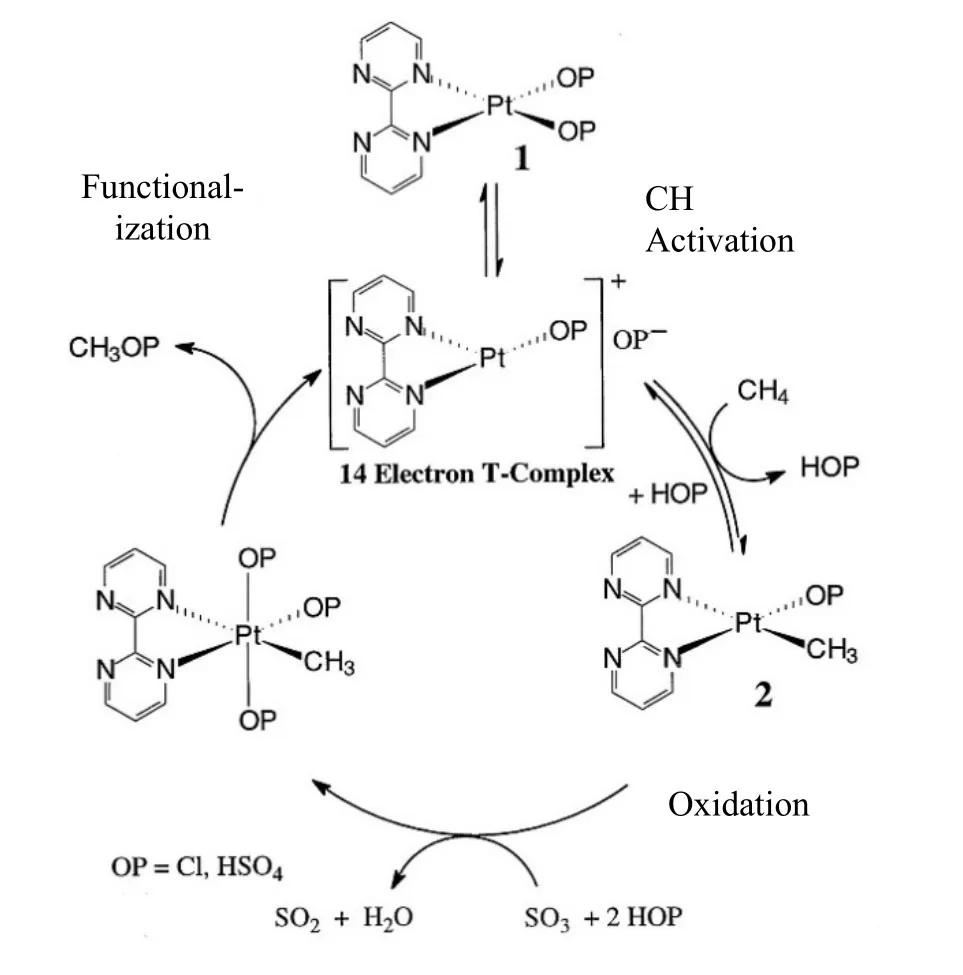
图3 H2SO4催化体系下(bpym)Pt(TFA)2催化甲烷功能化机理[34]Fig.3 Proposed mechanism for the functionalisation of methane using (bpym)Pt(TFA)2 in H2SO4 in the catalytic system[34]
分子催化剂在甲烷选择氧化反应中表现出可观的活性,但存在繁琐的分离过程。为了解决这一问题,Palkovits 等[36]用固体类似物通过共价三嗪基框架(CTF)复制了分子催化剂,CTF 连接PtII离子的方式与Periana 等[31]使用的双氮配体类似,该固体催化剂的性能与Periana 等的催化剂相当,并且连续循环使用5 次性能仍稳定。此外,一系列的铂改性氮掺杂碳催化剂既优于Periana 等开发的分子基催化剂,也优于CTF 基固体催化剂,但稳定性欠佳。尽管硫酸氢甲酯路线是获得非合成气基甲醇的方法,但仍然存在一些固有的缺陷,如SO3是氧化剂,必须从形成的SO2中回收,所需方法要大规模生产硫酸等;此外,所需的化学品腐蚀性强,铂催化剂价格昂贵,因此需要寻找一种新型氧化体系。
为了避免氧化剂的强腐蚀型问题,Shan 等[30]研究了一种锚定在分子筛或悬浮在水溶液中二氧化钛载体上的单核铑物种,在温和的条件下利用氧气和一氧化碳催化甲烷直接转化为甲醇和乙酸。结果表明这两种产物是通过独立的途径形成的,通过间歇式反应器在423 K 进行检测,甲醇收率约22 000 μmol/g,乙酸收率约230 μmol/g,甲醇选择性为60%~100%。Rahim 等[37]利用二氧化钛负载Pd-Au 纳米颗粒,在温和条件下,以H2O2或H2/O2作为氧化剂,在甲烷直接氧化反应中表现出较高的含氧化合物选择性。特别是在该体系中同时使用氧和氢,促进了甲烷转化和H2O2的生成,原位生成的H2O2有利于甲醇的生成,因此获得了较好的甲醇选择性。Agarwal 等[38]采用钯金催化剂在H2O2和O2存在下将甲烷转化为甲醇,在3 030 kPa 和323 K 反应条件下,甲醇的选择性约45%(总有机化合物的选择性为92%)。He 等[39]采用碳纳米管(CNTs)、活性炭、还原氧化石墨烯等碳材料作为催化剂载体,Pd-Au 纳米颗粒作为活性中心,Pd-Au/CNTs 催化剂以氧/氢为氧化剂直接合成甲醇,表现出优异的甲醇收率和选择性。与Pd-Au/CNTs 相比,硝酸处理的Pd-Au/CNTs-n提高了甲醇选择性,但降低了甲醇产量。进一步的研究表明,Pd-Au 纳米颗粒和碳纳米管载体之间的弱相互作用有利于甲醇的生成,而Pd-Au 与活性炭或还原氧化石墨烯催化剂之间强烈的相互作用抑制了反应活性。此工作为温和条件下直接由甲烷合成甲醇提供了一种简单而有效的方法。
2.2 仿生分子筛催化剂上甲烷氧化制甲醇
鉴于负载贵金属的催化剂成本高,产物分离步骤复杂,反应过程需要强氧化剂支撑,催化活性低,很难实现工业化过程,因此研究人员试图寻找一种新的催化体系来实现甲烷的高效转化。受甲烷单加氧酶催化体系的启发,研究者开发了以Fe,Co,Cu 和Zn 为活性金属组分、分子筛为载体的催化剂,实现了甲烷连续氧化制甲醇。这一过程可实现温和条件下甲烷的氧化,并在与水接触时释放部分氧化产物(甲醇、二甲醚和甲酸等)。
2.2.1 Fe 改性分子筛催化剂
自20 世纪90 年代早期Panov 等[40]的开创性工作以来,Fe 改性分子筛已被明确证明在甲烷氧化中具有催化活性,Fe/ZSM-5 能在相对较低的温度(低于573 K)下有效分解N2O,导致高活性的铁氧物种结合在分子筛表面,而其中产生的α-O 物种(N2O +(Fe2+)α→ (Fe3+-O-)α+N2)在后期被认为是甲烷直接部分氧化制甲醇的活性物种,如图4 所示。

图4 DFT 优化后α-O-CHA 模型[47]Fig.4 DFT-optimized structure of α-O-CHA[47]Color scheme:orange=Fe;red=O;gray=Si;light brown=Al
由于Fe-分子筛中存在大量不具活性的铁物种,活性中心的性质和决定反应活性的因素一直难以通过谱学分析揭示。早期研究认为,活性前驱体是类似于MMO 酶系统的双核铁物种,但随着研究的深入,确定活性中心α-Fe 位点是浸渍FeIII物种通过热处理后经不可逆自还原而形成的单核FeII物种。α-O 位上的甲烷到甲醇反应路径遵循自由基的氢原子抽提机制,活性α-O 通过N2O 分解引入到催化剂中,加入甲烷后,一个氢原子被α-O 从甲烷中提取出来,产生一个FeIII-O-H 碎片和一个CH3自由基;这个CH3自由基可以与另一个α-O 反应生成FeIII-O-CH3,该FeIII-O-CH3可以通过水解提取,或者CH3自由基可以再生成为FeII-O(H)-CH3,然后该FeII-O(H)-CH3进一步解吸形成CH3OH[20,41-42]。
Sobolev 等[43]首次报道了Fe-ZSM-5 分子筛表面产生的α-O,并通过实验和理论分析全面研究了α-位和α-O 的性质,其中α-O 在523 K 时是热稳定的,较高的温度下,它被解吸为气相O2。室温下甲烷与α-O 的相互作用进行得非常快,包括在速率控制步骤中提取一个氢原子。红外光谱数据显示反应导致羟基和甲氧基驻留在α位上,一个甲烷分子与两个α-O 原子相互作用:CH4+2(O)α→(OH)α+(OCH3)α。Starokon 等[44]研究了433 K 下N2O 对Fe-ZSM-5 表面甲烷的氧化作用,反应在CH4和N2O 化学计量比为1:1 下发生,并通过增加α-位浓度(100 μmol/g)实现了甲烷直接生成甲醇,形成的甲氧基和羟基吸附在α-Fe 位上,直接在分子筛表面生成甲醇。低温下,这个过程是准催化的,因为甲醇必须通过水解从催化剂表面提取;然而,超过573 K 时,甲醇脱附和整个过程是催化的,但是催化过程中的活性中心结构仍有争议,认为单核Fe4+=O(或Fe3+-O-)及双核氧桥接的Fe3+-O2--Fe3+物种是促进反应的活性中间体[45]。Sazama 等[46]进一步通过Fe-BEA 分子筛表征了α-O 活性位及其α-Fe(II)前驱体,结合磁圆二色性光谱(MCD)和Mössbauer 谱分析以及DFT 和CASPT2 计算研究,将α-Fe 位置确定为BEA 分子筛的β六元环中所携带的骨架外高自旋(S=2)单核亚铁,其具有正方形平面配位,如图5 所示。研究还发现,骨架铝原子在T6/T6′位置的定位对于稳定α-Fe 位点至关重要,通过从N2O 中提取氧原子,α-Fe 位形成反应性α-O 中间体,即具有金字塔形几何结构的单核高自旋(S=2)Fe4+=O 物种。α-O 位点的高反应活性源于其电子结构和分子筛晶格的刚性赋予其空间的跨轴配位位置。Bols 等[47]在CHA 分子筛拓扑结构d6r 复合建筑单元中,首次发现了经N2O 活化后在室温下对甲烷部分氧化具有活性的α-Fe 位点,并建立了CHA 中α-Fe 位点模型,通过CASPT2 计算了配体场跃迁。结果标明该模型α-Fe 优先于其他Fe 物种形成,配对骨架铝对稳定α-Fe 位点十分重要。尽管六元环结合位点的几何形状不同,但Fe-CHA 中α-位点的结构和反应性能与MFI,FER 和BEA分子筛早期报道[43-46]高度相似。Bols 等[47]认为要获得具有更好反应活性的Fe-CHA 材料,必须通过提高CHA 活性位点密度,同时在CHA 孔体系中引入Fe 或Al 对的晶体学定位方式来寻求改进。
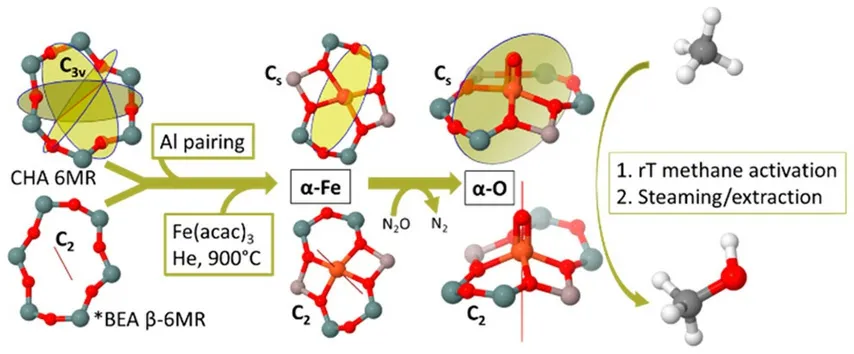
图5 Fe-CHA 和Fe-BEA 分子筛中α-Fe/α-O 活性位点对甲烷C—H 键的低温活化作用[46]Fig.5 The α-Fe/α-O active site in Fe-CHA and Fe-BEA zeolite for the activation of methane C-H Bond[46]
迄今为止,为了在较温和的反应条件下提高甲醇收率,研究人员合成并深入研究了多种甲烷直接氧化制甲醇催化剂。Hammond 等[48]发现含铁分子筛可以在过氧化氢水溶液中选择性氧化甲烷制甲醇。值得注意的是,在适当的反应条件下,甲烷的转化率高达10%,甲醇的选择性为93%。Parfenov 等[49]报道了Fe-ZSM-5 在548 K 下,同时通入N2O,CH4和H2O 可催化生成CH3OH,其中CH3OH 的选择性为62%,CH4转化率为0.19%。尽管这一过程取得成功,但Fe-ZSM-5 催化剂需要在氦气气氛中于900 ℃下进行预处理来生成活性FeII阳离子。为了提高甲醇的选择性,反应需在甲醇形成阶段终止,避免产物进一步氧化成甲酸或一氧化碳和二氧化碳[50]。除此之外,还可通过使用特殊氧化剂(H2O2和N2O 等)或甲烷与氧化剂的空间分离(化学链)来提高目标产物的产率。Hammond 等[51]研究表明将Al3+或Ga3+等三价阳离子加入到MFI 骨架中可以明显促进甲烷制甲醇反应,其中骨架外的Fe 物种被证明是催化剂的活性组分,骨架Fe 物种不构成活性催化中心,但当三价阳离子加入时,首先有利于从分子筛骨架中提取Fe,从而增加活性Fe 物种的形成;其次是提供一个带负电荷的骨架,以稳定和维持骨架外起催化作用的Fe 物种的分散。Chow 等[52]通过研究Fe-ZSM-5,Fe-silicalite-1 和Fe-TS-1等催化剂证明了合适的Brønsted 酸强度有利于促进Fe 基α-O 活性中心进行重要的初始氢提取步骤,而为了使N2O 能够持续有效地氧化甲烷,催化活性中心必须是Fe 与Al 的配位,通过控制催化剂的酸性和Fe 浓度,可以在主要产物易于解吸的情况下提高甲醇的选择性。除此之外,水在含铁分子筛催化甲烷氧化过程中起到重要作用。He 等[53]采用DFT 计算对ZSM-5 负载的双核铁离子催化甲烷氧化反应机理进行了研究,证明了水在反应过程中起到重要作用,其中包含多种双核铁位点团簇,如图6 所示。甲烷在这4 种活性位上氧化成甲醇的反应途径分为甲烷的碳氢键活化和甲醇的生成两个步骤。在[Fe(μ-O)Fe]2+活性位点上,甲醇生成是速控步,而在其他活性位点上,C—H 键活化是速控步。此外,羟基化双核位点[HOFe(μ-O)FeOH]2+和[Fe(μ-O)(μ-OH)Fe]+的羟基能显著促进C—H 键活化,其反应活性高于无水位点[Fe(μ-O)Fe]2+和[Fe(μ-O)2Fe]2+。这种高的反应活性主要归因于末端羟基或桥联羟基的存在,它们既可以提供显著的配位效应,也可以作为甲烷氧化的氧化剂。当水被引入[Fe(μ-O)Fe]2+和[Fe(μ-O)2Fe]2+位点时,水具有很强的配体效应,通过竞争吸附增强甲醇的生成。这对设计高活性甲烷氧化催化剂具有重要的指导意义。
图6 计算模型[53]Fig.6 Computational models[53]
2.2.2 Co 改性分子筛催化剂
含Co 分子筛催化剂可以有效活化甲烷,其中Co-MFI 分子筛催化甲烷制甲醇的反应过程并不连续,主要包括3 个步骤:(1)在空气中焙烧形成活性体;(2)活性体与甲烷在低温(即423 K)下反应;(3)利用极性质子溶剂对强吸附产物进行萃取[54]。Beznis 等[54]首次证明了在Co-ZSM-5 上利用空气在低温下可将甲烷部分氧化为甲醇和甲醛,结果表明制备方法及Co 的形态对甲烷氧化的催化活性和选择性存在极大影响。离子交换位的钴有利于生成甲醛,而浸渍法制得的含Co 催化剂由于主要含有氧化钴物种(CoO 和Co3O4),具有更高的甲醇选择性。通过进一步研究,Beznis 等[55]发现通过改变Co-ZSM-5 分子筛材料的微孔和中孔孔隙率可以调节甲烷对甲醇和甲醛的选择性。在ZSM-5 分子筛材料的微孔结构中加入有机模板剂,经碱性处理后,分子筛团聚体内部形成晶间介孔,外表面积增加。更高的外表面积可容纳更多的Co3O4和CoO 物种,增加了其对甲醇的总体选择性,甲醇的生成量随分子筛外表面积的增加呈线性增加。此外,分子筛骨架阳离子的性质对选择性也是至关重要的。与H 型相比,Na 型ZSM-5 外表面钴含量更高,使得Co-Na-ZSM-5 对甲醇的选择性高于Co-H-ZSM-5 的[56]。
2.2.3 Zn 改性分子筛催化剂
Kazansky 等[57]研究了Zn2+交换分子筛上的甲烷C—H 键解离,发现Zn 物种在分子筛载体上也可以作为甲烷低温活化的位点。近年来,研究者对轻质烷烃(如甲烷、乙烷和丙烷)的活化进行了大量的研究,主要集中在Fe,Co,Ni 和Cu 基分子筛[5,14]。这些材料在氧化剂(如N2O 和O2)存在的条件下可形成对甲烷具有高反应活性的金属-氧团簇,这些高活性团簇的氧原子在低温下可以打开甲烷的碳氢键,但这种金属-氧基活性位点的形成需要较高的预处理温度,不利于工业应用[58]。相反,Zn基催化材料的最大优势是能够直接形成活性物种,无需经过上述的初始高温氧化步骤,因此可能具有更高的工业价值。
然而,目前Zn 基分子筛上甲烷选择氧化制甲醇反应的催化活性较低,研究更多的是停留在理论阶段。相关研究的关键在于初始阶段甲烷的转化,即甲烷如何通过与Zn 改性分子筛表面活性位的相互作用而活化。Barbosa 等[59-60]通过理论计算提出,甲烷的高极化Cδ-—Hδ+键形成CH3离子,CH3离子容易附着在Zn2+离子上生成甲基锌(Zn-CH3)。这种表面物种可以在不同温度下(甚至在室温下)的Zn 改性分子筛上稳定存在。Kolyagin 等[61]研究发现甲烷可以在H-ZSM-5 分子筛中被孤立的Zn2+阳离子上活化,在室温下发生C—H 键的裂解,导致Zn-CH3和O-H 物种的形成。另一方面,Xu 等[62]通过核磁共振谱表征发现,Zn-ZSM-5 在室温下对甲烷的活化导致甲氧基(—OCH3)和Zn-CH3物种的形成。Gabrienko等[63]研究表明Zn-ZSM-5 在室温下的甲烷活化只会导致Zn-CH3的生成,而甲氧基只有在O2存在条件下才会生成,并进一步说明了含氧条件对于锌基分子筛上甲烷活化反应中间体及路径的影响。无氧条件下,Zn2+-ZSM-5 分子筛的Zn2+将甲烷活化生成甲基锌物种;引入氧气后,甲基锌物种被氧化形成表面甲氧基和其他含氧物质,如甲酸盐、乙醛和醋酸等,氧气的存在促进了分子筛表面的甲基锌物种氧化生成表面甲氧基物种,具体机理路线如图7 所示。
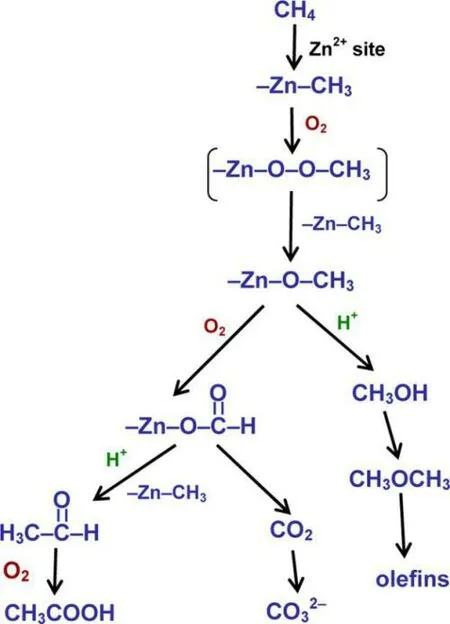
图7 氧存在下Zn2+改性ZSM-5 分子筛催化甲烷转化的可能途径[63]Fig.7 Possible pathways of methane transformation on Zn2+-modified ZSM-5 zeolites in the presence of dioxygen[63]
液体或固态离子交换、浸渍及二甲基锌的化学气相沉积(CVD)等方法均可制备Zn 基分子筛催化剂,在分子筛孔道中可以观察到孤立的Zn2+和小的Zn-O 团簇。然而,目前尚不清楚是Zn2+阳离子还是ZnmOn团簇对甲烷进行活化,与Zn-O 团簇相比,位于分子筛孔内的孤立Zn2+位点可能是更有活性的物种,更有利于对烷烃的活化与催化转化。Shah 等[64]首次报道了Zn 交换MOR 分子筛(Zn/MOR)上甲烷选择性氧化制甲醇反应,其采用CVD 法制备了具有高Zn 交换度的改性分子筛(ZSM-5,FER和MOR 分子筛),研究发现,3 种分子筛均可以活化CH4的C—H 键形成[Zn-CH3]+物种,活性Zn位点的百分比随着分子筛骨架的变化而变化,其在ZSM-5,MOR 和FER 分子筛上分别为5.7%,1.2%和0.5%,但不同的是,Zn/MOR 上具有两种不同的[Zn-CH3]+物种,可能分别存在于其12 元环和8 元环侧口袋中,且这2 个物种具有不同的反应转化速率,此外,3 种分子筛虽然均形成了甲氧基和甲酸物种,但却表现出不同的反应活性,ZSM-5 骨架对[Zn-CH3]+的反应性最强,而MOR 骨架对甲氧基的反应性最强,说明骨架在[Zn-CH3]+物种的反应中起着关键作用。
2.2.4 Cu 改性分子筛催化剂
比较多种典型金属负载型分子筛催化剂在不同氧化剂(NOx,H2O2,O2和H2O)中,于低温下(473 K)甲烷氧化制备甲醇反应中的性能,发现Cu 基分子筛性能表现最优。迄今为止,大量研究显示了负载Cu 的分子筛具有较大的催化潜力,如中孔MFI[65]分子筛、大孔MOR[66]、MAZ[67]、FAU 和BEA[68]等分子筛,以及小孔CHA[68],AFX[69]和ERI[71]分子筛等,分子筛载体的拓扑结构不同所表现出的催化效果与活化路线也不相同。含Cu 分子筛被认为是工业上实现甲烷直接氧化制甲醇最有前途的催化材料之一。
铜改性的丝光沸石催化剂(Cu-MOR)活性位点密度较高,MOR 骨架孔道较大有利于产物的解吸和转移,因此广泛应用于选择性转化甲烷制甲醇过程。MOR 结构具有直的12 元环孔(7.0 Å×6.5 Å),通过很窄的八元环通道互连(5.7 Å×2.6 Å),更确切地说是八元环侧口袋[72]。铜优先交换到这些侧口袋中平衡骨架电荷,在氧气存在条件下被活化形成活性CuxOy物种。与Cu-ZSM-5 类似,氧气活化的Cu-MOR 在紫外可见谱22 000 cm-1处具有特征吸收峰[73]。Alayon 等[74]研究了Cu 分布与Cu-MOR的氧化还原化学和谱学特征的关系,结果表明分子筛中60%的Cu 自动还原,这与Sushkevich 等[12]在X 射线吸收谱(XAS)实验中获得的甲烷反应中Cu 结构变化量相一致。活性物种可以在反应过程中产生和消耗并通过水蒸气处理释放产物,明确证明了Cu 活性中心的作用,但高温氧化过程中Cu中心的确切性质和结构仍有争议。最初,推测bis-μ-oxo Cu-oxo 位点的形成与甲烷活化有关,此后更多的铜物种模型被提出[75],如图8 所示。值得注意的是,所有这些多聚含Cu 结构都包含至少2 个氧化态的二价Cu,它们可以还原为一价Cu,因此,总共需要提供2 个电子。对于一个甲烷分子氧化为甲醇的净化学计量,意味着碳的氧化态从4 变为2。由此可见,二聚体或更大的物种可能更有利于甲烷转化为甲醇,这是由于它们在理论上可以同时提供两个电子,这缩小了铜氧物种的范围。进一步的研究指出,当活化势垒大于300 kJ/mol 时,动力学上排除了铜单体活化甲烷的可能性[76]。由此可见,更大的活性Cu 物种具有更高的甲烷活化优势。
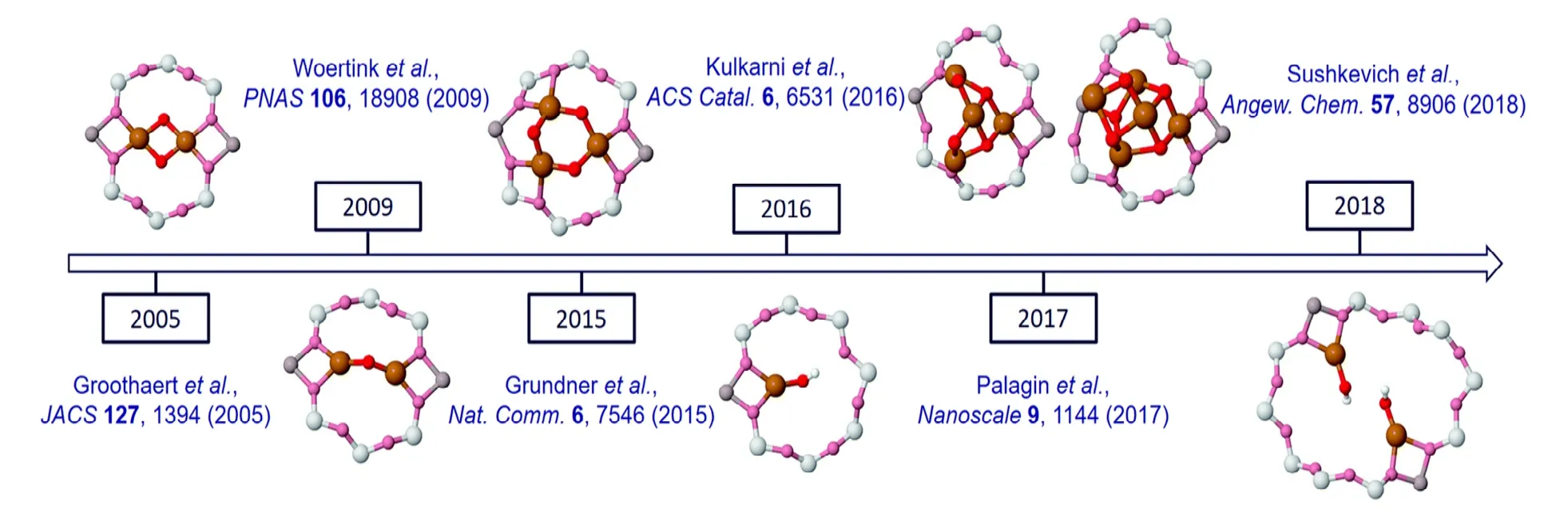
图8 Cu-MOR 中各种含铜活性物种建议构型的时间轴[75]Fig.8 Timeline of various suggested configurations of the copper oxide active species in Cu-MOR[75]
Grundner 等[77]提出Cu 交换丝光沸石的甲烷活化反应是由超骨架[Cu3O3]2+活性位点驱动的,[Cu3O3]2+团簇平衡了MOR 八元环上2 个铝位上的电荷,Cu3O3-MOR 催化剂的甲醇总收率(160 μmol/g)明显高于同类材料(13 μmol/g)。而Cu-H-MOR 反应与传统循环反应相比,甲醇产量几乎提高了一个数量级(723 K,O2),平均C1 产率可以达到0.33 mol/mol-Cu[77]。而催化剂中所有的Cu 都被认为是具有活性的,这极大地促进了Cu-H-MOR 催化剂中活性位点的表征。后续也有研究者提出在Cu-H-ZSM-5 中发现了三铜活性位点,尽管浓度低于Cu-H-MOR[73,78]。近期,Zheng 等[79]利用丝光沸石交换的铜氧团簇实现了甲烷到甲醇的低温化学计量转化过程,在含[Cu3(μ-O)3]2+活性位点的MOR上,甲醇产率可以达到0.6 mol/mol-Cu。综合反应活性评价、谱学研究、动力学分析和DFT 计算表明,通过增加甲烷的化学势,使包含三氧原子活性中心上的2 个甲烷分子活化,可以使Cu-MOR 中的甲醇产量达到最大值。
对活性中心的全面研究为Cu 离子在MOR 骨架中的复杂性质和动力学提供了新的视角,并可以通过改进反应和合成条件对活性中心进行优化,从而提高甲烷氧化制甲醇的催化效率。已知通过常规的离子交换法,可以制备不同的Cu 物种,且高Si/Al 比(物质的量之比)材料中形成Cu 单体的概率明显高于低Si/Al 比材料。因此,通过调节Si/Al 比可以调节活性铜团簇在分子筛中的尺寸和性能。Sushkevich 等[80]通过改变Si/Al 比来调整Cu 分子筛中活性中心的构型,高Si/Al 比样品优先形成孤立的Cu 离子,每个Cu 离子上产生更高的甲醇产量及选择性,但当将CuI氧化为CuII时,这些位点无法稳定并释放氢。另一方面,Si/Al 比较低的样品既能提供足够的甲醇产量,又能以较低的能量成本释放氢,从而为无氧条件下高效且高选择性地将甲烷直接转化提供了最佳条件。由此可见低聚铜物种在有氧和厌氧活化条件下都表现出较高的活性,而单铜中心仅在有氧过程中产生甲醇。此外,Sushkevich等[81]以Cu 交换丝光沸石为催化剂,在甲烷直接转化为甲醇的反应过程中发现甲醇的产率和选择性与分子筛中Brønsted 酸的含量有关。原位红外光谱显示,Brønsted 酸位的存在提高了生成甲醇的稳定性,从而避免了其过度氧化成碳氧化物。Cu 交换丝光沸石的甲醇产率最高,为118 μmol/g(0.18 mol/mol-Cu),甲醇的选择性为95%。Sushkevich 等[80]通过优化Cu 负载量和Si/Al 比,将Cu 分子筛上的甲醇产率提高到0.47 mol/mol-Cu。通过X 射线吸收光谱分析,将CuII物种的丰度与每个Cu 的甲烷氧化产物的产量直接关联起来,为Cu-MOR 中活性位点的解析提供了定量证据。除此之外,在连续甲烷氧化操作反应中,可以通过提高甲烷压力来提高甲醇的产量和选择性。Tomkins 等[82]研究表明,通过增加甲烷压力,用Cu-MOR 可以获得更高的甲醇产量。Brezicki 等[83]也观察到,在分步活化过程中,升高甲烷压力促进了甲烷在Cu-MOR 上的转化,使甲醇和Cu 的化学计量比从0.3 提高到0.42。Jeong 等[84]对甲醇产率的影响因素进行综合评价,发现Si/Al 比、Cu/Al 比(物质的量之比)、Brønsted 酸位点的存在和反应投料中的氧气浓度均会对反应产生一定的影响。在一定Si/Al 比下,甲烷转化率随Cu/Al 比呈火山图变化,甲醇选择性随Cu/Al 比的增加而降低,且相对于Si/Al 比,Cu/Al 比对Cu-H-MOR 上甲烷选择氧化反应的影响更大。实验数据和DFT 计算表明,双核铜氧团簇比单核铜氧团簇具有更强的活性。除此之外,Cu-H-MOR 对甲醇的选择性远远高于Cu-Na-MOR 的,这意味着Brønsted 酸位更有利于Cu-MOR 上的甲烷选择性氧化制甲醇反应。
近年来,Cu2+交换Omega 分子筛(MAZ 型材料,与丝光沸石结构相似的大孔分子筛)受到关注,Park 等[85]比较了12 种结构(MOR,EON,MAZ,MEI,BPH,FAU,LTL,MFI,HEU,FER,SZR和CHA)铜分子筛在甲烷选择氧化制甲醇过程中的表征结果和反应性能。对比发现,经高温活化和液体甲醇萃取后,MAZ 型分子筛可以产生相当高的甲醇量,为86 mmol/g。其高产的原因是在其八元环通道中形成了密度较高的铜氧杂化活性物种。经过条件优化,Tao 等[67]利用高结晶和金属分布均匀的Cu 离子交换MAZ 分子筛,在101 kPa 甲烷条件下得到的甲醇产率为150 μmol/g;3 030 kPa 甲烷下产生了高达200 μmol/g 的甲醇量。此外,Cu 浓度对分子筛的催化活性极其重要:在较低的Cu 负载量下,Cu-MAZ 活性很低;当超过特定Cu 负载量,Cu-MAZ 对甲烷的催化转化比Cu-MOR 的更具优势。进一步研究表明,分子筛的合成和形貌对甲醇的收率起着巨大的作用[86],只有当分子筛具有较长的棍状束状形态(24 μm×100 nm)时,才能获得较高的收率(197 μmol/g);当分子筛形成小球状聚集体时,甲醇产率严重降低(60~97 μmol/g)。这种差异源于合成过程中的微小变化,强调了合成条件对分子筛性能的重要性。
铜基MFI 分子筛选择性转化甲烷制甲醇的能力首次被Groothaert 等证实[87],铜交换的ZSM-5 分子筛(Si/Al 比为12,Cu/Al 比为0.58)在常压和相对较低的温度下成功地将甲烷转化成甲醇,产率为8.2 μmol/g。反应依赖于一个三步循环:高温O2活化(723 K),低温甲烷-甲醇反应(448 K),以及水或乙腈混合物对生成甲醇的萃取。甲烷碳氢键裂解发生在MFI 骨架中的双铜中心上,通过表征发现Cu-ZSM-5 的氧活化位点与22 700 cm-1处的吸收特征峰相关,这是该反应特有的光谱特征[87]。然而,在这种能量下的吸收特性还不足以准确地定义活性位点的性质,因此近几年不同研究团队进行了深入研究以明确反应发生的主要原因。
Cu 交换ZSM-5 分子筛上甲烷高选择性氧化制甲醇反应得到广泛研究[88]。Narsimhan 等[89]研究了在483 K 下,利用Cu-ZSM-5 在CH4-H2O-O2系统中、气相条件下连续催化生产甲醇,甲醇的选择性达到70%,甲醇的生成速率为0.88 mmol/(g·h),甲烷转化率为0.0014%。研究还发现,氧气活化的Cu-ZSM-5 在较低温度(373 K)下甲烷转化为甲醇的选择性可达98%[87]。但是反应仅发生在分子筛中总Cu 位点的一小部分上。随着研究的深入,发现多种因素可以影响催化剂的催化活性。Beznis 等[90]研究了铜负载对ZSM-5 催化甲烷选择性氧化的影响,发现当铜的质量分数为1.4%~2.6%时,甲醇产率为0~6.4 μmol/g。Markovits 等[91]发现MFI 分子筛中铝的浓度是决定Cu-H-ZSM-5 上多核铜氧物种形成最大浓度的关键参数。通过离子交换来增加金属Cu 负载量与高浓度的配对铝位点,可以用来调节活性铜Cu 物种的性质。低Cu 负载量时,Cu 单体与[Cu2(μ-O)]2+二聚体的混合物优先形成,这是由于在离子交换过程中,当Cu2+浓度较低时,裸露的Cu2+平衡两骨架铝时,Cu 离子会优先交换;中等Cu 负载量时,H-ZSM-5 中的Cu 主要以三核铜配合物[Cu3(μ-O)3]2+的形式存在,与铜氧二聚体相比,铜氧三聚体具有更高的热力学稳定性。此外,甲烷活化不仅与铜氧团簇的结构有关,而且与团簇所处的环境也有关。Cu-ZSM-5 和Cu-MOR 体系中含有相同类型的活性[Cu3(μ-O)3]2+团簇,但这些团簇在ZSM-5 上约有50%不具活性,主要由于MOR 拓扑结构稳定了高度受限的八元环侧口袋中的三核团簇,但ZSM-5 中铜氧三核物种的局域环境限制较小,导致甲烷氧化的自由能垒较高,约束了反应的催化活性。Sheppard 等[92]发现Cu-ZSM-5 孔道中的单氧双铜中心对甲烷部分氧化成甲醇具有活性,然而外表面的Cu 降低了活性、选择性位点与非选择性位点的比例。采用双(三甲基硅基)三氟乙酰胺(BSTFA)对ZSM-5 分子筛特定离子交换位点进行钝化及煅烧处理,可以选择性控制合成过程中Cu 的沉积以获得更高的催化活性。在硅烷化SiO2浓度为1%~2%(质量分数)时,外部非活性Cu 物种减少了64%,同时伴随甲醇产率的明显增加。Brezicki 等[93]发现Cu-ZSM-5 催化剂中H 和Na 的共阳离子特性显著影响了Cu 的形态和催化剂的甲烷-甲醇循环反应活性,并可以用此性质来控制过渡金属离子交换分子筛催化剂的活性位点结构。谱学表征及DFT 计算表明,H 型催化剂中含有高浓度的单氧双铜物种,该物种对甲醇的生成具有选择性,而Na 的存在会促进生成含氧更高的双氧双铜物种,导致甲烷过氧化反应的发生。
通过不断优化,研究人员逐渐提出了完整的铜改性ZSM-5 分子筛上的甲烷活化机理。Wu 等[94]报道了Cu-Na-ZSM-5 分子筛在423 K 温度下甲烷高选择性转化为甲醇的完整反应路线(图9),电子顺磁共振(EPR)和固体核磁共振(NMR)的表征结果表明,甲烷在铜基ZSM-5 分子筛的活化主要基于以下几个步骤:(1)甲烷在Cu-Na-ZSM-5 分子筛的[Cu2O]2+核上活化生成甲醇,Cu2+还原为Cu+;(2)吸附的甲醇在Cu+上活化,形成铜甲氧基(—Cu-O-CH3)和—Al-OH 基;(3)游离甲醇由甲氧基铜的水合作用和吸附甲醇的置换作用形成。Kolganov 等[95]结合固体核磁共振和DFT 计算对甲烷与Cu 改性ZSM-5 分子筛相互作用形成的中间体进行了捕获分析,进一步证明了甲烷在分子筛中不同金属位点上的活化机理。核磁结果显示,Cu-H-ZSM-5 分子筛的甲烷活化产生3 种不同的表面甲氧基类物质(O-CH3),如图10 所示,分别归属于:(1)甲醇吸附在两个相邻铜位点Cu-(HOCH3)-Cu(62.6 ppm);(2)甲醇吸附在分子筛的Brønsted 位点(52.9 ppm);(3)甲基自由基吸附在桥接Si-O-Al 位点上(Si-O(CH3)-Al,58.6 ppm)。其中,金属负载量的差异可以导致形成不同的甲氧基中间产物。Cu 负载较低(Cu 质量分数小于0.2%)时分子筛样品含有孤立的单核Cu 物种,有利于中间体ii和iii形成;Cu 负载量提高(质量分数大于1.3%),多核Cu-O-Cu 位点的存在促进中间体i的形成。由此可见,限域在分子筛中的单核和多核Cu 物种均能促进Cu 基MFI 分子筛上的甲烷活化。
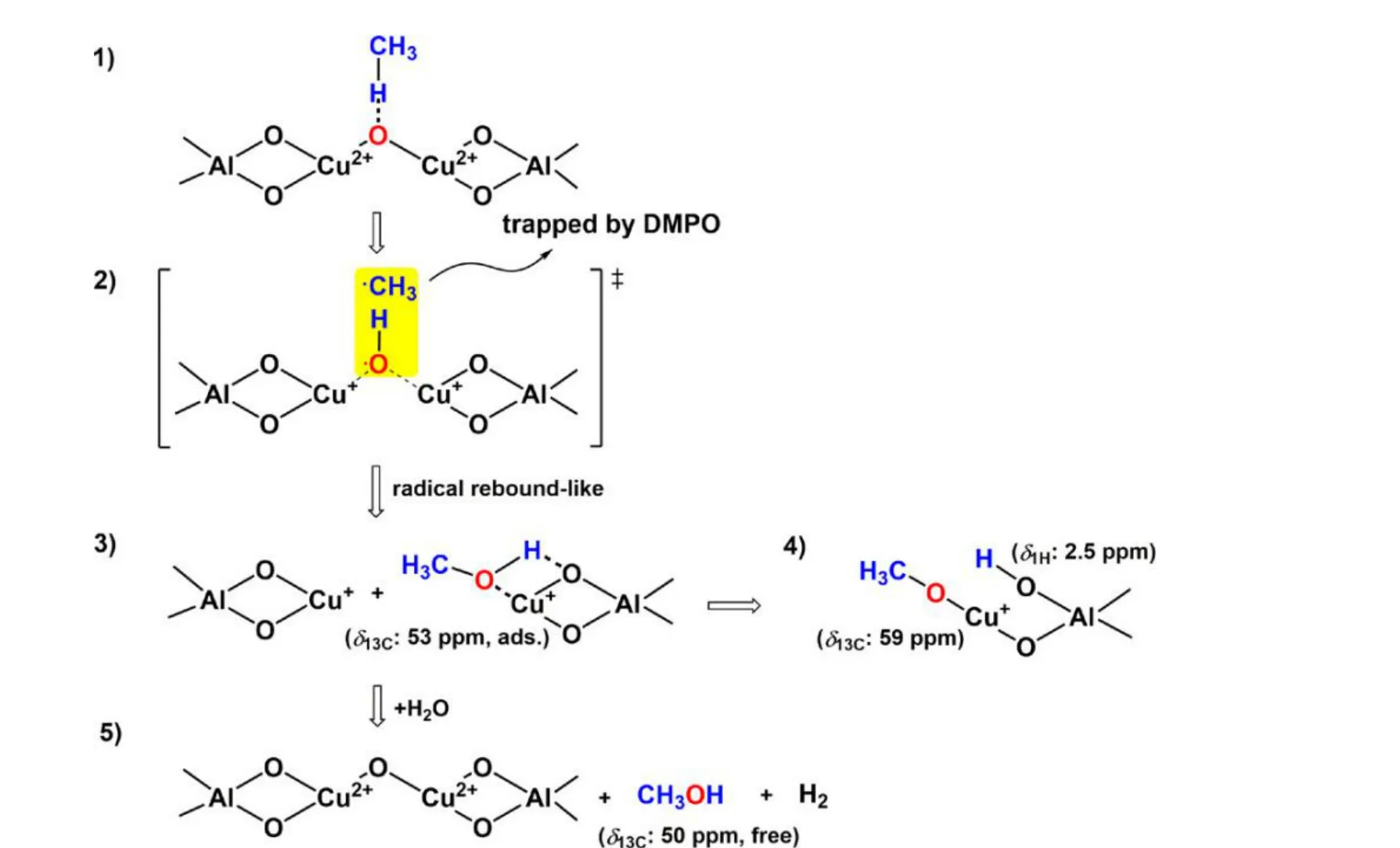
图9 Cu-ZSM-5 分子筛上甲烷转化为甲醇的机理[94]Fig.9 Proposed mechanism for the transformation of methane into methanol on the Cu-Na-ZSM-5 zeolite[94]

图10 13CH4 吸附在Cu-ZSM-5 分子筛上形成的表面中间体的CP/MAS NMR 谱[95]Fig.10 13C CP/MAS NMR spectrum of surface intermediates from 13CH4 adsorption on Cu-ZSM-5 zeolite[95]
近年来,研究人员对用于甲烷选择性氧化的Cu 交换分子筛催化剂的兴趣已经从中大孔分子筛拓展到小孔分子筛,如Cu-SSZ-13(Cu-CHA),Cu-SSZ-16(Cu-AFX)和Cu-SSZ-39(Cu-AEI)等,这些小孔分子筛催化材料比中孔的Cu-ZSM-5 和大孔的Cu-MOR 产生更多的甲醇[72]。其中Cu-CHA分子筛具有独特的T 位点,结构简单,是分子筛催化反应结构-活性关系研究的理想模型体系[96]。
CHA 分子筛的基本结构单元为四元环(4r)连接而形成的双六元环(d6r),这些双六元环以ABC顺序堆叠,形成CHA 分子筛独特的骨架结构以及规则排列的通过八元环窗口(8r)相互连接的CHA笼。CHA 骨架的特征是高度对称,其不对称单元仅包含一个T 位和4 个非等价氧,从而产生了两类Brønsted 位点:第一类包括与O1,O2和O4相连的Brønsted 位点,这些位点指向大笼内部,很容易接触反应物;相反,与O3相联的第二类Brønsted 位点却难以接近,一般指向六元环(6r)内部,如图11 所示。研究表明,这些位点十分有利于某些重要工业反应活性位点的落位控制,如氮氧化物的选择性催化还原(SCR)与甲烷转化制甲醇(MTM)[96]。因此,近年来,越来越多的科研人员将研究精力转移到对金属负载的CHA 分子筛的研究上,但研究主要集中在Cu-SSZ-13 上,尤其是甲烷选择性氧化反应,而Cu-SAPO-34 催化剂在这方面的研究较少。
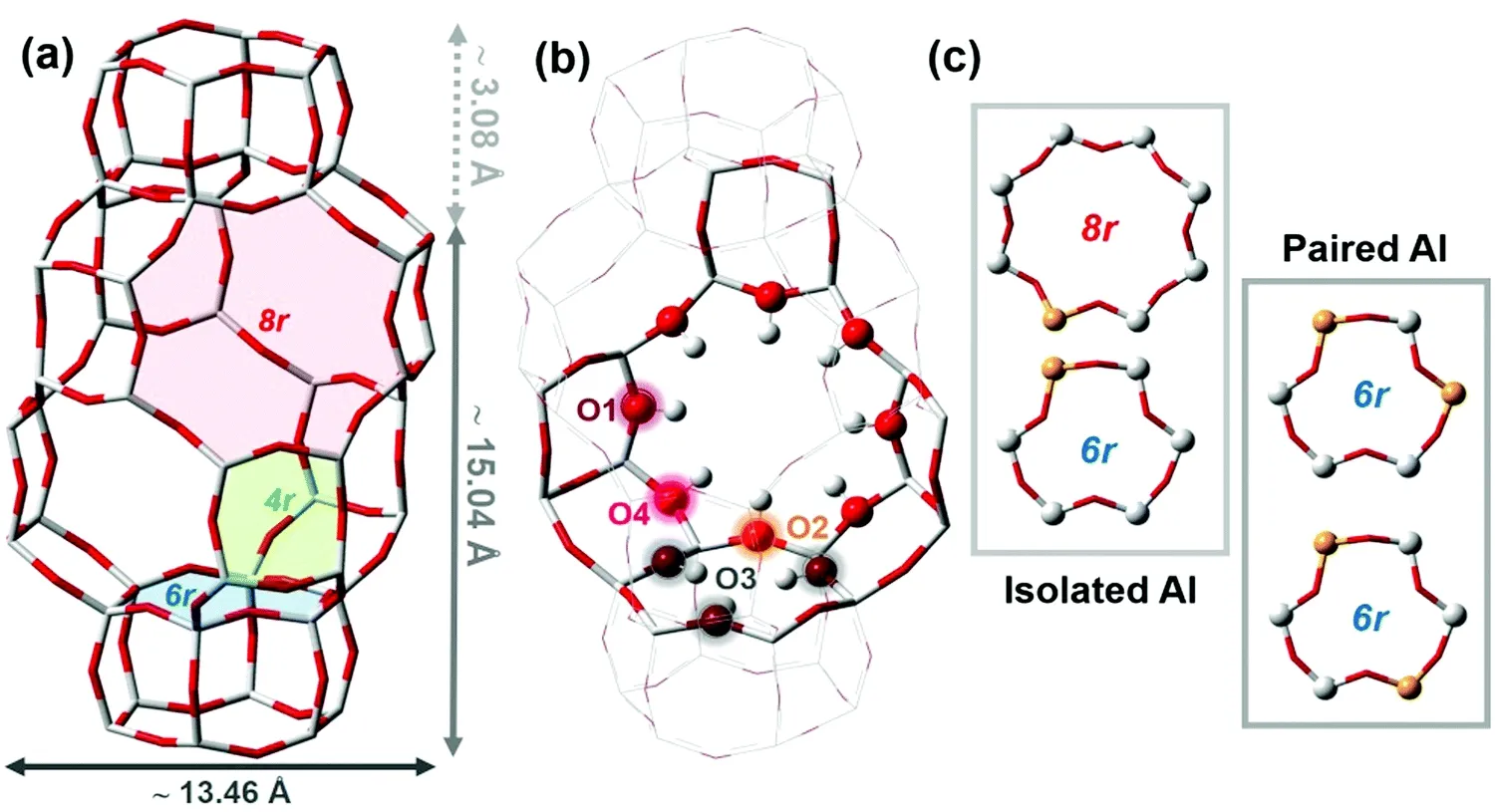
图11 CHA 拓扑结构[96]Fig.11 Structure of CHA zeolite[96]
Ipek 等[97]以N2O 为氧化剂,在Cu-SSZ-13 分子筛催化剂上将甲烷转化为甲醇。Cu-SSZ-13 上甲醇生产速率(以每克为基础)是Cu-MOR 的2 倍以上,是Cu-ZSM-5 的4 倍以上。Jeong 等[84]总结了一系列不同Cu 基分子筛体系对甲烷的选择性转化情况,在一个反应循环里,CHA 体系的甲醇产量可以高达200 μmol/g,比最初报道的甲醇收率高一个数量级以上(6~10 μmol/g)。Rhoda 等[98]利用紫外可见光谱和共振拉曼光谱表征,证明O2和N2O 活化的Cu-CHA 中存在[Cu2O]2+活性中心,并且该活性中心的Cu-O-Cu 角大于Cu-MFI 上的Cu-O-Cu 角,Cu-CHA 中的[Cu2O]2+中心比Cu-MFI 中的具有更高反应活性。DFT 与动力学实验结果表明,这种差异是由于反应中[Cu2OH]2+中间产物的产生,O—H 键的形成增加了热力学驱动力。虽然两种晶格中的[Cu2OH]2+中间产物能量相似,但与Cu-MFI 相比,Cu-CHA 中的反应物[Cu2O]2+位不稳定,从而降低了Cu-CHA 中的活化能垒,提升了对甲烷的催化活性。
在甲烷连续催化氧化体系中,通常认为分子氧(O2)为甲烷活化的唯一氧化剂,然而有研究报道水可以作为一种“软”氧化剂用于甲烷厌氧条件下对甲烷的催化。Narsimhan 等[89,99]证明了使用O2将甲烷连续气相催化氧化为甲醇的可能性。结果表明,C—H 活化速率对O2的分压几乎为零级依赖性,而对水的分压则为半数级依赖性[99]。Koishybay 等[100]在没有分子氧和使用18O 标记水进行的Cu-CHA体系实验中也证实了这一点,甲醇中氧的主要来源是水,而不是氧气,这为提高铜分子筛的部分氧化性能提供了新的途径。在523 K、低空速、有氧条件下的甲烷连续氧化反应可获得较高的甲醇收率,同时伴随着一定量二氧化碳生成,16O2和H218O 的原位红外光谱表明,有氧反应中生成甲醇中的氧原子主要来自于18O 标记水。甲烷与水蒸气在无氧条件下连续氧化,在催化区域没有生成二氧化碳,说明至少有2 个不同的Cu 活性位点分别可以被O2和水活化。没有O2的情况下,水可以再生的Cu 活性位点上可能形成甲醇。除此之外,反应过程中可能参与的金属活性位点主要有[Cu2O]2+和[CuOH]+物种。[Cu2O]2+活性位点已知能够在低温(室温)、N2O 的存在下形成[101]。这些Cu 活性位点需要1个氧原子和2 个电子从水中转移来完成氧化还原循环[102]。在523 K 的反应体系中加入O2,可能活化较高温度下形成的单氧双铜位点以及三聚铜位点[73,77],这些Cu 活性中心的存在可能是甲烷过度氧化为二氧化碳的主要原因,因为它们可以提供氧化还原循环所需的2 个氧原子和8 个电子[75]。长期以来,研究人员一直认为水只用来萃取甲醇而与动力学反应无关。而事实上,水可以作为氧化剂参与甲烷的选择性氧化反应,与氧气相比,水作为氧化剂的另一个优点是它对甲醇的高选择性。
明确CHA 结构中甲烷氧化反应活性中心的形成与甲烷活化机理是催化领域的巨大挑战,多年来相关研究不断更新,但目前仍未形成统一的认识。理论上,研究人员设想了以[CuIIOH]+配合物形式存在的单核活性物种[103]和多核活性物种[72]。Ipek 等[104]基于谱学分析结果提出Cu-SSZ-13 分子筛中存在[Cu2O2]2+和[Cu2O]2+物种,并且它们参与了甲烷的活化。Kulkarni 等[103]通过DFT 计算结合动力学分析提出单铜物种可以作为甲烷氧化的潜在活性位点。Cu-CHA 催化剂铝含量和分布具有规律性,通用的设计原则如下:六元环不利于反应,八元环有利于活性[Cu-OH]+的形成。当前研究普遍认为[Cu-OH]+活性位点是在已知[Cu-O-Cu]2+和Cu3O3物种基础上,为甲烷活化提供补充途径。对于[Cu-OH]+作为活性位点参与的完整甲烷活化反应的机理,Kulkarni 等[103]进行了具体的阐述。反应克服110 kJ/mol 的自由能垒对甲烷进行活化,生成Cu-H2O 和CH3自由基,后者更适合与Cu 原子而不是分子筛骨架进行结合;尽管可以将CH3自由基直接插入到H2O 分子中,但是其高活化能(175 kJ/mol)表明这条路径较难发生;相反,向铜原子上直接插入CH3自由基的势垒可以忽略不计,[Cu-H2O-CH3]+更易于形成;一旦CH3自由基与Cu 结合,进一步转移甲基形成甲醇具有很高的势垒,是不可行的。因此,甲烷活化后,在八元环中Cu 可能以[Cu-H2O-CH3]+的形式存在,由于实验中需要添加水或蒸汽来提取甲醇,Kulkarni 等[103]进一步探索了额外水分子对甲醇形成的影响。结果表明,当Cu 原子被额外的一个水分子水化时,[Cu-2(H2O)-CH3]+脱离骨架,在分子筛骨架中自由扩散,更有利于甲醇的释放。Sun 等[105]对Cu-SSZ-13 上甲烷选择氧化反应路线进行了明确地阐述,具体机理如图12 所示。结合谱学、动力学与DFT 计算结果,Cu-SSZ-13 中CuOH 单体和二聚体均能有效催化甲烷选择性氧化成甲醇,CuOOH是关键反应中间体,Cu2+-Cu+-Cu2+的快速氧化还原循环是Cu-SSZ-13 高催化活性的关键,而反应条件下单核Cu 物种与双核Cu 物种可相互转化。上述结果成功地解决了关于Cu-分子筛催化甲烷选择氧化制甲醇反应相关问题的争议。
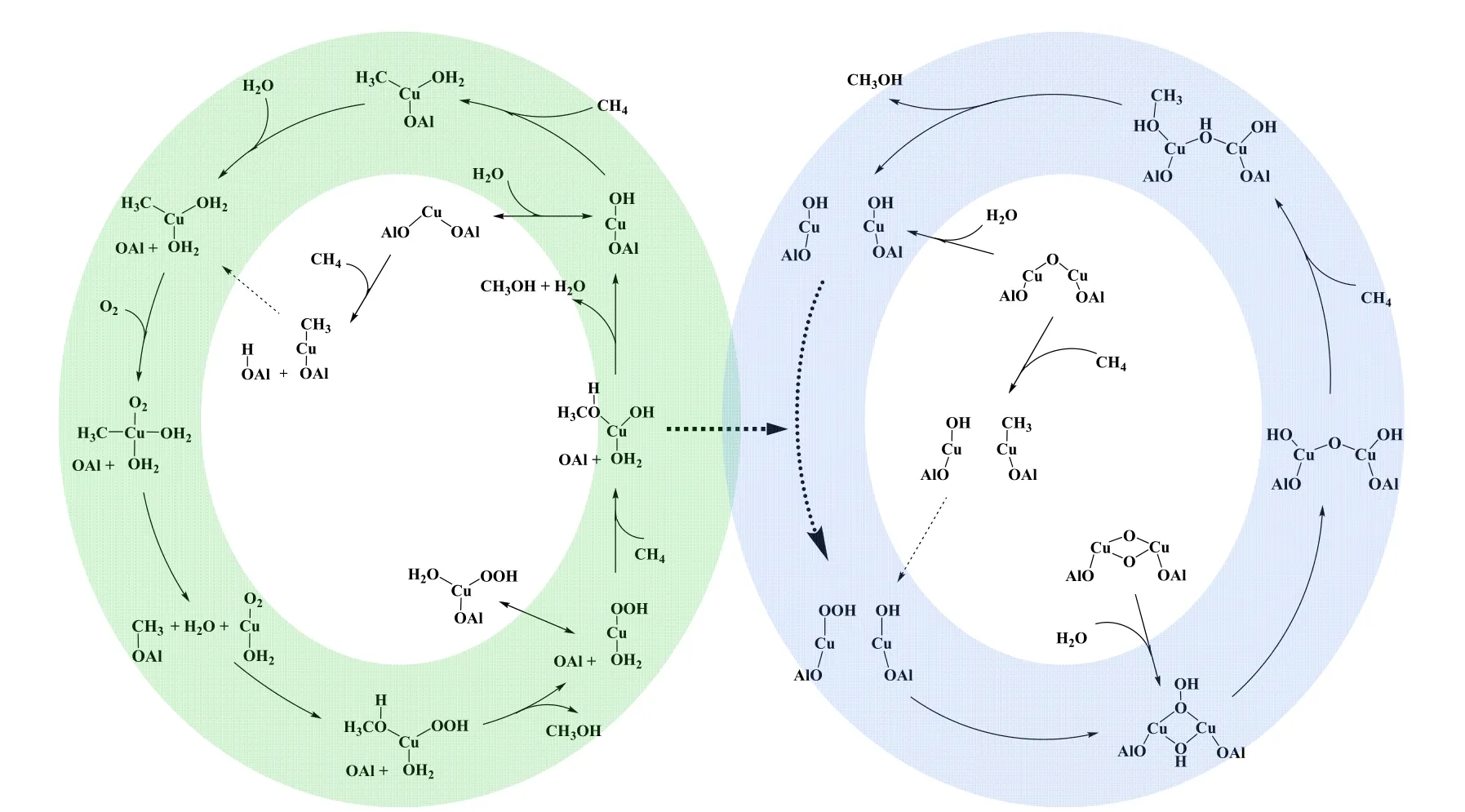
图12 Cu-SSZ-13 分子筛催化剂上甲烷选择性氧化制甲醇机理[105]Fig.12 Reaction mechanism of methane selective oxidation to methanol over Cu/SSZ-13catalysts[105]
2.3 金属有机框架(MOF)材料选择性氧化甲烷制甲醇
与分子筛类似,MOF 具有高孔隙率,可以通过对连接剂和节点的后合成修饰使它们具有可调节的孔隙环境。MOF 催化材料是典型的具有明确金属中心的高结晶材料,可以通过单晶或粉末衍射技术进行表征,这有助于设计结构明确的多相催化材料[106]。受pMMO 启发,研究人员设计和合成了多种MOF 催化剂用于选择性氧化甲烷制甲醇。金属酶的活性位点通常被认为是封闭在一个结构单元内来控制催化剂的反应环境、氢键和离子传递以防止自我破坏[106-108]。MOF 可以作为类似于酶中多肽链的支架,其二级和三级结构的排列可以通过合理选择MOF 的结构和拓扑来实现。在MOFs 材料中,有2 种活性物种已被提出可以活化烷烃的碳氢键,即MOF 构筑单元的金属物种和通过MOF 的后合成修饰形成的框架外金属位点[109-110]。通过对MOF 材料催化机制的合理研究,有望提高其在甲烷转化过程中的催化效率。
MOF 催化剂可以实现温和反应条件下甲烷的活化与转化,Ikuno 等[111]通过在NU-1000 的ZrO2节点上原子层沉积铜氧化物团簇实现甲烷部分氧化制甲醇过程。Cu 物种在室温条件下以15%Cu+和85%Cu2+的混合形式存在。423 K 条件下,Cu-NU-1000 上甲醇选择性为45%~60%。除此之外,含有有机和无机元素的杂化材料已被广泛讨论。Osadchii 等[112]成功地设计了一种位点分离的混合金属MOF,其包括所需要的反铁磁耦合高自旋物种,其配位环境与酶的非常相似。采用电化学合成方法构建微孔MOF 基体,同时将原子分散的Fe 活性位点整合到晶体支架中,该模型模拟了酶催化碳氢活化生成甲醇的行为,并表明这种反应的关键是形成孤立的氧桥铁单元。MOF 催化剂的拓展是开发模拟酶循环催化剂的良好平台,并为甲烷直接氧化活化的基础研究开辟了新的可能性。最近,Yang 等[113]制备了一种含Cu 金属有机骨架包埋的高度混合的杂化氧化物IrO2/CuO 催化剂。在423 K 下,该催化剂可以在303 kPa 甲烷和101 kPa 空气条件下选择氧化甲烷制甲醇,其中,甲醇收率为872 μmol/g。IrO2与CuO 的协同作用有助于甲醇产率的提高。而当甲烷进料压力提高到2 020 kPa 时,甲醇产率高达1 937 μmol/g,为目前报道本催化体系下的最高数值,这为杂化氧化物催化材料的设计和合成提供了另一种途径。
3 总结与展望
甲烷作为低碳烷烃中储量与热值均极具优势的能源与资源载体,对保障现代社会未来能源、燃料和化学品的供应具有重要意义。由于甲烷分子相对于目标产物的化学惰性问题,迄今为止很难通过一步直接转化过程实现甲烷连续氧化生成甲醇,大规模的甲烷工业利用仍依赖于以合成气为媒介的间接转化路线。产物甲醇较反应物甲烷具有更高的反应活性与其深度氧化产物二氧化碳的生成是甲烷直接转化体系失败的主要原因。
贵金属均相催化剂的应用开创了低温甲烷制甲醇工艺的先例,该工艺可以实现相对较高的甲醇选择性,从而使甲烷的高效催化转化成为可能。然而,这些体系大多数需要加入高腐蚀性物质如硫酸和三氟乙酸以稳定反应产物。除此之外,以生产甲酯作为中间体制备甲醇的附加反应及后续的分离步骤限制更高。理想的工业工艺需要在环境友好的介质中合成高浓度且稳定的甲醇或其衍生物,而该过程需要高活性及高稳定性的催化剂。近几年,受甲烷单加氧酶启发的仿生催化体系的开发与利用实现了温和条件下甲烷的转化。综合环境和经济因素,分子氧应作为理想的氧化剂。设计分子氧选择氧化甲烷制备甲醇的工艺是一个挑战,目前尚没有明确的解决方案。甲醇的低产率是这一工艺过程的热力学特征。为解决这些问题,研究人员做出了许多努力,取得了一些可喜的成果和进展。通过对当前甲烷直接转化的进展进行总结,未来建议从开发多相催化剂体系入手,将活性中心引入特定限域空间内(如分子筛),将甲烷的活化与产物萃取过程分离,有望避免产物甲醇的过度氧化。
