不同性别和交配状态的马铃薯块茎蛾对马铃薯挥发物的触角电位反应
2021-03-09李祥张小娇肖春董文霞
李祥,张小娇,肖春,董文霞
不同性别和交配状态的马铃薯块茎蛾对马铃薯挥发物的触角电位反应
李祥,张小娇,肖春,董文霞
云南农业大学植物保护学院/云南生物资源保护与利用国家重点实验室,昆明 650201
【】探明不同性别和交配状态的马铃薯块茎蛾()对寄主植物(马铃薯)挥发物的电生理反应的差异,为利用化学生态手段防治马铃薯块茎蛾提供参考。利用触角电位技术(electroantennogram,EAG),测定未交配雌蛾、交配雌蛾、未交配雄蛾3种不同生理状态的马铃薯块茎蛾对马铃薯块茎和植株释放的16种挥发性化合物(包括6种脂肪族化合物:1-辛烯-3-醇、丁醇、庚醛、辛醛、壬醛、癸醛;4种芳香族化合物:苯乙醇、苯乙醛、苯乙酮、水杨酸甲酯;6种萜类化合物:-蒎烯、对-聚伞花素、反--罗勒烯、桉叶油醇、反--法尼烯、茉莉酸甲酯)的电生理反应及对其中6种化合物(1-辛烯-3-醇、庚醛、壬醛、苯乙酮、水杨酸甲酯、反--罗勒烯)的剂量反应。马铃薯块茎蛾对这16种化合物均能产生触角电位反应,其中未交配雌蛾和雄蛾对脂肪族醇类化合物的EAG反应值较高,交配雌蛾对脂肪族醛类化合物的EAG反应值较高,3种不同生理状态的马铃薯块茎蛾对萜类化合物的EAG反应值均较低。当刺激剂量为1 000 µg时,不同性别和交配状态的马铃薯块茎蛾对同种化合物的反应差异较大,未交配雌蛾对辛醛、水杨酸甲酯、反--罗勒烯的反应强于交配雌蛾和未交配雄蛾,交配雌蛾对庚醛、壬醛、-蒎烯的反应强于未交配雌蛾和雄蛾,未交配雄蛾对1-辛烯-3醇、苯乙醇、苯乙醛的反应强于雌蛾。在测试剂量范围内(1、10、100、1 000 µg),3种生理状态的马铃薯块茎蛾对6种化合物的EAG反应值随刺激剂量的增加呈现增大的趋势,均未达到饱和阈值,交配雌蛾对同一化合物不同剂量的反应差异更为明显。马铃薯块茎蛾未交配雌蛾和雄蛾对脂肪族醇类化合物较敏感,交配雌蛾对脂肪族醛类化合物较敏感,雌、雄蛾对萜类化合物均不敏感;对于单个化合物的电生理反应,交配雌蛾对庚醛、壬醛、-蒎烯更为敏感;对同一化合物不同剂量的电生理反应,交配雌蛾同样更为敏感。
马铃薯块茎蛾;马铃薯挥发物;触角电位反应
0 引言
【研究意义】马铃薯块茎蛾()是危害马铃薯和烟草等茄科植物最严重的害虫之一,目前在亚洲、欧洲、美洲、非洲、大洋洲的100多个国家均有分布[1-2]。在中国,随着马铃薯种植面积的逐步扩大,马铃薯块茎蛾现已广泛分布于云南、贵州、四川、广西、湖南等多个省区,且危害日益加重,其中以云南、贵州、四川三省受害最为严重,马铃薯块茎蛾在大田时期造成的危害可使马铃薯减产30%,对仓储期马铃薯块茎的危害高达100%[3-4]。由于马铃薯块茎蛾幼虫具有钻蛀危害的习性,因此防治困难[1]。近几年,一些研究者试图通过利用植物挥发物组分调控其行为,寻找防治马铃薯块茎蛾的新途径[5-11]。因此,研究不同性别和交配状态的马铃薯块茎蛾对植物挥发物敏感性的差异,对于马铃薯块茎蛾行为调节剂(包括引诱剂和驱避剂)的精准开发和应用具有重要意义。【前人研究进展】同种昆虫由于性别和生理状态的差异,植物挥发物组分在其行为反应中所起的作用不同,因而对植物挥发物各组分的敏感性也不同。不同生理状态的番石榴实蝇()雌、雄虫对寄主番石榴气味具有不同的敏感性和选择性,已交配雌虫反应最强,其次是性成熟未交配的雄虫,性未成熟的雄虫反应最弱[12]。交配状态直接影响蛾类昆虫对植物挥发物的行为反应,例如烟草天蛾()雌虫交配后对寄主植物的反应增强[13],苹果蠹蛾()交配雌虫对苹果挥发物的反应强于未交配雌蛾[14],只有交配后的白蜡丽细蛾()才对寄主植物(白蜡树)叶片挥发物发生定向反应[15]。蛾类昆虫的触角电生理反应也因其性别和交配状态而异。羽化后1—3 d未交配的美国白蛾()雌、雄蛾对寄主植物挥发物的触角电位(electroantennogram,EAG)反应不同[16],羽化后2—4 d的未交配茶尺蠖()雌、雄蛾对非寄主迷迭香()挥发物组分的EAG反应也存在差异[17]。冷杉梢斑螟()和海灰翅夜蛾()雌虫交配后对寄主植物挥发物的EAG反应增强[18-20]。Das等测定了印度马铃薯块茎蛾羽化后2—3 d的雌、雄成虫对27种植物挥发物组分的EAG反应,发现其对大部分供试化合物的电生理反应因性别而异[21],但有关雌蛾在交配前后对寄主挥发物的敏感性差异未见报道。另外,昆虫对植物挥发物的敏感性也因地域不同而存在差异,例如粉蝶盘绒茧蜂()荷兰种群和中国种群对寄主挥发物的EAG反应存在差异[22]。【本研究切入点】马铃薯块茎蛾的交配状态是否影响其对寄主植物挥发物的敏感性,中国的马铃薯块茎蛾种群对寄主植物挥发物的电生理反应是否与印度种群存在差异?为了回答这些问题,本文选取马铃薯释放的16种挥发性化合物,测定马铃薯块茎蛾未交配雌蛾、交配雌蛾、未交配雄蛾对这些化合物的EAG反应。【拟解决的关键问题】通过分析不同生理状态的马铃薯块茎蛾对不同化合物及同种化合物不同剂量电生理反应的差异,探明影响马铃薯块茎蛾对植物挥发物反应的因素,为利用化学生态手段防治马铃薯块茎蛾提供参考。
1 材料与方法
试验于2014—2017年在云南生物资源保护与利用国家重点实验室昆虫电生理室完成。
1.1 材料
1.1.1 供试昆虫 马铃薯块茎蛾采自云南农业大学植物病理实验大棚,室内连续饲养10代以上,幼虫以马铃薯块茎(合作88)饲养,成虫饲以10.0%的蜂蜜水。室内饲养条件:温度为(27.0±2.0)℃,相对湿度为(70.0±5.0)%,光周期为L﹕D=14﹕10。试验时选取羽化后3 d的健康已交配雌蛾、未交配雌蛾、未交配雄蛾。其中,已交配雌蛾通过将刚羽化的雌、雄蛾以2﹕3的比例混合饲养获得,试验后解剖雌蛾进一步确认其交配状态,如果交配囊内有精苞,则确定是已交配雌蛾;如果无精苞,则剔除相关数据。
1.1.2 气味化合物 测定化合物包括6种脂肪族化合物:1-辛烯-3-醇(98.0%,J&K)、丁醇(99.5%,J&K)、庚醛(95.0%,TCI)、辛醛(98.0%,TCI)、壬醛(95.0%,TCI)、癸醛(95.0%,TCI);4种芳香族化合物:苯乙醇(99.0%,Acrös)、苯乙醛(98.0%,Acrös)、苯乙酮(98.0%,J&K)、水杨酸甲酯(99.0%,J&K);6种萜类化合物:-蒎烯(98.0%,Sigma- Aldrich)、对-聚伞花素(96.0%,TCI)、反--罗勒烯(90.0%,Sigma-Aldrich)、桉叶油醇(99.0%,Acrös)、反--法尼烯(98.0%,Sigma-Aldrich)、茉莉酸甲酯(95.0%,Sigma-Aldrich)。其中,马铃薯植株挥发物组分有庚醛、辛醛、水杨酸甲酯、桉叶油醇,马铃薯块茎挥发物组分有茉莉酸甲酯、1-辛烯-3-醇、对-聚伞花素、丁醇、苯乙酮,植株和块茎中均存在的挥发物组分有壬醛、癸醛、苯乙醛、苯乙醇、-蒎烯、反--罗勒烯、反--法尼烯[5,23-25]。以正己烷(色谱纯,Merck)作为溶剂,将上述样品配成5×10-2g·ml-1的溶液,并将1-辛烯-3-醇、庚醛、壬醛、苯乙酮、水杨酸甲酯、反--罗勒烯稀释成浓度为5×10-3、5×10-4、5×10-5g·ml-1的正己烷溶液,存于-20℃的冰箱待用。
1.2 方法
1.2.1 EAG的测定 EAG反应测定方法和EAG反应相对值的计算方法同文献[11]。以反-2-己烯醛为参照化合物,其浓度为5×10-2g·ml-1。每个样品重复4根触角,每根触角刺激5次以上,样品测试前后用参照化合物各刺激一次。
1.2.2 数据处理 数据采用Excel和SPSS17.0软件进行分析,利用Origin2017绘图软件绘图。利用-检验(<0.05)分析处理与对照之间的差异显著性。不同处理之间的差异显著性分析采用单因素方差分析,利用Tukey检验分析其差异显著性(<0.05)。
2 结果
2.1 马铃薯块茎蛾对1 000 µg的16种挥发性化合物EAG反应
马铃薯块茎蛾未交配雌虫、交配雌虫、未交配雄虫对1 000 µg的参照化合物反-2-己烯醛的EAG反应值分别为(0.149±0.003)、(0.150±0.006)、(0.152±0.008)mV,三者之间无显著差异(>0.05)。
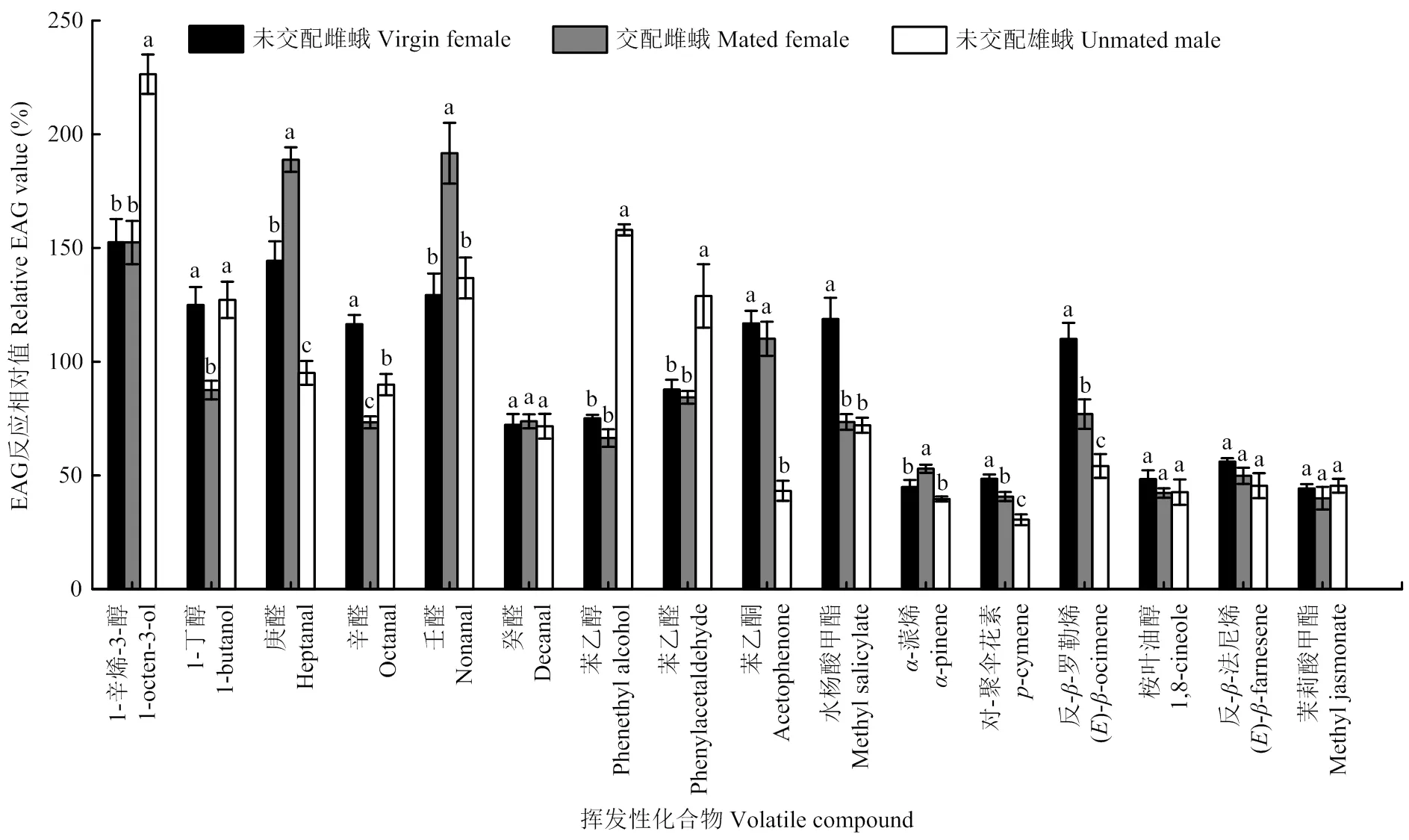
当刺激剂量为1 000 µg时,马铃薯块茎蛾未交配雌蛾、交配雌蛾、未交配雄蛾对16种化合物EAG反应绝对值均显著高于对照(<0.05)。但是,这3种生理状态的马铃薯块茎蛾对这16种化合物的EAG相对反应值差异较大。未交配雌蛾和雄蛾对醇类化合物的EAG相对反应值较高,交配雌蛾对醛类化合物的EAG相对反应值较高,3种不同生理状态的马铃薯块茎蛾对萜类化合物的EAG相对反应值均较低。未交配雌蛾和雄蛾对1-辛烯-3-醇的反应值显著高于多数化合物,分别为152.47%、226.42%;交配雌蛾对壬醛和庚醛的反应值显著高于其他化合物,分别为191.67%、188.87%(图1)。
当刺激剂量为1 000 µg时,不同性别和交配状态的马铃薯块茎蛾同种化合物的反应差异较大。对庚醛的反应为交配雌虫>未交配雌虫>未交配雄虫,对辛醛的反应为未交配雌虫>未交配雄虫>交配雌虫,对反--罗勒烯和对-聚伞花素的EAG反应均为未交配雌虫>交配雌虫>未交配雄虫。未交配雌蛾对水杨酸甲酯的反应值显著高于交配雌蛾和未交配雄蛾;交配雌蛾对壬醛、-蒎烯的EAG反应值均显著高于未交配雌蛾和雄蛾,对丁醇的反应值显著低于未交配雌蛾和雄蛾;未交配雄蛾对1-辛烯-3-醇、苯乙醇、苯乙醛的反应值显著高于雌蛾,对于苯乙酮的反应值显著低于雌蛾(<0.05)(图2)。

不同小写字母表示同一生理状态的马铃薯块茎蛾对不同化合物的EAG反应相对值经Turkey检验差异显著(P<0.05)
2.2 马铃薯块茎蛾对6种挥发性化合物的EAG剂量反应
当刺激剂量分别为1、10、100 µg时,马铃薯块茎蛾未交配雌蛾、交配雌蛾、未交配雄蛾对1-辛烯-3-醇、庚醛、壬醛、苯乙酮、水杨酸甲酯、反--罗勒烯的EAG反应值均显著高于对照(<0.05)。对不同剂量的1-辛烯-3-醇的EAG反应,3种生理状态的块茎蛾均为1 000 µg>100 µg>10 µg>1 µg;对庚醛的EAG反应,则为1 000 µg>100 µg>10、1 µg;对于壬醛、水杨酸甲酯的EAG反应,未交配雌虫与交配雌虫对不同剂量的反应趋势一致;对于苯乙酮、反--罗勒烯的反应,3种生理状态的马铃薯块茎蛾对不同剂量的反应趋势各不相同(图3)。总之,在测试剂量范围内,3种生理状态的马铃薯块茎蛾对6种化合物的EAG反应强度随刺激剂量的增加呈现增强的趋势,且均未达到饱和阈值。
不同小写字母表示未交配雌蛾、交配雌蛾、未交配雄蛾对同一化合物的EAG反应相对值经Turkey检验差异显著(P<0.05)
3 讨论
本试验所选取的16种马铃薯挥发物1-辛烯-3-醇、丁醇、庚醛、辛醛、壬醛、癸醛、苯乙醇、苯乙醛、苯乙酮、水杨酸甲酯、-蒎烯、对-聚伞花素、反--罗勒烯、桉叶油醇、反--法尼烯、茉莉酸甲酯在一定的剂量下均会引起马铃薯块茎蛾的EAG反应,表明马铃薯块茎蛾触角中的嗅觉外周神经系统对马铃薯气味的反应具有广谱性,这可以使马铃薯块茎蛾通过辨别环境中的不同气味,从而寻找到适合的寄主植物。但是,对于同种化合物,雌、雄马铃薯块茎蛾敏感性表现出不同程度的差异,这可能是由于雌蛾通常拥有的感受寄主植物挥发物的嗅觉感受神经元数量比雄蛾高[26]。本研究结果与欧洲玉米螟()雌、雄虫对寄主植物挥发物的EAG反应相似[27],但与苹果蠹蛾和女贞细卷蛾()对寄主植物挥发物EAG反应的结果不同,后者雌、雄虫的敏感性不存在差异[28-29]。马铃薯块茎蛾雌虫对寄主挥发物组分的敏感性因交配状态而异,在其他蛾类昆虫上也有类似结果[18-20]。
在马铃薯块茎蛾对剂量为1 000 µg马铃薯挥发性化合物的EAG反应中,交配雌蛾对于庚醛、壬醛、-蒎烯的电生理反应值显著高于未交配雌蛾和雄蛾。这3种化合物在低剂量下对马铃薯块茎蛾产卵具有引诱作用,庚醛在高剂量下对产卵具有驱避作用,壬醛对羽化3 d的交配雌蛾定向兼具引诱作用,庚醛和壬醛对未交配雄蛾的定向行为均不起作用[7,11,30]。因此,交配的雌蛾对这3种化合物更为敏感。未交配雄蛾对1-辛烯-3醇、苯乙醇、苯乙醛的EAG反应值显著高于未交配雌蛾和交配雌蛾,交配雌蛾与未交配雌蛾之间无显著差异。有研究表明,高剂量(4、40、400 mg)的1-辛烯-3醇具有干扰马铃薯块茎蛾在马铃薯块茎上产卵在作用[31],苯乙醇则是低浓度下对产卵具有引诱作用,高浓度下具有驱避作用[8],但是对于雄蛾的作用目前还不清楚。笔者推测,在雄蛾为了找到配偶而向寄主植物定向的过程中,寄主植物释放的这3种化合物(低剂量)有可能起着重要作用。未交配雌蛾对辛醛、水杨酸甲酯、反--罗勒烯的EAG反应值显著高于交配雌蛾和未交配雄蛾。辛醛对羽化后1 d的未交配雄蛾的定向具有驱避作用,对羽化后2—3 d的已交配雌蛾产卵具有驱避作用[11,31];水杨酸甲酯在高浓度下对雌蛾产卵具有引诱作用[8]。但辛醛、水杨酸甲酯、反--罗勒烯对未交配雌虫的作用目前还不清楚。3种生理状态的马铃薯块茎蛾对癸醛、桉叶油醇、反--法尼烯、茉莉酸甲酯的EAG反应值之间无显著差异。癸醛对交配雌蛾定向具有引诱作用,对未交配雄蛾的定向不起作用,对雌蛾产卵具有引诱作用[11];桉叶油醇在低浓度时对马铃薯块茎蛾雌蛾产卵具有引诱作用,而在高浓度时具有驱避作用[8,30];茉莉酸甲酯在低浓度时(接近完整马铃薯块茎释放的浓度)对交配雌蛾定向具有引诱作用。总之,马铃薯块茎蛾对某个化合物具有EAG反应只是表明该虫能够感受到该化合物,反应值的大小也仅表明其对该化合物的敏感性,由于化合物的挥发性不同,导致即使是同剂量的不同化合物,最终被马铃薯块茎蛾触角上的受体结合蛋白结合的剂量也不同。因此,部分化合物的功能需要行为和田间实验进一步验证。

不同小写字母表示同一生理状态的马铃薯块茎蛾对不同剂量的同一化合物的EAG反应相对值经Turkey检验差异显著(P<0.05)
Das等研究发现,同样是1 000 µg的化合物,马铃薯块茎蛾雌虫对反-2-己烯醛、苯乙酮、苯乙醇、-蒎烯的EAG反应值显著高于雄虫,而对于苯乙醛的反应,雌、雄虫的反应值无差异[21]。这与本研究的结果不同。造成这种差异的原因可能有两个方面:(1)Das等进行EAG测定时,没有检查马铃薯块茎蛾的交配状态,采用的是羽化后2—3 d雌、雄虫,本研究仅采用羽化后3 d雌、雄虫,而且严格区分了其交配状态;(2)Das等测定的是印度种群,本研究测定的为中国种群,昆虫的地域不同,也会导致其对同种挥发物的敏感性不同。
另外,马铃薯块茎蛾雌、雄虫对同剂量的同种化合物反应不同,有可能是由于其触角上的嗅觉感器对各化合物的感受不同所导致。Anfora等测定了马铃薯块茎蛾雌、雄蛾触角上的长毛形感受器对辛醛、庚醛、壬醛、1-辛烯-3-醇的单感器反应,发现在测定的雌蛾触角上的19个感器中,有17个感器至少对2种或2种以上的化合物具有电生理反应,有一个毛形感器对12种化合物具有电生理反应,分别有12、10、9、7个感器对1-辛烯-3-醇、辛醛、壬醛、庚醛发生反应;雄虫触角上的同种感器(测定的感器数为16个)却对辛醛、壬醛、庚醛无单感器反应,仅对1-辛烯-3-醇有反应(2个感器有反应)[31]。同种、同性别的昆虫在不同时期生命活动不同,导致与之密切相关的嗅觉蛋白(例如气味结合蛋白、嗅觉受体等)的表达量不同[32-33]。马铃薯块茎蛾未交配雌虫寻找寄主的目的是在寄主上求偶,交配雌虫寻找寄主的目的是在寄主上产卵。因此,未交配雌虫和交配雌虫对同种化合物EAG反应的差异,可能主要源于触角上嗅觉感器内嗅觉蛋白表达量的差异。
4 结论
马铃薯块茎蛾未交配雌虫、交配雌虫、未交配雄虫基于不同的生理需求和目的,对不同类别化合物的电生理反应表现出不同的敏感性,未交配雌蛾和雄蛾对脂肪族醇类化合物较敏感,交配雌蛾对脂肪族醛类化合物较敏感,3种不同生理状态的马铃薯块茎蛾对萜类化合物均不敏感。交配状态直接影响马铃薯块茎对寄主挥发物电生理反应,交配雌蛾对于庚醛、壬醛、-蒎烯的敏感性高于未交配雌蛾和雄蛾。对同一化合物不同剂量的电生理反应,交配雌蛾同样更为敏感。
[1] RONDON S I. The potato tuber worm: a literature review of its biology, ecology and control. American Journal of Potato Research, 2010, 87(2): 149-166.
[2] RONDON S I. Decoding(Lepidoptera: Gelechiidae) in the new age of change. Journal of Integrative Agriculture, 2020, 19(2): 316-324.
[3] GAO Y. Potato tuberworm: A threat for China potatoes. Entomology, Ornithology and Herpetology: Current Research, 2018, 7(2): 1000e132.
[4] 高玉林, 徐进, 刘宁, 周倩, 丁新华, 詹家绥, 成新跃, 黄剑, 鲁宇文, 杨宇红. 我国马铃薯病虫害发生现状与防控策略. 植物保护, 2019, 45(5): 106-111.
GAO Y L, XU J, LIU N, ZHOU Q, DING X H, ZHAN J S, CHENG X Y, HUANG J, LU Y W, YANG Y H. Current status and management strategies for potato insect pests and diseases in China. Plant Protection, 2019, 45(5): 106-111. (in Chinese)
[5] ARAB A, TRIGO J R, LOURENCÃO A L, PEIXOTO A M, RAMOS F, BENTO J M S. Differential attractiveness of potato tuber volatiles to(Gelechiidae) and the predator(Anthocoridae). Journal of Chemical Ecology, 2007, 33(10): 1845-1855.
[6] SHARABY A, ABDEL-RAHMAN H, MOAWAD S. Biological effects of some natural and chemical compounds on the potato tuber moth,Zeller (Lepidoptera: Gelechiidae). Saudi Journal of Biological Sciences, 2009, 16(1): 1-9.
[7] 马艳粉, 胥勇, 肖春. 10种寄主植物挥发物对马铃薯块茎蛾产卵的引诱作用. 中国生物防治学报, 2012, 28(3): 448-452.
MA Y F, XU Y, XIAO C. Oviposition attraction effect of ten host-plant volatiles on potato tuber moth,. Chinese Journal of Biological Control, 2012, 28(3): 448-452. (in Chinese)
[8] 马艳粉, 张晓梅, 胥勇, 肖春. 滇杨挥发物成分对马铃薯块茎蛾产卵选择的影响. 植物保护, 2016, 42(2): 99-103.
MA Y F, ZHANG X M, XU Y, XIAO C. Effects of volatiles fromon oviposition preferece of potato tuber moth,. Plant Protection, 2016, 42(2): 99-103. (in Chinese)
[9] 刘燕, 谢冬生, 熊焰, 王春娅, 任智强, 肖春. 庚醛与桉叶油醇组合对马铃薯块茎蛾产卵选择的影响. 植物保护, 2016, 42(3): 99-103.
LIU Y, XIE D S, XIONG Y, WANG C Y, REN Z Q, XIAO C. Effects of combination of cineole with heptanal on oviposition choices of the potato tuber moth,. Plant Protection, 2016, 42(3): 99-103. (in Chinese)
[10] DEKEBO A, ARYAL S, JUNG C. Olfactory responses of adult potato tuber moth,(Zeller) measured by attraction relative to the tomato leaf volatiles. Journal of Asia-Pacific Entomology, 2019, 22(2): 611-618.
[11] LI X, ZHANG X G, XIAO C, GAO Y L, DONG W X. Behavioral responses of potato tuber moth () to tobacco plant volatiles. Journal of Integrative Agriculture, 2020, 19(2): 325-332.
[12] 张小娇, 钱诚, 杨六三, 刘洪翠, 李成云, 董文霞. 不同生理状态的番石榴实蝇对寄主气味的行为反应. 应用昆虫学报, 2020, 57(1): 166-172.
ZHANG X J, QIAN C, YANG L S, LIU H C, LI C Y, DONG W X. Behavioral responses of sexually immature, mature virgin, and mated, guava fruit flies to host plant odor.Chinese Journal of Applied Entomology, 2020, 57(1): 166-172. (in Chinese)
[13] MECHABER W L, CAPALDO C T, HILDEBRAND J G. Behavioral responses of adult tobacco hornworms,, to host plant volatiles change with age and mating status. Journal of Insect Science, 2002, 2(1): 5.
[14] YAN F, BENGTSSON M, WITZGALL P. Behavioral response of female codling moths,, to apple volatiles. Journal of Chemical Ecology, 1999, 25(6): 1343-1351.
[15] LEMMEN-LECHELT J K, WIST T J, EVENDEN M L. State-dependent plasticity in response to host-plant volatiles in a long-lived moth,(Lepidoptera: Gracillariidae). Journal of Chemical Ecology, 2018, 44(3): 276-287.
[16] TANG R, SU M W, ZHANG Z N. Electroantennogram responses of an invasive species fall webworm () to host volatile compounds. Chinese Science Bulletin, 2012, 57(35): 4560-4568.
[17] ZHANG Z, BIAN L, SUN X, LUO Z, XIN Z, LUO F, CHEN Z. Electrophysiological and behavioural responses of the tea geometrid(Lepidoptera: Geometridae) to volatiles from a non-host plant, rosemary,(Lamiaceae). Pest Management Science, 2015, 71(1): 96-104.
[18] SHU S, GRANT G G, LANGEVIN D, LOMBARDO D A, MACDONALD L. Oviposition and electroantennogram responses of(Lepidoptera: Pyralidae) elicited by monoterpenes and enantiomers from eastern with pine. Journal of Chemical Ecology, 1997, 23(1): 35-50.
[19] MARTEL V, ANDERSON P, HANSSON B S, SCHLYTER F. Peripheral modulation of olfaction by physiological state in the Egyptian leaf worm(Lepidoptera: Noctuidae). Journal of Insect Physiology, 2009, 55(9): 793-797.
[20] SAVEER A M, KROMANN S H, BIRGERSSON G, BENGTSSON M, LINDBLOM T, BALKENIUS A, HANSSON B S, WITZGALL P, BECHER P G, IGNELL R. Floral to green: mating switches moth olfactory coding and preference. Proceedings of Royal Society B:Biological Sciences, 2012, 279(1737): 2314-2322.
[21] DAS P D, RAINA R, PRASAD A R, SEN A. Electroantennogram responses of the potato tuber moth,(Lepidoptera; Gelichiidae) to plant volatiles. Journal of Biosciences, 2007, 32(2): 339-349.
[22] 王国红, 刘勇, 戈峰, 吴开拓. 粉蝶盘绒茧蜂中国和荷兰种群学习行为及EAG反应的比较. 生态学报, 2012, 32(2): 351-360.
WANG G H, LIU Y, GE F, WU K T. Comparative study on learning behavior and electroantennogram responses in two geographic races of. Acta Ecologica Sinica, 2012, 32(2): 351-360. (in Chinese)
[23] BOLTER C J, DICKE M, VAN LOON J J A, VISSER J H, POSTHUMUS M A. Attraction of Colorado potato beetle to herbivore-damaged plants during herbivory and after its termination. Journal of Chemical Ecology, 1997, 23(4): 1003-1023.
[24] AGELOPOULOS N G, CHAMBERLAIN K, PICKETT J A. Factors affecting volatile emissions of intact potato plants,: Variability of quantities and stability of ratios.Journal of Chemical Ecology, 2000, 26(2): 497-511.
[25] KARLSSON M F, BIRGERSSON G, PRADO A M C, BOSA F, BENGTSSON M, WITZGALL P. Plant odor analysis of potato: Response of Guatemalan moth to above- and background potato volatiles. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5903-5909.
[26] BRUCE T J A, PICKETT J A. Perception of plant volatile blends by herbivorous insects—finding the right mix. Phytochemistry, 2011, 72(13): 1605-1611.
[27] SOLE J, SANS A, RIBA M, GUERRERO A. Behavioural and electrophysiological responses of the European corn borerto host-plant volatiles and related chemicals. Physiological Entomology, 2010, 35: 354-363.
[28] ANESBO L, CORACINI M D A, BENGTSSON M, LIBLIKAS I, RAMIREZ M, BORG-KARLSON A K, TASIN M, WITZGALL P. Antennal and behavioural response of codling mothto plant volatiles. Journal of Applied Entomology, 2004, 128(7): 488-493.
[29] SCHMIDT-BUSSER D, VON ARX M, CONNETABLE S, GUERIN P M. Identification of host-plant chemical stimuli for the European grape berry moth. Physiological Entomology, 2011, 36: 101-110.
[30] MA Y F, XIAO C. Push-pull effects of three plant secondary metabolites on oviposition of the potato tuber moth,. Journal of Insect Science, 2013, 13(1): 128.
[31] ANFORA G, VITAGLIANO S, LARSSON M C, WITZGALL P, TASIN M, GERMINARA G S, DE CRISTOFARO A. Disruption of(Lepidoptera: Gelechiidae) oviposition by the application of host plant volatiles. Pest Management Science, 2014,70: 628-635.
[32] 张治科, 吴圣勇, 雷仲仁. 西花蓟马气味结合蛋白的cDNA克隆、序列分析及时空表达. 中国农业科学, 2016, 49(6): 1106-1116.
ZHANG Z K, WU S Y, LEI Z R. Cloning, sequence analysis and expression profile of an odorant binding protein gene in western flower thrips ().Scientia Agricultura Sinica, 2016, 49(6): 1106-1116. (in Chinese)
[33] 陈丽慧, 李梅梅, 陈秀琳, 仵均祥, 许向利. 梨小食心虫普通气味受体基因的克隆及表达分析. 昆虫学报, 2019, 62(4): 418-427.
CHEN L H, LI M M, CHEN X L, WU J X, XU X L. Cloning and expression profiling of general odorant receptor genethe oriental fruit moth,(Lepidoptera: Tortricidae). Acta Entomologica Sinica, 2019, 62(4): 418-427. (in Chinese)
Electroantennogram Responses ofof Different Sexes and Mating States to Potato Volatiles
LI Xiang, ZHANG XiaoJiao, XIAO Chun, DONG WenXia
College of Plant Protection/State Key Laboratory for Conservation and Utilization of Bio-Resources in Yunnan, Yunnan Agricultural University, Kunming 650201
【】The objective of this study is find out the difference of electrophysiological responses of potato tuberworm () with different sexes and mating states to potato volatiles, and to provide a reference for the chemical ecological control of.【】Electroantennogram (EAG) responses of virgin female, mated female and unmated maleto 16 volatile compounds (including 6 aliphatic compounds viz.1-octen-3-ol,1-butanol,heptanal,octanal, nonanal and decanal, 4 aromatic compounds viz. phenethyl alcohol, phenylacetaldehyde, acetophenone and methyl salicylate, and 6 terpenoids viz.-pinene,-cymene, ()--ocimene, 1,8-cineole, ()--farnesene and methyl jasmonate) released from potato tubers and plants were recorded, and the dose-responses to 6 compounds (including 1-octen-3-ol, heptanal, nonanal, acetophenone, methyl salicylate and ()--ocimene)were also conducted.【】All the tested compounds could elicit EAG responses of. Among them, the aliphatic alcohols elicited significantly greater EAG values in the virgin females and the unmated males, and aliphatic aldehydes elicited significantly greater EAG values in the mated females. However, the terpenoids elicited lower EAG values in all the tested. At the dose of 1 000 µg,the same compound elicited varied antennal responses from thewith different sexes and mating states. Octanal, methyl salicylate and ()--ocimene elicited stronger responses in virgin females than those in the mated females and the unmated males, while heptanal, nonanal and-pinene elicited stronger responses in the mated females than those in the others. The compounds 1-octene-3-ol, phenethyl alcohol and phenylacetaldehyde elicited stronger responses in the males than those in the females. At the tested dose series (1, 10, 100 and 1 000 µg), EAG responses ofat 3 physiological states to 6 individual compounds increased with the increase of stimulation dose, and were far from saturation thresholds. For the same compound at different doses, EAG responses of the mated females varied significantly.【】The virgin females and the unmated males ofare more sensitive to aliphatic alcohols, and the mated females are more sensitive to aliphatic aldehydes. However, both the females and males are less sensitive to terpenoid compounds. Among the responses to the individual compound, the mated females are more sensitive to heptanal,nonanal and-pinene than the virgin females and the unmated males, so are their responses to the same compound at different doses.
potato tuberworm (); potato volatile;electroantennogram response

10.3864/j.issn.0578-1752.2021.03.009
2020-06-30;
2020-07-28
国家自然科学基金(31560607)、国家重点研发计划(2018YFD0200802)
李祥,E-mail:lixiang0217@126.com。通信作者董文霞,E-mail:dongwenxia@163.com
(责任编辑 岳梅)
