小麦生长模型对拔节期和孕穗期低温胁迫响应能力的比较
2021-03-09肖浏骏刘蕾蕾邱小雷汤亮曹卫星朱艳刘兵
肖浏骏,刘蕾蕾,邱小雷,汤亮,曹卫星,朱艳,刘兵
小麦生长模型对拔节期和孕穗期低温胁迫响应能力的比较
肖浏骏,刘蕾蕾,邱小雷,汤亮,曹卫星,朱艳,刘兵
南京农业大学农学院/国家信息农业工程技术中心/智慧农业教育部工程研究中心/农业农村部农作物系统分析与决策重点实验室/江苏省信息农业重点实验室/江苏省现代作物生产协同创新中心,南京 210095
作物生长模型是预测和评估气候变化对作物生产力影响的重要量化工具,明确典型作物生长模型对小麦拔节期和孕穗期低温胁迫响应能力的不足,可以为进一步改进低温胁迫对小麦生产力影响的模拟算法提供指导。本研究将来自4套国际知名小麦生长模型(美国密歇根州立大学的CERES-Wheat、美国华盛顿州立大学的CropSyst、荷兰瓦赫宁根大学的WOFOST和法国国家农业科学研究院的STICS模型)的典型低温胁迫效应算法,与本课题组研发的小麦生长模拟模型WheatGrow相耦合,利用2012—2013年南京和2013—2015如皋不同品种(扬麦16和徐麦30)、不同温度水平(最低至-6℃)和持续时间(2、4、6 d)的人工气候室低温盆栽试验资料,检验和评价了原WheatGrow模型和耦合后低温胁迫效应算法的WheatGrow模型在拔节期和孕穗期低温胁迫下对小麦叶面积指数动态、茎生物量、地上部总生物量、籽粒产量等指标的预测能力。拔节—孕穗期低温胁迫明显降低了小麦叶面积指数、地上部生物量积累和籽粒产量,且随低温水平的降低和持续时间的增加降低幅度呈明显升高趋势。比较不同处理时期和品种发现,小麦生长发育及产量对孕穗期低温处理较拔节期低温处理更加敏感,扬麦16较徐麦30对低温胁迫更为敏感。耦合了4种低温胁迫效应算法的WheatGrow模型在模拟叶面积指数动态上较原WheatGrow模型有所改善,但模拟误差仍然较大,其中对孕穗期低温处理的模拟误差大于拔节期处理。4种低温胁迫算法均低估了低温胁迫对茎生物量以及成熟期地上部生物量积累的不利影响。综合比较4种低温胁迫算法的预测能力可以看出,对于叶面积指数和地上部生物量的动态模拟,CropSyst模型中的低温胁迫效应算法表现最好;对于茎生物量的动态模拟,WOFOST模型中的低温胁迫效应算法表现最好,特别是孕穗期低温处理;对于籽粒产量的模拟,STICS模型中的低温胁迫效应算法表现最好,其次是CropSyst模型。耦合低温胁迫效应算法后的WheatGrow模型,在模拟叶面积指数、茎生物量、地上部生物量和籽粒产量上均好于原WheatGrow模型,且在弱低温条件下的模拟效果好于强低温条件,但是4套算法由于没有考虑低温胁迫对茎秆的直接伤害、低温胁迫对干物质分配的影响以及低温胁迫后的恢复和补偿效应,因此在模拟茎生物量积累,以及模拟不同低温持续时间下的地上部生物量积累存在明显不足。此外,4套低温效应算法引入参数较多,为模型的参数化带来一定的困难,有待今后进一步改进和完善。研究结果对改进小麦生长模型对低温胁迫响应,降低气候变化背景下作物生产力的预测预警的不确定性具有重要意义。
小麦;低温胁迫;作物生长模型;算法比较;模型检验;WheatGrow模型
0 引言
【研究意义】气候变化背景下,极端温度事件频发[1],给作物生产带来极为不利影响。小麦拔节后出现的极端低温事件,如倒春寒和晚-春霜冻害,成为限制小麦生产的主要气候灾害之一[2-3]。大量研究表明,拔节—孕穗期低温胁迫对小麦生长发育、器官建成和籽粒产量产生不利影响[4-7]。小麦是世界三大粮食作物之一,小麦安全生产在确保世界粮食安全上起着重要作用。全球多个小麦主产区的气候变化评估报告显示,极端低温胁迫事件的波动将进一步增加且变得更加难以预测,进而给全球小麦生产带来巨大风险[8-10]。因此,准确预测和评估极端低温胁迫对小麦生产的影响具有重要意义。【前人研究进展】作物生长模型是预测和评估气候变化背景下小麦生产力响应特征并制定适应性措施的重要工具[11]。针对性的检验和比较作物模型中温度响应算法的预测能力,是应用作物模型评估极端温度效应的前提和基础[12]。Wang等[13]系统性比较了29个小麦生长模型生育期、光合、呼吸等生理过程的温度响应算法对高温胁迫的响应,结果表明温度响应算法可以解释至少50%的产量模拟不确定性。Liu等[14]基于人工气候室小麦高温盆栽试验,比较了DSSAT-CERES-Wheat、DSSAT-Nwheat、APSIM-Wheat和WheatGrow 4个模型对小麦开花期和灌浆期高温胁迫的响应能力,4个模型均不能较好地模拟极端高温下小麦产量和品质的响应。前人在平均温度和极端高温效应上的算法评估和比较取得了重要进展,但很少有研究系统地比较作物模型中极端低温算法的响应能力[15-16]。Rötter等[12]通过综述最近5 000篇极端气候相关文献,发现大部分极端气候模拟研究集中在高温(33%)和干旱(44%)方面,而低温胁迫方面的模拟研究则不到2%。Bergjord等[17]构建了基于半致死温度()的冬小麦低温胁迫下致死率模拟模型FROSTOL,并利用多点多年试验资料检验评估后耦合进了WOFOST模型中。WOFOST模型中的低温胁迫算法在中国华北和黄淮等地区的多种作物和多个生育时期进行了测试和检验,结果显示低温胁迫算法可以较好地模拟重度霜冻发生后作物地上部生物量,但对轻度霜冻效应的模拟能力不足[18-19]。Persson等[20]在测试FROSTOL模型模拟冬小麦低温致死率时,分别使用植株顶端温度、空气温度和土壤温度作为模型输入,发现使用土壤温度时的模拟精度更高。Lecomte等[15]利用10年观测数据分别测试了小麦越冬期抗寒锻炼和脱抗寒锻炼的模拟算法;Savdie等[21]利用加拿大西部试验数据测试了CERES-Wheat模型中低温胁迫效应算法在越冬期的表现,但未对春季拔节后的表现进行测试。CropSyst模型和STICS模型具有一套完整的低温胁迫响应算法,但从未对拔节后的模拟表现进行测试[22-24]。APSIM-Wheat模型提出了低温胁迫对叶片衰老的影响算法,并将发生叶片衰老的默认温度范围设置为-5℃至-15℃,但由于从未经过测试,该算法在区域评估中也从未被使用[25-27]。Zheng等[9]在APSIM-Wheat中耦合了孕穗后期至开花期低温胁迫对产量影响的算法,Barlow等[28]基于澳大利亚低温事件数据构建并测试了开花期前后14 d低温胁迫对产量的影响算法,Bracho-Mujica等[27]通过设置不同日最低温度阈值,将开花期霜冻类型分为轻霜冻、中霜冻和重霜冻,然后在APSIM模型中添加了经验性的霜冻导致产量损失系数(轻霜冻减产10%,中霜冻减产20%,重霜冻减产90%),但都不适合拔节—孕穗期。Martino等[5]提出了拔节至灌浆期低温胁迫对小麦穗粒数影响的算法,并通过比较发现这套算法在模拟低温胁迫导致的穗粒数下降效应上优于STICS模型,但该算法参数比较复杂,且没有耦合到完整的作物模型中。【本研究切入点】现有作物模型对低温胁迫条件下的作物生长和产量形成模拟具有较大不确定性,且较少对小麦拔节后的低温胁迫响应进行系统检验。因此迫切需要系统性检验和评估已有低温胁迫效应算法对拔节后低温胁迫响应的预测能力。【拟解决的关键问题】本研究将比较4套国际知名小麦生长模型中典型低温胁迫效应算法对拔节期和孕穗期低温胁迫下小麦叶面积指数、器官及地上部生物量和籽粒产量的预测能力,明确现有低温胁迫效应算法对低温胁迫响应的优点与不足,为进一步改进和完善低温胁迫效应算法提供指导。
1 材料与方法
1.1 试验材料
试验材料选取江苏省主推的2个对低温敏感性不同的冬小麦品种扬麦16(低温敏感型)和徐麦30(耐低温型),其中扬麦16为江苏里下河地区农业科学研究所选育,属于春性中熟品种,对低温敏感,抗寒性差;徐麦30为徐州农业科学研究所提供,属于半冬性中晚熟品种,越冬抗寒性强,较抗春季低温。
1.2 试验设计
试验于2012—2015年在南京农业大学牌楼试验基地(118.78°E,32.04°N)和国家信息农业工程技术中心如皋试验基地(120.33°E,32.23°N)进行。盆栽试验所用的塑料桶深度为30 cm,直径为25 cm,桶底有5个1 cm2分布均匀的排水孔。试验用土取自南京农业大学牌楼试验站和国家信息农业工程技术中心如皋试验基地大田水稻土,经过细筛、晒干、称重后装入桶中,土壤容重1.34 g·cm-3,全氮含量0.95 g·kg-1,有机质含量13.3 g·kg-1,速效磷33 mg·kg-1,速效钾217 mg·kg-1。3年盆栽试验分别于11月4日、10月27日和11月3日播种,每桶播种25粒,播种深度为2 cm,到小麦3叶期每桶保留均匀分布且大小一致的10株。播种前每桶分别施肥0.9 g纯氮、0.5 g P2O5和0.9 g K2O,并浇入1 500 ml水,在拔节前再追施等量氮肥,灌溉、除草和病虫害防治等措施都采取当地最优管理措施,以防止其他逆境胁迫的发生。在低温处理前和处理后,小麦生长在室外自然环境中,与大田环境保持一致。分别于拔节期(Zadoks31,第一个节间伸长1—2 cm)和孕穗期(Zadoks45,旗叶叶片全部抽出,旗叶叶鞘包着的幼穗明显膨大)选取生育期和长势一致的盆栽小麦移入人工气候室进行短期低温处理,具体温度设置如表1。研究表明,小麦拔节至孕穗期的适宜平均温度大约为9.3—11.9℃[29],因此本试验将最高温16℃/最低温6℃(平均温度11℃)作为试验对照组。另外,通过分析我国冬小麦主产区1981—2009年冬小麦低温胁迫的时空分布特征发现,过去29年主产区拔节至孕穗期极端最低温度在-6℃左右,且最长持续时间不超过6 d[2]。因此,本试验设置最低温度处理组为4/-6℃,最长持续时间为6 d。
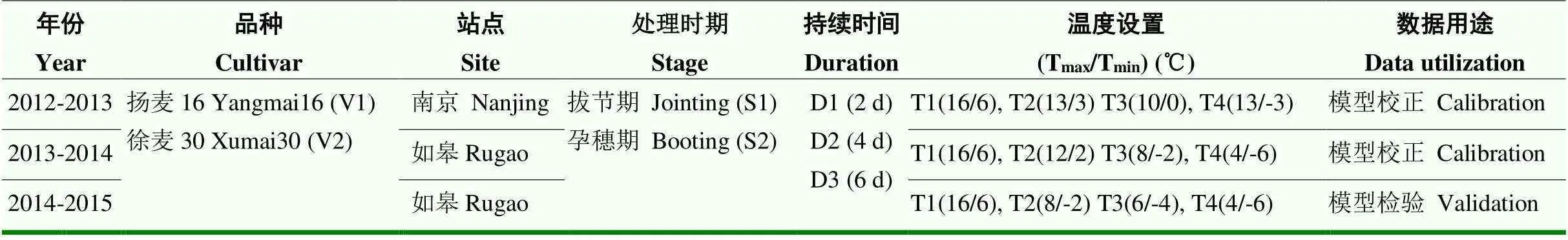
表1 多年人工气候室控温试验
全自动人工气候室采用高透明玻璃制成,长宽高为3.4 m×3.2 m×2.5 m,内有温湿度控制设备、照明控制设备(阴雨天气启动)以及自动换气设备。人工气候室内控温装置为5个分布均匀的温度传感器,采用5点平均法对室内温度进行感应。人工气候室内的温度昼夜变化模式采用正常环境中的温度日变化曲线方式,处理期间人工气候室内的温度变化模式,具体设置参考刘蕾蕾等[6]。此外,为了保持4个气候室除温度以外的其他因素尽可能一致,在气候室前后分别安装了进、出口风扇,用于与周围环境进行相对缓和的气体交换,从而避免CO2等因素的影响,所有处理湿度保持一致,控制在60%—90%。处理期间,为减少气候室内各方位光温的差异,每天下午17:00左右对室内桶的位置进行随机移动。
1.3 测定项目与方法
在每季试验过程中均准确记录小麦物候发育期,包括拔节期、孕穗期、抽穗期、开花期和成熟期。于非处理期间的主要生育期(三叶期、分蘖期、拔节期、孕穗期)进行破坏性取样,用于考察植株的基本生长状况;低温胁迫处理后的植株每隔7—9 d取一次样,直至生理成熟期,每次取样3桶(3个重复)。取回的样品分为绿叶、茎鞘和穗,于烘箱内105℃杀青0.5 h,在80℃的烘箱里烘干至恒重后称重,以观测每桶植株各器官的干物质积累和分配动态。叶面积利用LAI-3000(LI-COR,Lincoln,NE,USA)测试。当小麦达到成熟期后,各处理取12桶小麦植株,分为3次重复,分别测试每个重复小麦的地上部总干物重及籽粒产量(含颖壳,14%含水量)。
1.4 低温效应算法
为了比较不同低温胁迫效应算法的预测能力,同时排除因不同小麦模型中模型结构差异带来的不确定性,本研究选取目前国际上4套知名小麦生长模型中已有的低温效应算法,与本课题组已有的小麦生长发育及生产力预测模型WheatGrow相耦合,并利用人工气候室低温控制试验观测资料,对耦合后的WheatGrow模型进行检验和评价。
1.4.1 CERES-Wheat低温效应算法 CERES(Crop Environment Resource Synthesis)模型是20世纪70年代在美国农业部农业研究局(USDA-ARS)支持下,由密歇根州立大学RiTchie教授牵头组织,经过多年研究推出的作物生长模拟模型,其小麦模型(CERES-Wheat)已经整合到DSSAT 4.7平台中[30-31]。CERES-Wheat中的低温胁迫效应算法是20世纪90年代提出的基于低温抗寒锻炼因子()的叶片、植株在低温下的损伤算法,最早出现在CERES- Wheat 2.0中,现在已被DSSAT-Nwheat耦合成其中的一个子模块[21]。低温效应算法分为低温胁迫下叶片衰老致死算法(图1)和植株顶端温度(T)小于致死温度()的致死算法(图1)。在叶片衰老致死算法中,综合利用日最高温(T)、日最低温(T)、积雪深度(snow depth,)和低温抗寒锻炼因子(hardening index,)计算了叶片致死因子(killing factor,,取值范围0—1),其计算见公式(1)。
=(0.02×-0.1)×(T×0.85+ T×0.15+ 2.5×+T) (1)
式中,T是温度系数,与生育时期有关,默认值是10(越冬期),由于该算法只在越冬期测试过,所以默认值都是越冬期的参数。本研究利用拔节—孕穗期人工气候室低温试验资料对温度修正系数进行了校正,具体设置如表2。为低温抗寒锻炼因子,取值范围为0—2,其计算过程分为抗寒锻炼过程(公式2)和脱抗寒锻炼过程(公式3)。在拔节前,植株顶端温度(T)介于-1到8℃之间时发生低温抗寒锻炼,以0.06—0.1的速率从0开始往上积累,最快10 d累计到1,在拔节后如果大于1且T小于0,将以0.083的速率继续累加,需要12 d从1累计到2,具体计算过程如公式(2)。

当日最高温大于10℃时,小麦发生脱抗寒锻炼作用,开始下降,其计算过程分为拔节前和拔节后,其中拔节后的脱抗寒锻炼速率是拔节前的2倍,如公式(3)。

式中,(De-hardening rate coefficient)是脱抗寒锻炼速率系数,默认值为0.02。
低温下植株致死算法通过先计算低温致死温度(),然后计算低温胁迫下植株的存活率,其计算如公式(4)和(5)。

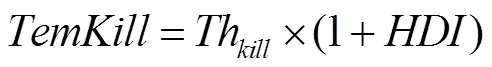
式中,是植株的存活率,取值范围0—1;T是最小顶端温度,其计算见公式(7);是低温致死温度,随着的不同而变化;Th(initial killing temperature)是开始致死的温度,是模型参数,与品种抗性和生育期有关,默认值是-6℃(越冬期)。具体参数设置如表2。
植株顶端温度的计算与积雪深度()相关,其具体计算见公式(6—9)。
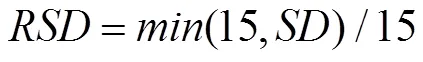
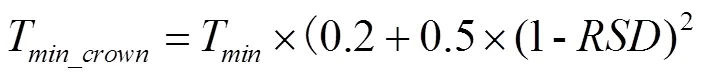
图1 扬麦16拔节期低温处理下CERES-Wheat模型中叶片致死因子(a)和植株存活率(b)的取值分布
Fig. 1 The value of killing factor of green leaf (a) and plants survival (b) for Yangmai16 at jointing stage in CERES-Wheat
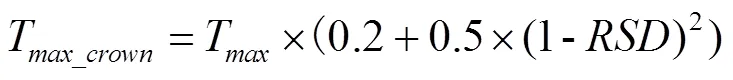

式中,T,T和T分别是最小顶端温度、最大顶端温度和平均顶端温度;是积雪深度,最大限制为15 cm,是相对积雪深度。
1.4.2 CropSyst低温效应算法 CropSyst(Cropping Systems Simulation Model)模型是美国华盛顿州立大学Stöckle等[32]组织开发的多年、多作物、以天为步长的作物模型系统,常用于作物生产潜力的模拟、栽培方案的优化及气候变化背景下极端气候因子对作物生产力影响的模拟。CropSyst采用线性方程来模拟低温胁迫对冠层叶面积指数(leaf area index,)和潜在最大收获指数(harvest index,HI)的限制作用[22],其具体计算见公式(10—11)。

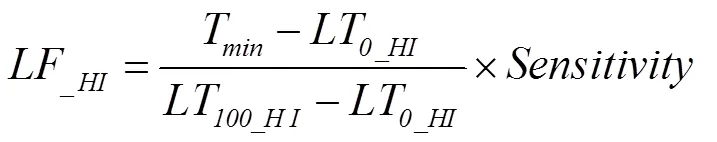
式中,KF和LF是低温胁迫下叶片致死因子和潜在最大收获指数限制因子,取值范围为0—1,取值越接近0,表明限制作用越小;T是日最低温度;LT和LT分别是叶片开始致死温度和完全致死温度,具体见图2-a;LT和LT分别是潜在最大收获指数开始受到低温胁迫限制的温度和完全受到低温胁迫限制的温度,是收获指数对温度胁迫的敏感性因子,随品种和生育时期而变化,具体参数取值如表2。
1.4.3 WOFOST低温效应算法 WOFOST(World Food Study)模型是荷兰瓦赫宁根大学de Wit等[33]开发的作物生长模型,其低温胁迫模块来自于专门模拟低温胁迫作物致死率的FROSTOL模型[17]。FROSTOL(Frost model of)模型基于抗寒锻炼、脱抗寒锻炼、积雪覆盖和低温胁迫影响等4个过程来模拟整个生育期半致死温度()的变化。WOFOST模型在低温胁迫下对作物生产力的模拟表现已经得到广泛的测试和应用[18-19,34],其中低温胁迫效应主要影响植株总生物量,其具体算法见公式(12)。

式中,RF(reduction factor on biomass)是低温对生物量的限制因子,取值范围0—1,取值越接近0,表明限制作用越小;是半致死温度,是作物的抗寒参数;T的定义和计算见公式(7);Kill(steepness coefficient for logistic kill function)是致死速率方程系数,随品种和生育期而变化,具体取值如表2和图2-b。
1.4.4 STICS低温效应算法 STICS(Simulateur mulTIdiscplinaire pour les Cultures Standard)模型是法国农业科学研究院(INRA)Brisson等[23,35]于1996年组织开发的多作物生长模型,已经被广泛应用于气候变化背景下作物生产力预测及适应性措施评估。STICS模型采用三段直线法模拟低温胁迫对叶面积和穗粒数的影响,有4个参数,包括开始致死温度(T)、10%致死温度(T)、90%致死温度(T)和完全致死温度(T),具体见公式(13)和图2-c。STICS模型中有关低温胁迫对产量的效应算法在原模型中只作用于开花期和灌浆期,为了测试该算法是否适用于拔节—孕穗期,本研究把原算法的作用时期和作用对象均做了修改,改成拔节期和孕穗期低温胁迫对潜在最大收获指数的效应算法,然后利用2013、2014年的试验数据进行参数校正(表3)。
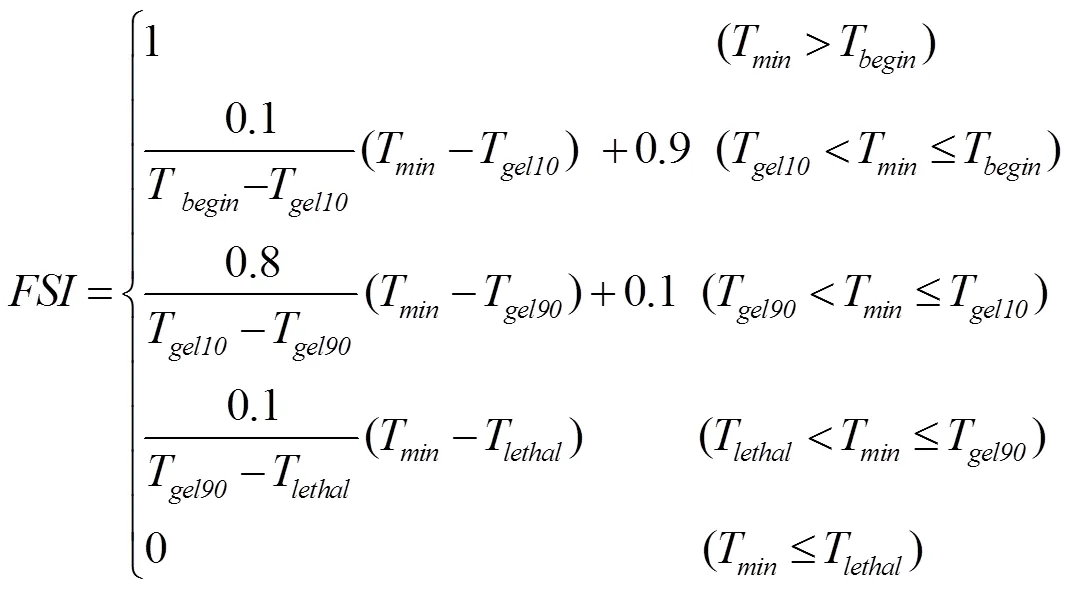
式中,是低温胁迫对叶面积指数或潜在产量的影响因子,取值范围为0—1,取值越接近0,表明低温胁迫效应越大;T是日最低温度;T和T在模型中取定值,分别为0℃和-13℃;T和T随品种和生育期而变化,具体取值如表2和图2-c。
1.5 模型参数校正与检验
为了比较不同低温胁迫效应算法的预测能力,同时排除因不同小麦模型中模型结构差异带来的不确定性,本研究将国际知名的4套小麦模型(CERE-Wheat、CropSyst、WOFOST和STICS)中的低温胁迫效应算法与课题组已有的小麦生长发育与产量预测模型WheatGrow相耦合。原WheatGrow模型没有低温胁迫效应算法,在耦合过程中,将4种算法分别写入WheatGrow模型中的光合生产及干物质积累子模型和干物质分配及产量形成子模型,根据不同算法特点分别计算低温胁迫发生后每天的叶面积、地上部总生物量和收获指数限制因子,并分别作用于每日生物量积累、分配和产量形成过程的模拟。将4套耦合低温胁迫效应算法后的WheatGrow模型与耦合前的WheatGrow模型进行比较,测试模型对低温胁迫下叶面积指数、地上部总生物量、茎生物量和籽粒产量等的预测能力。
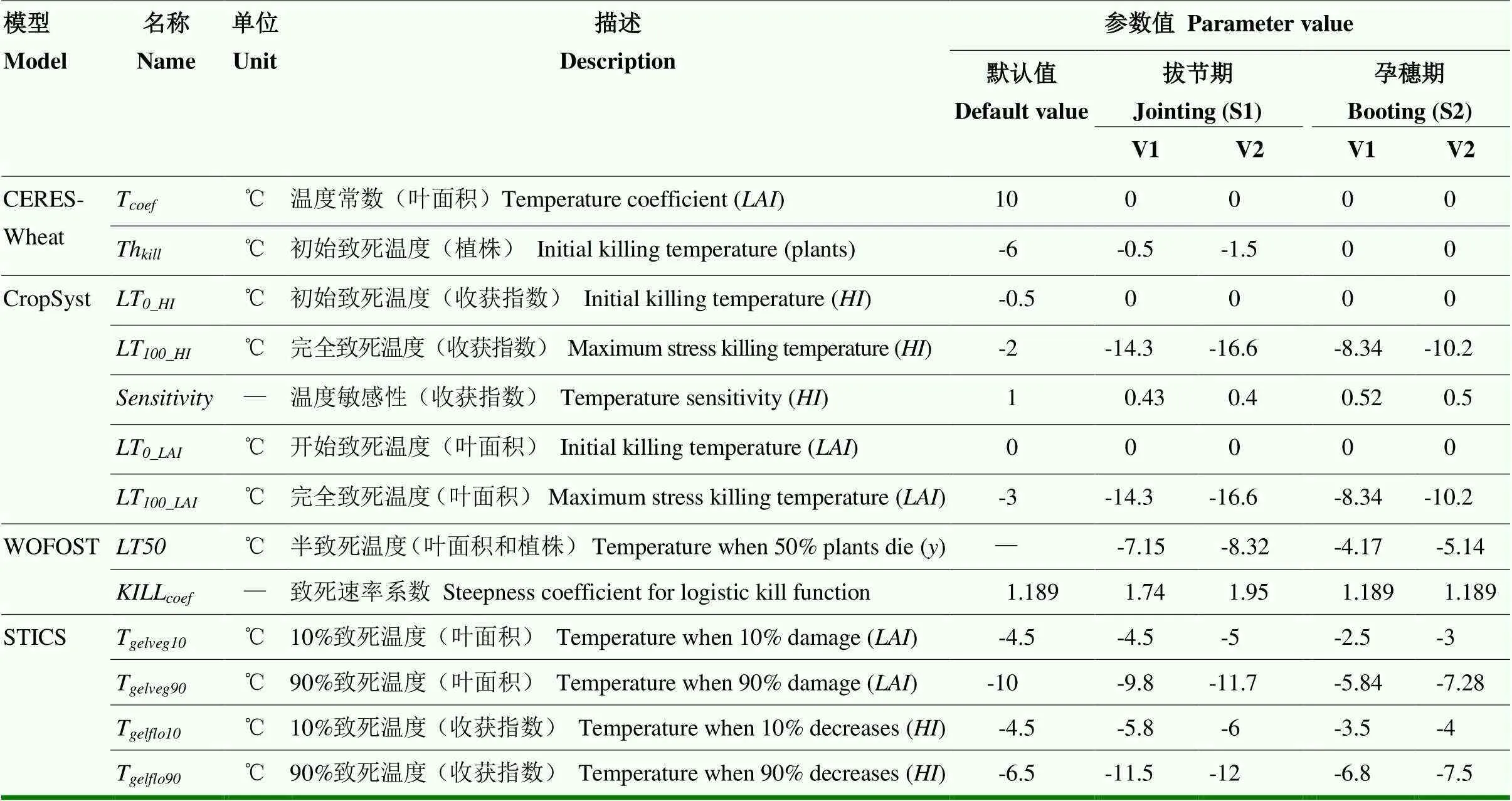
表2 4种小麦生长模型中低温胁迫效应算法参数及取值
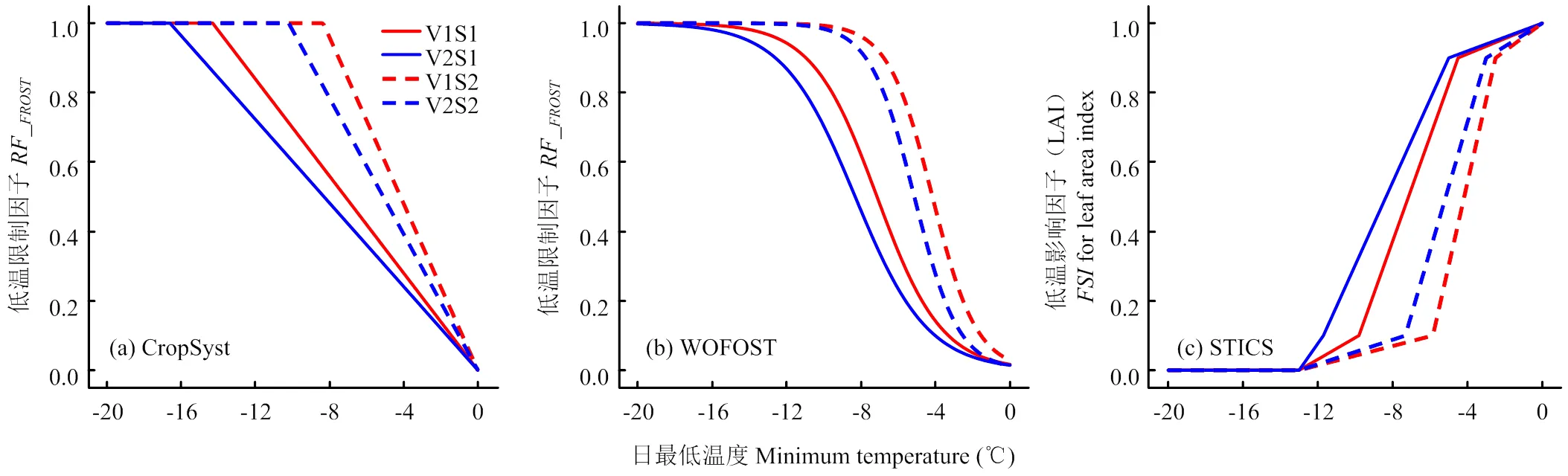
图2 不同低温处理下3套小麦生长模型低温胁迫效应算法中叶面积受低温胁迫影响因子与日最低温之间的关系
由于低温胁迫效应算法主要涉及叶面积指数动态和产量形成,为了直观地比较低温胁迫效应算法对叶面积伤害和产量损失的模拟效果,将低温胁迫处理下的叶面积指数和籽粒产量的模拟值和实测值分别减去对照处理下的叶面积指数和籽粒产量模拟值和实测值,从而求出不同低温处理下叶面积及产量较对照条件下的相对模拟值和实测值,用于不同低温胁迫效应算法模拟能力的比较。
将2013—2015年3个生长季的人工气候室盆栽试验观测资料分成2组独立数据,分别用于模型参数的校正和检验。其中2013和2014年的数据用来调参,2015年的数据用来对模型的模拟表现进行检验。由于不同模型低温算法中的默认参数大部分不适合拔节期和孕穗期的低温胁迫,本研究用2013和2014年的试验数据首先对参数进行校正,校正后的结果见表2。
为综合评价和检验模型模拟结果的准确性和可靠性,采用目前国际上广泛使用的5项评价指标:(1)平均绝对误差(mean absolute error,);(2)均方根误差(root mean square error,);(3)相对均方根误差(relative root mean square error,);(4)一致性系数(consistency indicator,-index);(5)决定系数(determination coefficient,2)。可以更好地反映模拟值误差的实际情况。是模拟值与观测值偏差的平方和与观测次数n比值的平方根,其表征的含义是模拟值与观测值之间的差异大小,用来衡量模拟的准确程度,越小,模拟精度越高。是均方根误差与观测平均值的比值的百分比,可以综合评价模型的预测效果,越小,模拟精度越高,若大于30%则说明模拟结果较差。-index是模拟值与实测值的一致性系数,取值范围是0—1,其值越接近1说明模拟的效果越好[36-37]。
2 结果
2.1 叶面积指数动态对低温胁迫响应的模拟
从不同低温胁迫下实测叶面积动态可以看出,小麦叶面积指数随着低温水平的降低和持续时间的增加呈明显下降趋势。4套耦合模型都能反映低温胁迫下叶面积指数下降的趋势(图3)。原模型在拔节期低温处理(T<0)下模拟小麦叶面积指数的均方根误差()、相对均方根误差()和一致性系数(-index)分别为0.8 m2·m-2、32.7%和0.95,孕穗期低温处理的模拟误差大于拔节期处理,其中和较拔节期分别增加了0.8 m2·m-2和49%,-index降低了1.00(表3)。4套耦合低温效应算法的模型模拟叶面积指数的模拟误差较原WheatGrow模型有所下降,其中、和分别平均下降了0.4 m2·m-2、0.4 m2·m-2和21.6%,-index和2变化不大,较原WheatGrow模型平均分别上升了0.05和0.06。
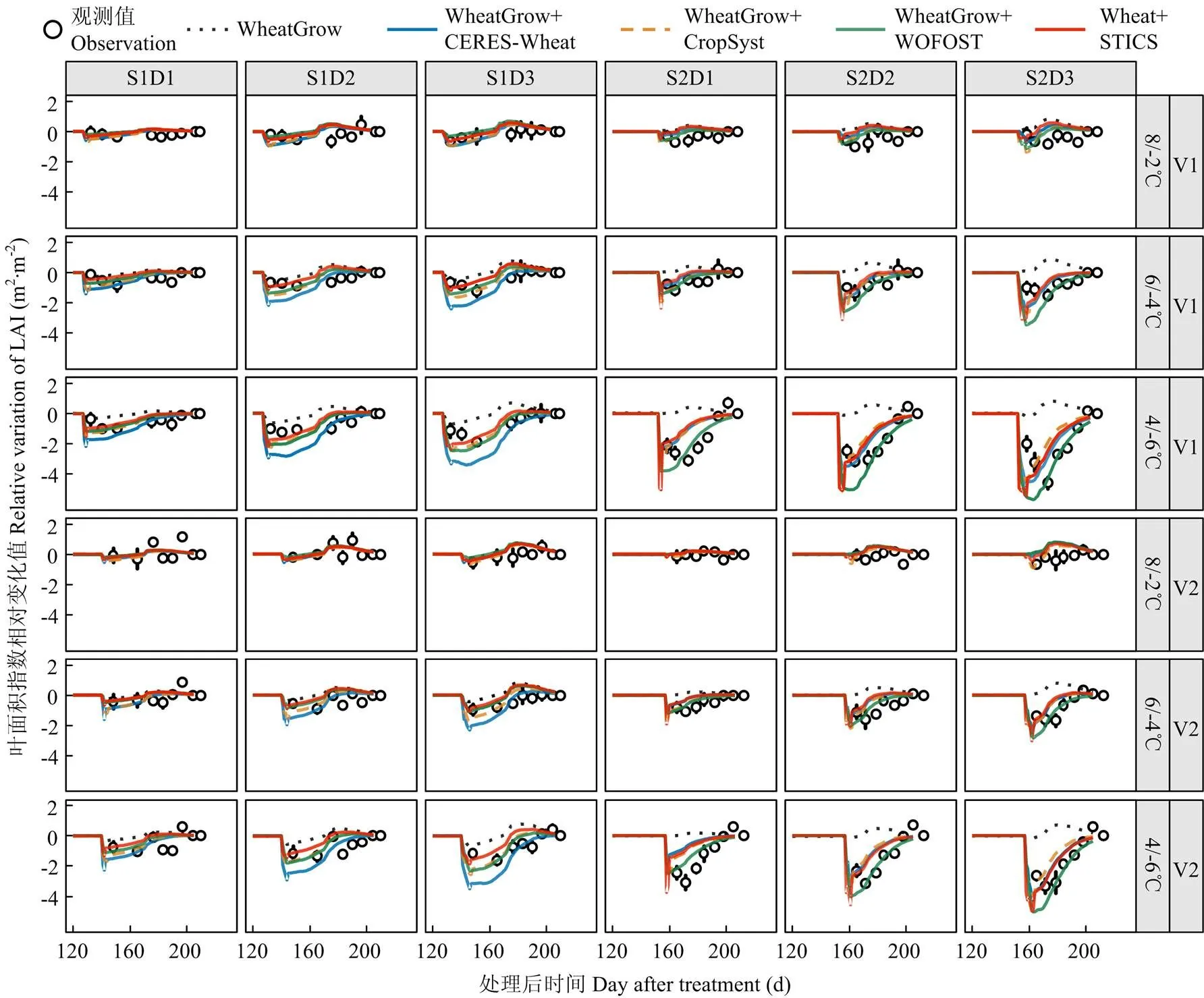
V1:扬麦16;V2:徐麦30;S1:拔节期;S2:孕穗期;D1:2 d;D2:4 d;D3:6 d。下同
从不同模型的模拟表现可知,WOFOST低温效应算法表现最好,其在拔节期低温胁迫下模拟值的、和-index分别为0.6 m2·m-2、26.3%和0.96,在孕穗期分别为0.8 m2·m-2、42.3%和0.94;CERES-Wheat和STICS低温胁迫效应算法表现相对较差(表3)。从不同温度水平来看,温度越低,叶面积指数下降越多(图3)。4套耦合模型均能模拟叶面积指数对不同低温水平的响应,但随着温度的下降,模拟精度降低,例如在孕穗期8/-2℃处理下,4套耦合模型模拟值的、和-index分别为0.8 m2·m-2、30%和0.97,但在4/-6℃处理下模拟值的、和-index分别为1.1 m2·m-2、86.3%和0.77。从不同低温持续时间来看,4套耦合模型模拟的低温胁迫下叶面积指数变化动态与实测值的时间变化动态并不一致,模拟值表现为低温胁迫期间叶面积指数立即下降,而实测值表现为缓慢下降(图3)。
2.2 茎生物量积累动态对低温胁迫响应的模拟
观测结果显示,低温胁迫处理下茎生物量明显降低,其中扬麦16(V1)较徐麦30(V2)对低温胁迫更加敏感,孕穗期处理较拔节期处理对低温更加敏感。由于4套耦合模型都缺乏低温胁迫对茎秆直接伤害的模拟,所以在强低温胁迫条件下,特别是孕穗期处理,4套模型总体上均低估了低温胁迫对茎秆的伤害效应(图4)比较4套模型对茎生物量的模拟表现可以看出,WOFOST模型算法在孕穗期低温处理下对茎生物量积累动态的模拟效果最好,观测值和模拟值之间的、和较原WheatGrow模型分别平均下降了1 918 kg·hm-2、2 412 kg·hm-2和52.1%,较其他3套耦合模型平均低1 306 kg·hm-2、1 592 kg·hm-2和34.4%;D-index较原WheatGrow模型提高了0.28,较其他3套耦合模型提高了0.14(表3)。除了耦合WOFOST模型中的低温胁迫算法外,其他3套耦合后的模型均低估了孕穗期低温下茎生物量积累动态的影响。WOFOST模型通过模拟整个植株致死从而减少茎生物量,但其在持续时间为2 d(D2)时仍然低估了孕穗期低温胁迫对茎生物量的影响。4套耦合模型对拔节期低温胁迫下茎生物量的模拟效果好于孕穗期,其中对拔节期低温胁迫模拟的茎生物量、和平均分别为585.5 kg·hm-2、751.9 kg·hm-2和13.5%,比孕穗期分别低689 kg·hm-2、919 kg·hm-2和22.6%,而-index和2比孕穗期处理高0.13和0.25。
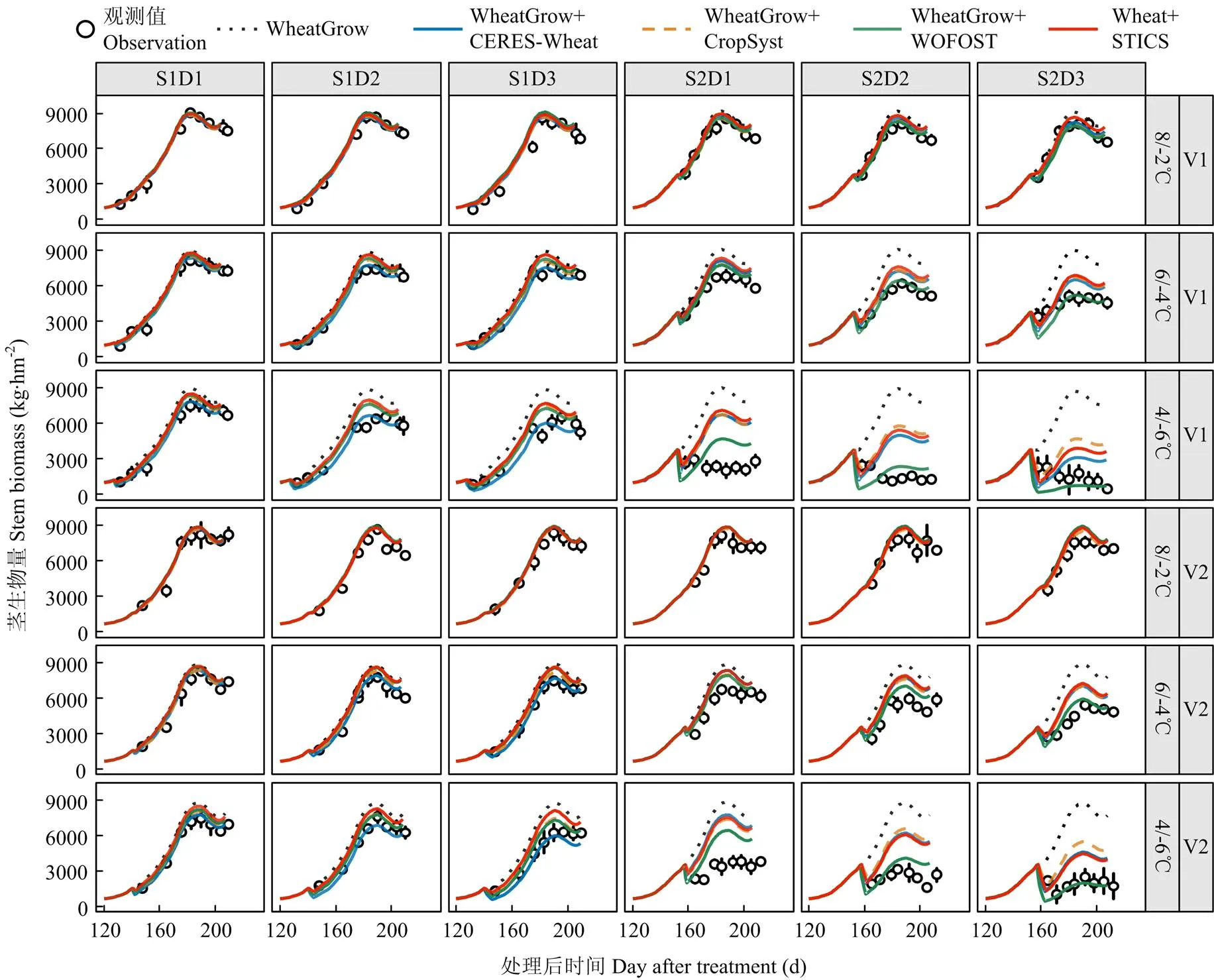
图4 原WheatGrow模型和耦合4种低温胁迫效应算法后的WheatGrow模型对2014-2015年茎生物量积累动态模拟值和实测值的比较

表3 原WheatGrow模型和耦合4种低温胁迫效应算法后的WheatGrow模型对叶面积指数和茎生物量动态预测误差的统计检验
a-e分别为WheatGrow、WheatGrow+CERES-Wheat、WheatGrow+CropSyst、WheatGrow+WOFOST和WheatGrow+STICS;和R分别为平均绝对误差、均方根误差、相对均方根误差、一致性系数和决定系数。下同
a-e represent WheatGrow, WheatGrow+CERES-Wheat, WheatGrow+CropSyst, WheatGrow+WOFOST and WheatGrow+STICS, respectively.andRrepresent mean absolute error, root mean square error, relative root mean square error, consistency indicator and determination coefficient, respectively. The same as below
2.3 地上部生物量积累动态对低温胁迫响应的模拟
观测结果显示,低温胁迫发生后,地上部生物量积累受到抑制,且温度越低、持续时间越长地上部生物量积累的越少,其中在孕穗期4/-6℃处理下地上部干物质受到不可逆的影响。由图5可知,4套耦合模型均能在一定程度上反映低温胁迫对地上部生物量积累的限制效应,但表现存在差异。总体上看,多数耦合模型在弱低温上的模拟效果好于强低温下的模拟效果,但在部分模型上存在相反的趋势。例如,WOFOST 低温效应算法在孕穗期的强低温条件下模拟效果较好,但是在拔节期和孕穗期的弱低温下却低估了低温胁迫对地上部生物量的影响。从不同处理时期来看,4套耦合模型对拔节期地上部生物量动态的模拟效果好于孕穗期。从不同品种来看,拔节期处理4套耦合模型对2个品种地上部生物量的预测表现相差不大,而孕穗期4套耦合模型对扬麦16(V1)地上部生物量的预测精度小于徐麦30(V2)。
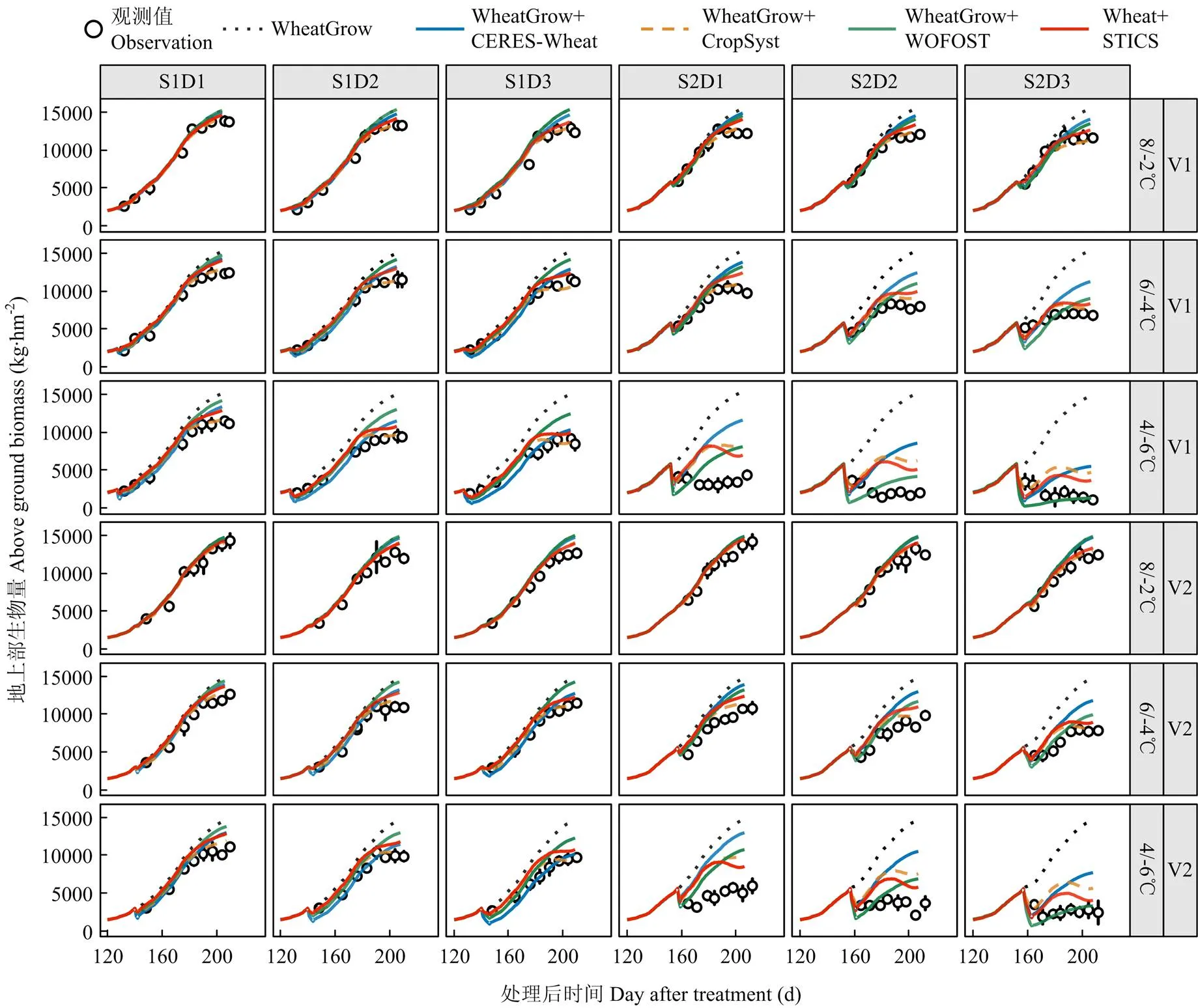
图5 原WheatGrow模型和耦合4种低温胁迫效应算法后的WheatGrow模型对2014-2015年地上部生物量积累动态的模拟值和实测值的比较
从不同模型对成熟期地上部生物量的模拟表现来看,CropSyst和STICS低温效应算法平均表现最好,其分别为1 772 kg·hm-2和1 944 kg·hm-2,较其他2个模型平均值分别降低了1 172 kg·hm-2和1 000 kg·hm-2;分别为20.1%和21.1%,较其他2个模型平均值分别降低了11.8%和10.8%;而-index为0.89和0.86,较其他2个模型平均值分别提高了0.10和0.07(表4)。在强低温(4/-6℃)处理下,拔节期表现最好的是CropSyst和STICS低温效应算法,两者模拟成熟期生物量的、、、-index和2的平均值分别为1 086 kg·hm-2、1 188 kg·hm-2、12.0%、0.81和0.79;孕穗期表现最好是WOFOST和STICS低温效应算法,两者、、、-index和2的平均值分别为2 998 kg·hm-2、3 269 kg·hm-2、101.6%、0.74和0.8,模拟精度仍然不高(表4)。
2.4 籽粒产量对低温胁迫的响应模拟
低温胁迫处理后小麦籽粒产量明显下降,且温度越低持续时间越长产量下降的越明显,孕穗期对产量的影响大于拔节期。由于CropSyst模型和STICS模型的低温胁迫效应算法考虑了低温胁迫对产量效应,所以耦合这2套模型低温算法后对产量动态的模拟结果好于耦合其他2套模型的结果(图6)。由图7可以看出,4套耦合模型在最终籽粒产量模拟上较原模型均有改善,其中CERES-Wheat和WOFOST低温效应算法的改善效果较差,而CropSyst和STICS低温效应算法的改善效果最好。在低温胁迫(Tmin<0℃)处理下,CERES-Wheat和WOFOST低温效应算法后对成熟期籽粒产量模拟结果的和较原WheatGrow模型平均下降1 174 kg·hm-2和37.3%,-value平均较原WheatGrow模型提升0.05,而CropSyst、STICS算法对成熟期籽粒产量模拟结果的和较原WheatGrow模型平均下降2 330 kg·hm-2和72.5%,-value平均较原WheatGrow模型提升0.24(表4)。在2套具备低温胁迫直接限制产量形成的算法中,STICS模型的表现好于CropSyst模型,其中STICS低温效应算法在拔节期和孕穗期模拟的籽粒产量的相比CropSyst模型分别低160.7 kg·hm-2和91.4 kg·hm-2,相比CropSyst模型分别低3.8%和3.1%(表4),2个模型在强低温4/-6℃处理时表现差异最大(图7)。

图6 原WheatGrow模型和耦合4种低温胁迫效应算法后的WheatGrow模型对2014-2015年灌浆期籽粒产量模拟值和实测值的比较

表4 原WheatGrow模型和耦合4种低温胁迫效应算法后的WheatGrow模型对成熟期地上部生物量和产量预测误差的统计检验
3 讨论
春季极端低温事件成为气候变化背景下制约冬小麦生产的重要因素之一。作物生长模型为评估气候变化条件下的小麦生产力提供了量化工具。现有作物生长模型中,大部分缺乏模拟低温胁迫效应的算法[28]。少量具有低温胁迫效应算法的模型,例如CERES-Wheat低温效应算法,仅在越冬期测试过该算法对低温胁迫的响应,在其他生育时期上的表现并未做系统研究[21]。本研究将来自4套国际知名小麦模型(CERES-Wheat、CropSyst、WOFOST和STICS)中的低温效应算法与本课题组研发的WheatGrow模型相耦合,并利用人工气候室低温控制试验资料,对模型在拔节—孕穗期低温胁迫下的模拟表现进行了系统性检验和评估,研究结果为进一步改进和完善小麦模型在低温胁迫下的模拟表现提供指导。
从模型检验结果看,4种算法对低温胁迫的响应存在明显差异。CropSyst和STICS模型中的低温响应算法在叶面积指数和产量上的模拟表现好于其他2套模型算法,主要原因是这2套模型设置了不同的参数来体现不同低温处理时期、不同低温强度对小麦不同器官的影响。然而,大量的参数设置不仅给参数调试带来很大的麻烦,还会对模拟结果产生较大的不确定性。虽然不同低温效应模拟算法定义的相关温度参数不一样,但本研究在参数校正时利用实测数据估算了模型中使用的半致死温度,以减少不同低温效应算法调参过程中产生的不确定性。
拔节期和孕穗期低温胁迫打破了小麦源库平衡,显著降低了小麦的库容量和源强度。首先,拔节期和孕穗期低温胁迫造成植株叶片、茎损伤,影响生物量积累相关过程,降低源的供给(图3—4)。此外,拔节期和孕穗期的低温胁迫对小穗发育的影响会造成库强的降低(图6)。叶、茎、穗对低温胁迫的敏感性差异导致了地上部生物量向各个器官分配的比例发生变化[4-7],厘清低温胁迫对地上部总生物量积累和不同器官生物量的积累是进一步探究产量形成规律和构建低温胁迫下产量形成模拟模型的关键。已有的模型对低温胁迫下茎生物量积累的低估是地上部生物量低估的主要因素。在对茎生物量积累的模拟上,特别是孕穗期低温胁迫处理下,除了WOFOST模型中的低温算法外,其他模型算法都低估了茎生物量对低温胁迫的响应。WOFOST中的低温效应算法在模拟孕穗期低温胁迫对地上部生物量的影响上表现较好,主要原因在于模型高估了孕穗期低温胁迫对叶面积指数的损伤效应,所以弥补了对低温胁迫下茎生物量伤害效应模拟值偏低的不足。
低温胁迫条件下,小麦叶绿素含量下降[38],光合生产受到抑制[6],现有低温胁迫效应算法大部分均考虑了低温对叶片衰老死亡的效应;但大部分模型中的低温效应算法并没有考虑低温胁迫对潜在最大收获指数的影响,CropSyst除外。STICS模型虽然有低温胁迫对穗粒数影响的算法,但只适用于开花后;本研究将STICS模型中花后低温效应算法应用到拔节—孕穗期,能较好地模拟小麦产量对拔节—孕穗期低温胁迫的响应。Barlow等[28]认为,现有大部分作物模型中的低温胁迫效应算法均具有较强的经验性,并没有较好地体现具体低温胁迫对小麦生长发育及产量形成过程的影响,例如对小麦生育进程、光合作用、干物质分配、小花分化及退化和穗粒数形成等过程均缺乏较好的量化。
低温胁迫对小麦的伤害程度除了跟低温程度有关,还跟所处生育时期小麦的低温敏感性和低温持续时间有关。4种低温胁迫效应算法通过设置不同低温阈值参数反映不同时期、不同品种以及不同器官对低温胁迫的敏感性差异(表2)。CERES-Wheat模型中的低温胁迫效应算法,通过构建低温抗寒锻炼因子反映低温胁迫下不同时期和不同持续时间下抗寒性的不同[21]。该算法主要适用于越冬期低温,春季返青后低温抗寒锻炼因子快速下降为0,从而在拔节—孕穗期的低温胁迫中并没有很好响应。CropSyst模型通过定义低温敏感性参数()反映收获指数对不同生育时期低温胁迫的敏感性差异。而STICS模型在每个生育时期都设置温度阈值参数(10%致死温度T和90%致死温度T)体现作物不同时期的抗寒性。CropSyst模型和STICS模型都通过设置参数分别反映叶片和穗部(收获指数)的敏感性差异,这些参数并没有通过固定的算法进行量化,每个生育时期和每个器官都需要人为调试,增加了模型应用的难度。WOFOST模型通过半致死温度反映不同时期、不同器官的低温敏感性。从模型参数可知,拔节期扬麦16和徐麦30的分别为-7.15℃和-8.32℃,而孕穗期扬麦16和徐麦30的分别为-4.17℃和-5.14℃,说明扬麦16较徐麦30对低温更加敏感,孕穗期小麦较拔节期对低温更加敏感。大部分作物模型中的低温胁迫效应算法都仅考虑了低温程度的影响,在处理不同持续时间上的低温效应时与低温强度是等效的。研究表明,相同低温强度下不同持续时间对小麦的损伤程度并不是等效的,一般来说小麦低温敏感性随着持续时间的增加逐渐减小[39-40]。因此,Barlow等[28]认为CERES-Wheat和CropSyst模型中的低温胁迫效应算法只适用于1到2次持续时间较短的低温事件。Vico等[40]认为需要构建一个加权的低温度日(weighted cooling degree days)作为指标来量化不同时期和不同持续时间下低温胁迫对小麦的影响。此外,冬小麦在不同时期低温胁迫以后并不能立即恢复到正常水平,而是需要一定的时间进行恢复,4套模型均未考虑低温胁迫后的恢复和补偿效应,这将成为未来模型低温算法改进的重点。综上所述,现有的低温胁迫效应算法在模拟拔节—孕穗期低温胁迫对小麦生长发育及产量形成影响上仍然存在一定的局限性,有待今后进一步的拓展和完善。
4 结论
拔节期和孕穗期低温胁迫明显降低了小麦叶面积指数、地上部生物量积累和籽粒产量。耦合了4种低温胁迫效应算法的WheatGrow模型在模拟叶面积指数动态上较原WheatGrow模型有所改善,但模拟误差仍然较大。CropSyst和STICS中的低温胁迫效应算法对地上部生物量积累和籽粒产量的预测能力要好于其他2种低温胁迫算法。4套算法由于没有考虑低温胁迫对茎秆的直接伤害、低温胁迫对干物质分配的影响以及低温胁迫后的恢复和补偿效应,因此在模拟茎生物量积累,以及模拟不同低温持续时间下的地上部生物量积累存在明显不足。本研究通过系统评估4种低温胁迫效应算法的模拟表现,明确了已有模型对低温胁迫响应的不足,为后续极端低温条件下的模型算法改进和完善提供了依据。
[1] IPCC. Managing the Risks of Extreme Events and Disasters to Advance Climate Change Adaptation. Cambridge, UK: Cambridge University Press, 2012.
[2] XIAO L, LIU L, ASSENG S, XIA Y, TANG L, LIU B, CAO W, ZHU Y. Estimating spring frost and its impact on yield across winter wheat in China. Agricultural and Forest Meteorology, 2018, 260/261: 154-164.
[3] 陈翔, 林涛, 林非非, 张妍, 苏慧, 胡燕美, 宋有洪, 魏凤珍, 李金才. 黄淮麦区小麦倒春寒危害机理及防控措施研究进展. 麦类作物学报, 2020, 40(2): 243-250.
CHEN X, LIN T, LIN F F, ZHANG Y, SU H, HU Y M, SONG Y H, WEI F Z, LI J C. Research progress on damage mechanism and prevention and control measures of late spring coldness of wheat in huanghuai region. Journal of Triticeae Crops, 2020, 40(2): 243-250. (in Chinese)
[4] WU Y, ZHONG X, HU X, REN D, LV G, WEI C, SONG J. Frost affects grain yield components in winter wheat. New Zealand Journal of Crop and Horticultural Science, 2014, 42(3): 194-204.
[5] MARTINO D, ABBATE P. Frost damage on grain number in wheat at different spike developmental stages and its modelling. European Journal of Agronomy, 2019, 103: 13-23.
[6] 刘蕾蕾, 纪洪亭, 刘兵, 马吉锋, 肖浏骏, 汤亮, 曹卫星, 朱艳. 拔节期和孕穗期低温处理对小麦叶片光合及叶绿素荧光特性的影响. 中国农业科学, 2018, 51(23): 4434-4448.
LIU L L, JI H T, LIU B, MA J F, XIAO L J, TANG L, CAO W X, ZHU Y. Effects of jointing and booting low temperature treatments onphotosynthetic and chlorophyll fluorescence characteristics in wheat leaf. Scientia Agricultura Sinica, 2018, 51(23): 4434-4448. (in Chinese)
[7] 武永峰, 胡新, 任德超, 史萍, 游松财. 晚霜冻胁迫后冬小麦株高降低及其与籽粒产量关系. 中国农业科学, 2018, 51(18): 3470-3485.
WU Y F, HU X, REN D C, SHI P, YOU S C. Reduction of plant height in winter wheat and its relationship with grain yield under late frost stress. Scientia Agricultura Sinica, 2018, 51(18): 3470-3485. (in Chinese)
[8] ZHENG B, CHENU K, FERNANDA DRECCER M, CHAPMAN S C. Breeding for the future: what are the potential impacts of future frost and heat events on sowing and flowering time requirements for Australian bread wheat () varieties? Global Change Biology, 2012, 18(9): 2899-2914.
[9] ZHENG B, CHAPMAN S C, CHRISTOPHER J T, FREDERIKS T M, CHENU K. Frost trends and their estimated impact on yield in the Australian wheatbelt. Journal of Experimental Botany, 2015, 66(12): 3611-3623.
[10] 郑冬晓, 杨晓光, 赵锦, 慕臣英, 龚宇. 气候变化背景下黄淮冬麦区冬季长寒型冻害时空变化特征. 生态学报, 2015, 35(13): 4338-4346.
ZHENG D X, YANG X G, ZHAO J, MU C Y, GONG Y. Spatial and temporal patterns of freezing injury during winter in Huang Huai winter wheat area under climate change. Acta Ecologica Sinica, 2015, 35(13): 4338-4346. (in Chinese)
[11] ASSENG S, MARTRE P, MAIORANO A, RöTTER R P, O’LEARY G J, FITZGERALD G J, GIROUSSE C, MOTZO R, GIUNTA F, BABAR M A. Climate change impact and adaptation for wheat protein. Global Change Biology, 2019, 25(1): 155-173.
[12] RÖTTER R, APPIAH M, FICHTLER E, KERSEBAUM K, TRNKA M, HOFFMANN M. Linking modelling and experimentation to better capture crop impacts of agroclimatic extremes-A review. Field Crops Research, 2018, 221: 142-156.
[13] WANG E, MARTRE P, ZHAO Z, EWERT F, MAIORANO A, RöTTER R P, KIMBALL B A, OTTMAN M J, WALL G W, WHITE J W, REYNOLDS M P, ALDERMAN P D, AGGARWAL P K, ANOTHAI J, BASSO B, BIERNATH C, CAMMARANO D, CHALLINOR A J, DE SANCTIS G, DOLTRA J, DUMONT B, FERERES E, GARCIA-VILA M, GAYLER S, HOOGENBOOM G, HUNT L A, IZAURRALDE R C, JABLOUN M, JONES C D, KERSEBAUM K C, KOEHLER A-K, LIU L, MüLLER C, NARESH KUMAR S, NENDEL C, O'LEARY G, OLESEN J E,
PALOSUO T, PRIESACK E, EYSHI REZAEI E, RIPOCHE D, RUANE A C, SEMENOV M A, SHCHERBAK I, STÖCKLE C, STRATONOVITCH P, STRECK T, SUPIT I, TAO F, THORBURN P, WAHA K, WALLACH D, WANG Z, WOLF J, ZHU Y, ASSENG S. The uncertainty of crop yield projections is reduced by improved temperature response functions. Nature Plants, 2017, 3: 17102.
[14] LIU B, LIU L, ASSENG S, ZOU X, LI J, CAO W, ZHU Y. Modelling the effects of heat stress on post-heading durations in wheat: A comparison of temperature response routines. Agricultural and Forest Meteorology, 2016, 222: 45-58.
[15] LECOMTE C, GIRAUD A, AUBERT V. Testing a predicting model for frost resistance of winter wheat under natural conditions. Agronomie, 2003, 23(1): 51-66.
[16] 陈曦, 杜克明, 魏湜, 孙忠富, 郑飞翔, 李晶, 顾万荣. 小麦霜冻害模拟模型研究进展. 麦类作物学报, 2015, 35(2): 285-291.
CHEN X, DU K M, WEI S, SUN Z F, ZHENG F X, LI J, GU W R. Advance on simulation modeling of frost and freezy injury in wheat. Journal of Triticeae Crops, 2015, 35(2): 285-291. (in Chinese)
[17] BERGJORD OLSEN A K, PERSSON T, DE WIT A, NKURUNZIZA L, SINDHøJ E, ECKERSTEN H. Estimating winter survival of winter wheat by simulations of plant frost tolerance. Journal of Agronomy and Crop Science, 2018, 204(1): 62-73.
[18] 马玉平, 王石立, 张黎. 针对华北小麦越冬的WOFOST模型改进. 中国农业气象, 2005, 26(3): 145-149.
MA Y P, WANG S L, ZHANG L. Study on improvement of WOFOST against overwinter of wheat in north China. Chinese Journal of Agrometeorology, 2005, 26(3): 145-149. (in Chinese)
[19] 张雪芬, 余卫东, 王春乙, 白凌霞. WOFOST模型在冬小麦晚霜冻害评估中的应用. 自然灾害学报, 2006(S1): 337-341.
Zhang X F, Yu W D, Wang C Y, Bai L X. Application of WOFOST model to assessment of winter wheat's chilling damage by late frost. Journal of Natural Disasters, 2006(S1): 337-341. (in Chinese)
[20] PERSSON T, BERGJORD OLSEN A K, NKURUNZIZA L, SINDHöJ E, ECKERSTEN H. Estimation of crown temperature of winter wheat and the effect on simulation of frost tolerance. Journal of Agronomy and Crop Science, 2017, 203(2): 161-176.
[21] SAVDIE I, WHITEWOOD R, RADDATZ R L, FOWLER D B. Potential for winter wheat production in western Canada: A CERES model winterkill risk assessment. Canadian Journal of Plant Science, 1991, 71(1): 21-30.
[22] STöCKLE C O. Temperature routines in CropSyst. Proceedings of the Workshop on Modeling Wheat Response to High Temperature. Mexico, International Maize and Wheat Improvement Center (CIMMYT), 2013: 47.
[23] BRISSON N, GARY C, JUSTES E, ROCHE R, MARY B, RIPOCHE D, ZIMMER D, SIERRA J, BERTUZZI P, BURGER P, BUSSIèRE F, CABIDOCHE Y M, CELLIER P, DEBAEKE P, GAUDILLèRE J P, HéNAULT C, MARAUX F, SEGUIN B, SINOQUET H. An overview of the crop model stics. European Journal of Agronomy, 2003, 18(3/4): 309-332.
[24] BEAUDOIN N, MARY B, LAUNAY M, BRISSON N, Conceptual basis, formalisations and parameterization of the STICS crop model. France: Quae Editions, 2009.
[25] KEATING B A, CARBERRY P S, HAMMER G L, PROBERT M E, ROBERTSON M J, HOLZWORTH D, HUTH N I, HARGREAVES J N, MEINKE H, HOCHMAN Z. An overview of APSIM, a model designed for farming systems simulation. European Journal of Agronomy, 2003, 18(3): 267-288.
[26] FLOHR B M, HUNT J R, KIRKEGAARD J A, EVANS J R. Water and temperature stress define the optimal flowering period for wheat in south-eastern Australia. Field Crops Research, 2017, 209: 108-119.
[27] BRACHO-MUJICA G, HAYMAN P T, OSTENDORF B. Modelling long-term risk profiles of wheat grain yield with limited climate data. Agricultural Systems, 2019, 173: 393-402.
[28] BARLOW K M, CHRISTY B P, O’LEARY G J, RIFFKIN P A, NUTTALL J G. Simulating the impact of extreme heat and frost events on wheat crop production: A review. Field Crops Research, 2015, 171: 109-119.
[29] LUO Q. Temperature thresholds and crop production: a review. Climatic Change, 2011, 109(3/4): 583-598.
[30] JONES J W, HOOGENBOOM G, PORTER C H, BOOTE K J, BATCHELOR W D, HUNT L A, WILKENS P W, SINGH U, GIJSMAN A J, RITCHIE J T. The DSSAT cropping system model. European Journal of Agronomy, 2003, 18(3/4): 235-265.
[31] RITCHIE J. Description and performance of CERES wheat: A user-oriented wheat yield model. ARS Wheat Yield Project, US Department of Agriculture, Agricultural Research Service, 1985, 38: 159-175.
[32] STöCKLE C O, DONATELLI M, NELSON R. CropSyst, a cropping systems simulation model. European Journal of Agronomy, 2003, 18(3/4): 289-307.
[33] DE WIT A, BOOGAARD H, FUMAGALLI D, JANSSEN S, KNAPEN R, VAN KRAALINGEN D, SUPIT I, VAN DER WIJNGAART R, VAN DIEPEN K. 25 years of the WOFOSTcropping systems model. Agricultural Systems, 2019, 168: 154-167.
[34] 陈振林, 张建平, 王春乙, 郑江平. 应用WOFOST模型模拟低温与干旱对玉米产量的综合影响. 中国农业气象, 2007, 28(4): 440-442, 445.
CHEN Z L, ZHANG J P, WANG C Y, ZHENG J P. Application of WOFOST model in simulation of integrated impacts of low temperature and drought on maize yield. Chinese Journal of Agrometeorology, 2007, 28(4): 440-442, 445. (in Chinese)
[35] BRISSON N, RUGET F, GATE P, LORGEOU J, NICOULLAUD B, TAYOT X, PLENET D, JEUFFROY M-H, BOUTHIER A, RIPOCHE D, MARY B, JUSTES E. STICS: a generic model for simulating crops and their water and nitrogen balances. II. Model validation for wheat and maize. Agronomie, 2002, 22 (1): 69-92.
[36] WILLMOTT C J, ACKLESON S G, DAVIS R E, FEDDEMA J J, KLINK K M, LEGATES D R, O'DONNELL J, ROWE C M. Statistics for the evaluation and comparison of models. Journal of Geophysical Research: Oceans, 1985, 90: 8995-9005.
[37] BELLOCCHI G, RIVINGTON M, DONATELLI M, MATTHEWS K. Validation of biophysical models: issues and methodologies. A review. Agronomy for Sustainable Development, 2010, 30(1): 109-130.
[38] 李军玲, 余卫东, 张弘, 郭其乐. 冬小麦越冬中期冻害高光谱敏感指数研究. 中国农业气象, 2014, 35(6): 708-716.
LI J L, YU W D, ZHANG H, GUO Q L. Study on hyperspectral sensitivity index of winter wheat after freezing injury at mid-winter period. Chinese Journal of Agrometeorology, 2014, 35(6): 708-716. (in Chinese)
[39] ZHENG D, YANG X, MíNGUEZ M I, MU C, HE Q, WU X. Effect of freezing temperature and duration on winter survival and grain yield of winter wheat. Agricultural and Forest Meteorology, 2018, 260/261: 1-8.
[40] VICO G, HURRY V, WEIH M. Snowed in for survival: Quantifying the risk of winter damage to overwintering field crops in northern temperate latitudes. Agricultural and Forest Meteorology, 2014, 197: 65-75.
Testing the Responses of Low Temperature Stress Routine to Low Temperature Stress at Jointing and Booting in Wheat
XIAO LiuJun, LIU LeiLei, QIU XiaoLei, TANG Liang, CAO WeiXing, ZHU Yan, LIU Bing
College of Agriculture, Nanjing Agricultural University/National Engineering and Technology Center for Information Agriculture/ Engineering Research Center of Smart Agriculture, Ministry of Education/ Key Laboratory for Crop System Analysis and Decision Making, Ministry of Agriculture and Rural Affairs/Jiangsu Key Laboratory for Information Agriculture/Jiangsu Collaborative Innovation Center for Modern Crop Production, Nanjing 210095
【】Crop growth model is an essential approach for predicting and evaluating crop productivity under climate change. This study was conducted to clearly demonstrate the shortcomings of the existing models under low temperature stress, and provide instructions to improve the algorithms for simulating effects of low temperature stress on wheat productivity.【】The low temperature stress response routines from four famous wheat models, including CERES-Wheat from Michigan State University, CropSyst from Washington State University, WOFOST from Wageningen University in the Netherlands, and STICS from INRA in France, were integrated into the WheatGrow model. And then, the WheatGrow model was used to test and evaluate the responses of low temperatures stress routines in simulating effects of low temperature stress at jointing and booting stages on wheat leaf area index, stem biomass, aboveground biomass and grain yield, with detailed observed datasets from environment-controlled phytotron experiments under different temperature levels (lowest to -6℃) and durations (2 days, 4 days and 6 days) of low temperature stress at Nanjing (2012-2013) and Rugao (2013-2015) with two wheat cultivars (Yangmai16 and Xumai30).【】 The results showed that leaf area index, aboveground biomass, and grain yield were decreased significantly under low temperature stress during jointing and booting stages, and the reductions increased with the increasing duration of low temperature stress and the decreasing low temperature level. Wheat growth and grain yield were more sensitive to low temperature stress at booting than at jointing, and Yangmai16 were more sensitive to low temperature stress than Xumai30. The integration of four low-temperature stress algorithms improved the performance of the original WheatGrow model in simulating the dynamics of leaf area index, but the simulation errors were still large, and the simulation errors were larger under low temperature stress at booting stage than at jointing stage. All four low temperature stress routines underestimated the negative effects of low temperature stress on the accumulation of stem and aboveground biomass. Comparing the overall performance of the four low temperature stress routines, the low temperature stress routine from CropSyst model performed best in simulating the dynamics of leaf area index and aboveground biomass. For the simulation of stem biomass dynamic, the low temperature stress algorithm from the WOFOST model performed best among the four routines, especially under low temperature stress at booting. The low temperature stress algorithm from STICS is the best routine in the simulation of grain yield under low temperature stress, followed by CropSyst model. 【】The integrated models with four low temperature stress algorithms were better than the original WheatGrow model in predicting aboveground biomass, stem biomass, leaf area index and grain yield, and the simulation error under weak low temperature conditions was smaller than that under strong low temperature conditions. However, there were large uncertainties in simulating the accumulation of stem biomass and simulating above-ground biomass under different durations of low temperature stress from all four low temperature algorithms, because none of the four low temperature stress routines considered the damagingeffects of low temperature stress on stem biomass, dry matter partitioning, and the recovery and compensation effects after low temperature stress. As many parameters were introduced in the four low temperature stress algorithms, it was difficult for conducting model parameterization with existing algorithms, and this should be avoided in future model improvement. Our results were critical for improving the simulation of wheat growth and yield for wheat crop models under low temperature stress, and reducing the uncertainty in predicting crop productivity under climate change.
wheat; low temperature stress; crop growth model; algorithm comparison; model evaluation; WheatGrow model

10.3864/j.issn.0578-1752.2021.03.005
2020-04-23;
2020-10-12
国家重点研发计划(2019YFA0607404)、国家杰出青年科学基金(31725020)、国家自然科学基金(32021004,41961124008,31872848,31301234)
肖浏骏,E-mail:liujunxiao@zju.edu.cn。通信作者刘兵,E-mail:bingliu@njau.edu.cn
(责任编辑 杨鑫浩)
