乳清分离蛋白-葡聚糖糖基化条件优化及抗氧化活性
2021-03-09傅锡鹏朱秀灵戴清源洪青源张伟伟邱小晴丁雅瑞
傅锡鹏,朱秀灵,戴清源*,洪青源,张伟伟,陈 锦,邱小晴,丁雅瑞
(1.安徽工程大学 生物与食品工程学院,安徽 芜湖 241000;2.微生物发酵安徽省工程研究中心,安徽 芜湖 241000)
乳清分离蛋白是奶酪制作的副产品,主要由β-乳球蛋白和α-乳清蛋白组成,具有良好的发泡性、胶凝性和保水性等功能特性,因此常被作为天然食品成分用于食品加工。但由于天然乳清分离蛋白在酸性条件下尤其在等电点附近时溶解度低,对环境pH值及热处理条件高度敏感,限制了其在食品、医药、化妆品等领域的广泛应用。
通过物理、化学和酶法处理均可改善蛋白质的功能特性,但其中的一些方法需要使用有毒的化学试剂,这将导致此类方法改性的蛋白质不能用作食品的原料。近年来报道较多的一种简便、有效、天然、无毒的改善蛋白质功能特性的方法是糖基化反应,它是基于蛋白质的氨基与糖的还原端羰基发生的美拉德反应。根据反应体系状态的不同,糖基化反应分为干热糖基化和湿热糖基化。干热糖基化经常发生在干燥状态的物料体系中,需要控制反应条件,并且反应时间较长,但由于反应效率较高,常被用于改善蛋白质的功能特性。湿热糖基化是在溶液状态下发生的,反应时间短,但在较高温度下蛋白质会变性聚集,且溶液状态会增加运输成本。与单糖或双糖相比,蛋白质与多糖形成的糖基化产物可显著改善蛋白质的物理和化学性质,如热稳定性、乳化性和抗氧化性,例如β-乳球蛋白与葡聚糖在60 ℃水分活度0.44条件下进行糖基化反应能够显著提高蛋白质的溶解度和热稳定性。利用多糖(如葡聚糖、壳聚糖或半乳甘露聚糖)改善蛋白质(如卵清蛋白、溶菌酶、大豆蛋白和乳清蛋白)的功能特性已有大量文献报道,其中大多数集中在蛋白质的热稳定性和乳液稳定性。
利用糖基化反应改善乳清分离蛋白的抗氧化活性的研究亦有相关报道。Wang等研究发现乳清分离蛋白与木糖、葡萄糖、果糖等的糖基化产物均具有较高的抗氧化活性。美拉德反应产物的抗氧化能力除了来自最终产物类黑精外,中间产物、杂环化合物及还原酮等物质也具有一定的抗氧化活性。美拉德反应的进程、产物的结构及功能性质受许多因素的影响,除了糖和氨基化合物的种类、浓度外,反应温度、时间、pH、相对湿度对其也有重要的影响。常用的抗氧化活性测定方法主要有DPPH(1,1-Diphenyl-2-Picrylhydrazyl)自由基清除能力、ABTS(2,2'-Azinobis-(3-Ethylbenzothiazoline-6-Sulfonic Acid))自由基清除能力、还原能力等,测定方法不同其结果会有较大差异,因此,需要用不同的方法多角度地评价糖基化产物的抗氧化活性。已有文献报道,糖基化反应可提高乳清分离蛋白的抗氧化性能,有效清除自由基,达到抗衰老作用,也能对延缓心脑血管组织的老化发挥一定的作用,在食品、医药等领域有着巨大的开发利用前景。
基于此,研究以乳清分离蛋白和葡聚糖为原料,采用干热糖基化反应制备糖基化蛋白,通过单因素试验探讨蛋糖比、反应温度、反应时间和相对湿度对糖基化反应的影响。在此基础上,通过响应面试验优化糖基化反应条件,并对糖基化产物的pH稳定性、热稳定性以及抗氧化活性进行研究,为乳清分离蛋白及其他可食用蛋白的绿色改性和合理利用提供有益参考。
1 材料与方法
1.1 实验材料
乳清分离蛋白(Wheyproteinisolate,WPI),购于上海江莱生物科技有限公司;邻苯二甲醛(Ortho-phthalaldehyde,OPA),购于上海瑞永生物科技有限公司;β-巯基乙醇,购于麦克林生化科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-Picrylhydrazyl,DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-Azinobis-(3-Ethylbenzothiazoline-6-Sulfonic Acid),ABTS),购于阿拉丁试剂(上海)有限公司;葡聚糖(Dextran,Dex;其分子量为40 kDa)及其他常规试剂,均购于国药集团化学试剂有限公司。
1.2 主要设备
FD-1A-50+型真空冷冻干燥机(北京博医康实验仪器有限公司);DHG-9070型烘箱(成都晟杰科技有限公司);UV-5800PC型分光光度计(上海仪电分析仪器有限公司)。
1.3 试验方法
(1)乳清分离蛋白-葡聚糖糖基化反应。参照文献[15]方法并稍作修改:将乳清分离蛋白和葡聚糖按照一定质量比混合并溶于超纯水中,使乳清分离蛋白的质量浓度控制在40 mg/mL,磁力搅拌2 h,然后真空冷冻干燥得到冻干粉。再将冻干粉分别放入底部盛有能维持体系一定湿度的饱和盐溶液的干燥器中,把干燥器置于干燥箱中预热,以使糖基化反应保持在相对湿度和反应温度相对稳定的状态。通过控制乳清分离蛋白与葡聚糖的质量比(蛋糖比)、反应温度和反应时间,分别得到不同接枝度的糖基化产物。
(2)单因素试验。以接枝度为指标,研究蛋糖比为3∶1、2∶1、1∶1、1∶2和1∶3 g/g(反应温度80 ℃,反应时间48 h,相对湿度75%),反应温度为60 ℃、70 ℃、80 ℃、90 ℃和100 ℃(蛋糖比1∶2 g/g,反应时间48 h,相对湿度75%),反应时间为24 h、48 h、72 h、96 h和120 h(蛋糖比1∶2 g/g,反应温度80 ℃,相对湿度75%),相对湿度为干燥状态、25%、50%、75%、100%(蛋糖比1∶2 g/g,反应温度80 ℃,反应时间72 h)对乳清分离蛋白-葡聚糖糖基化反应的影响。其中,体系相对湿度分别采用饱和的氯化镁、溴化钠和氯化钠溶液以及超纯水,置于干燥器中密封,以控制体系相对湿度分别为25%、50%、75%、100%,以PO代替饱和盐溶液以控制干燥器为极低相对湿度即干燥状态。
(3)响应面试验。在单因素试验的基础上,根据中心组合试验设计原理,选择蛋糖比、反应温度、反应时间和相对湿度4个因素,各设置3个水平,以接枝度为响应值,利用Design-Expert 8.0.6软件进行响应面试验设计并优化制备条件。响应面试验设计因素水平如表1所示。
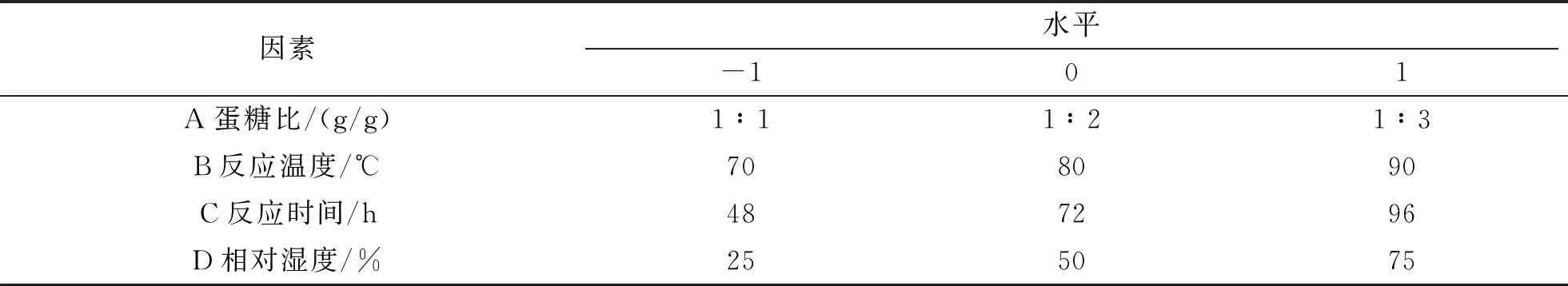
表1 Box-Behnken试验因素及水平
(4)接枝度测定。接枝度的测定采用邻苯二甲醛(OPA)法,精确称取40 mg OPA溶解于1 mL甲醇中,分别加入2.5 mL(20% w/w)十二烷基硫酸钠溶液、25 mL(0.1 mol/L)硼砂溶液和100 μL β-巯基乙醇,混匀后加入去离子水定容至50 mL,得到OPA溶剂(现用现配)。分别移取4 mL OPA溶液加入到200 μL稀释至适当浓度的样品溶液中,混匀后于35 ℃水浴保温2 min,以去离子水作为空白对照,用紫外分光光度计于340 nm处测定吸光度值。以赖氨酸为标准,获得自由氨基摩尔浓度与吸光度值之间的线性回归曲线(A
=0.
459 9C
+0.
094 5,R
=0.
999 5,线性范围为0.17~1.71 mmol/L)。按式(1)计算糖基化产物的接枝度(Degree Ofgrafting,DG)。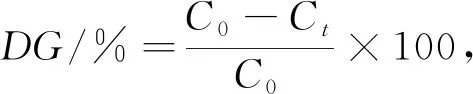
(1)
式中,DG
为接枝度(%);C
为未进行糖基化反应样品溶液中自由氨基基团的毫摩尔浓度(mmol/L);C
为反应t
时糖基化样品溶液中自由氨基基团的毫摩尔浓度(mmol/L)。(5)溶解度测定。蛋白质及其糖基化产物的溶解度采用考马斯亮蓝G250染色法测定,以牛血清白蛋白为标准品,测定波长为595 nm,得到吸光度(Y
)与牛血清白蛋白浓度(X
)之间的标准曲线Y
=0.
150 8X
-0.
002 2(R
=0.
999 2),线性范围为0~1 mg/mL。将待测样品分别溶解于去离子水中并调整蛋白质浓度为2 mg/mL,用0.1 mol/L HCl或0.1 mol/L NaOH溶液分别调节溶液pH为2.0、3.0、4.0、4.8、5.0、5.2、6.0、7.0、8.0、9.0、10.0,再补加去离子水使蛋白质浓度为0.2 mg/mL,室温磁力搅拌30 min,离心(8 000 r/min,30 min),分别移取1 mL上清液置于不同的试管中,各加入5 mL考马斯亮蓝G250溶液并混匀,静置2 min后于595 nm波长下测定吸光度值。根据标准曲线计算上清液中蛋白质的浓度(C
),根据式(2)计算待测样品中蛋白质的溶解度(S
)。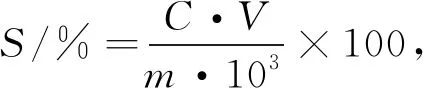
(2)
式中,S
为待测样品中蛋白质的溶解度(%);C
为通过上清液中蛋白质的质量浓度(mg/mL);V
为上清液的体积(mL);m
为待测样品中蛋白质的质量(g);10为质量单位换算数值。(6)稳定性测定。参照文献[20]采用浊度法测定乳清分离蛋白及其糖基化产物的热稳定性和pH稳定性。分别称取一定质量的待测样品,加入适量去离子水在磁力搅拌下溶解1 h,分别采用1 mol/L HCl或NaOH溶液调节pH为2.0、3.0、4.0、4.8、5.0、5.2、6.0、7.0、8.0、9.0、10.0,用去离子水调整蛋白质浓度为2 mg/mL,分别于室温和85 ℃处理15 min,再利用紫外可见分光光度计测定溶液在633 nm波长处的吸光度值,以去离子水为空白对照。
(7)DPPH自由基清除能力测定。参照文献[21-22]方法并修改如下:量取1 mL(0.1 mmol/L)DPPH(体积分数95%乙醇溶解)溶液加入到3.0 mL(1 mg/mL)待测样品中,混匀,室温暗处静置30 min,离心(4 000 r/min,10 min),取上清液于517 nm处测定吸光度值,以体积分数95%乙醇代替DPPH的样品溶液为对照品,以体积分数95%乙醇代替样品溶液作为空白,DPPH自由基清除率以式(3)计算。
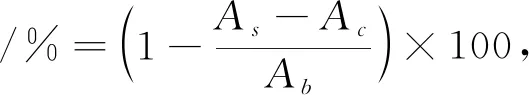
(3)
式中,A
为样品溶液的吸光度值;A
为对照品溶液的吸光度值;A
为空白溶液的吸光度值。(8)ABTS自由基清除能力测定。参照文献[23]测定ABTS自由基清除能力。向ABTS溶液(7.4 mmol/L)中加入过硫酸钾溶液2.6 mmol/L,并将混合物在黑暗中储存18 h来形成ABTS储备溶液。用10 mmol/L磷酸盐缓冲液(pH 7.4)稀释ABTS储备溶液,直至其在734 nm处吸光度值为0.7±0.2。然后,将样品与ABTS稀释液以1∶19(v/v)比例混合;在空白对照中加入去离子水来代替样品。将混合物离心(4 000 r/min,10 min)以除去不溶性蛋白质,并测量混合物在734 nm波长处的吸光度值。ABTS自由基清除率采用式(4)计算。

(4)
(9)还原能力测定。还原能力测定采用文献[3]方法:1 mL样品(蛋白质含量为2 mg/mL)与1.0 mL 0.2 mol/L磷酸钠缓冲液(pH 6.6)和1.0 mL质量分数为1%铁氰化钾溶液混合,50 ℃水浴保温20 min,冷却至室温后加入1.0 mL质量分数为10%三氯乙酸溶液,混匀,离心(4 000 r/min,10 min),移取上清液2 mL,加入2.0 mL去离子水及0.4 mL质量分数为0.1%FeCl溶液,混匀,于700 nm波长处测定溶液的吸光度值(以去离子水作为空白溶液)。结果以3次重复实验的平均值表示。
1.4 数据处理
实验重复3次,结果以平均值±标准偏差表示。采用Origin 2018绘制折线图及柱形图,采用Design Expert 8.0.5软件进行响应面分析和响应面图绘制,采用IBM SPSS Statistics Version 20软件对数据进行相关性和差异显著性分析,P
<0.
05表示差异显著。2 结果与分析
2.1 单因素试验
(1)蛋糖比对糖基化反应的影响。蛋糖比即乳清分离蛋白与葡聚糖质量比,其对糖基化反应的影响如图1所示。由图1可知,在乳清分离蛋白和葡聚糖的混合体系中,随着葡聚糖所占比例的增加,接枝度逐渐增加,当蛋糖比为1∶2 g/g时,糖基化产物接枝度达到最大值(20.14%)。但随着葡聚糖所占比例进一步增加,接枝度反而下降。这可能是由于体系中多糖所占比例的增加提高了蛋白质与多糖分子的碰撞机会,进而提高了糖基化反应的速率和接枝效果;但是随着体系中葡聚糖所占比例的继续增加,蛋白质和葡聚糖的空间位阻作用也随之增强,当乳清分离蛋白与葡聚糖质量比小于1∶2 g/g时,分子流动性降低,空间位阻作用阻碍了乳清分离蛋白和葡聚糖的相互接触。因此,乳清分离蛋白与葡聚糖的质量比以1∶2 g/g为宜。
(2)反应温度对糖基化反应的影响。反应温度对糖基化产物接枝度的影响如图2所示。由图2可以看出,反应温度对糖基化反应有显著性影响(P
<0.
05),接枝度的大小与温度的高低正相关,温度升高,接枝度增加。这主要是由于较高的温度能够加速分子运动,增大蛋白质和多糖分子之间的碰撞概率,有助于糖基化反应。此外,在一定温度范围内,随着温度的升高,蛋白质分子结构打开,蛋白质分子内部的自由氨基暴露出来,易与葡聚糖的羰基发生糖基化反应,使接枝度增加。由图2还可以看出,在60~70 ℃之间,接枝度增加速度最快,随后接枝度也显著增加但增幅减缓,可能是由于蛋白质分子上共价结合的糖链增长,空间位阻效应使糖基化反应受到限制。当温度高于90 ℃,接枝度增加不显著。此外,在较高温度下,糖基化反应的能耗增大,还可能导致某些特殊的色素物质产生。综合考虑,反应温度以70~90 ℃为宜。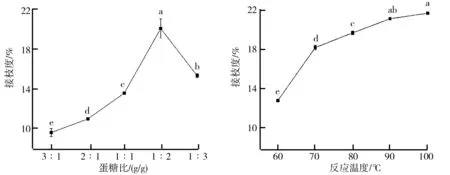
图1 乳清分离蛋白与葡聚糖质量比对糖基化产物接枝度的影响 图2 反应温度对糖基化产物接枝度的影响图1注:不同字母表示差异显著(P<0.05),下图同。
(3)反应时间对糖基化反应的影响。在一定温度下,反应时间是影响糖基化反应的重要因素之一。反应时间对糖基化产物接枝度的影响如图3所示。由图3可知,在反应的起始阶段(24~48 h),糖基化产物接枝度随着反应时间的延长而显著性增加(P
<0.
05);当反应时间在48~72 h内,接枝度显著性增加但增幅减缓;当反应时间超过72 h后,接枝度增加不显著,这与文献[27-28]报道基本一致。这可能是由于反应起始阶段乳清分离蛋白分子含量较高,糖基化蛋白接枝度增加迅速;随着糖基化反应持续进行,未反应的乳清分离蛋白含量降低,反应速度降低,当可获得的自由氨基基本反应完全后,其接枝度将不再增加;此外,反应时间超过某一限定值时,还可能导致某些特殊的色素物质产生,因此,反应时间以72 h为宜。(4)相对湿度对糖基化反应的影响。相对湿度对糖基化反应的影响如图4所示。由图4可以看出,在干燥状态即相对湿度较低的条件下,乳清分离蛋白与葡聚糖糖基化产物的接枝度较低(13.86%±0.01%);与干燥状态相比,在相对湿度25%~100%时,接枝度均显著增加;当相对湿度为25%~100%时,接枝度变化差异不显著。其原因可能是在干燥状态下体系的相对湿度较低,蛋白质具有相对静止的结构,多肽链移动受限。随着相对湿度的不断增加,水分含量不断增多,通过水合作用和穿透作用可以使蛋白质溶胀结构膨松,蛋白质多肽链的移动性和柔性增强,促进乳清分离蛋白与葡聚糖之间的相互作用,从而使接枝度增加。但相对湿度进一步增加,也会使多肽链移动过快不利于糖基化反应,从而使接枝度不再提高。由图4还可以得知,保持体系处于一定的相对湿度状态,有助于促进乳清分离蛋白和葡聚糖之间的糖基化接枝反应,增大或减少相对湿度(干燥状态除外)对糖基化接枝反应不会产生显著性影响。综合考虑,相对湿度以25%~75%为宜。
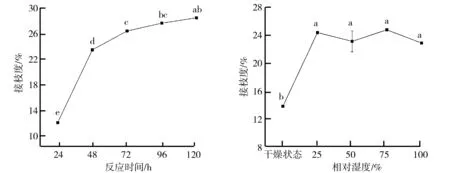
图3 反应时间对糖基化产物接枝度的影响 图4 相对湿度对糖基化产物接枝度的影响图4注:以P2O5代替饱和盐溶液控制极低相对湿度即干燥状态;以氯化镁、溴化钠、氯化钠的饱和盐溶液以及超纯水控制体系相对湿度分别为25%、50%、75%和100%。
2.2 响应面试验与设计
(1)回归模型的建立及分析。在单因素试验的基础上,选取蛋糖比、反应时间、反应温度、相对湿度4个因素进行Box-Behnken试验设计,结果如表2和表3所示。采用Design Expert 8.0.5软件对表2中的数据进行二次回归拟合分析,得到回归模型如下:
Y
(%)=22.
59-0.
76A
+2.
89B
+3.
29C
-0.
38D
+0.
15AB
-0.
22AD
+0.
34BC
-0.
24BD
+2.
09CD
-0.
50A
-1.
63B
-0.
34C
+0.
96D
。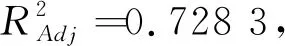
(2)响应面图的分析与优化。采用Design Expert 8.0.5软件对表2中的数据进行解析,可得到乳清分离蛋白和葡聚糖糖基化反应的响应面图如图5所示。由图5a可知,在反应时间和相对湿度不变时,随着蛋糖比中葡聚糖含量增加和反应温度升高,接枝度逐渐增大至最大值24.07%;由图5b可以看出,在反应温度和相对湿度相对恒定情况下,随着蛋糖比中葡聚糖含量增加和反应时间延长,接枝度逐渐增大并达到最大值25.67%;由图5c得知,当其他反应条件不变并维持体系相对湿度在同一水平时,随着蛋糖比中葡聚糖含量增加,接枝度逐渐增大并达到最大值,然后再逐渐降低;当其他反应条件不变并且蛋糖比中葡聚糖含量相同时,随着相对湿度增大,接枝度先逐渐降低而后逐渐增加;图5d表明升高反应温度和延长反应时间(其他反应条件不变)能够提高乳清分离蛋白和葡聚糖糖基化产物的接枝度;图5e说明在其他反应条件不变且反应时间达到某一值时,增大相对湿度,接枝度增加;同样地,相对湿度恒定不变,随着反应时间的延长,接枝度也增大。由此说明各因素交互作用对接枝度具有不同程度的影响。
在此基础上,通过Design-Expert 8.0.5软件对回归方程求极值,得出A
=0.
93,B
=88.
72,C
=72,D
=75,在此条件下乳清分离蛋白与葡聚糖糖基化产物的接枝度的理论值能达到29.94%。为验证响应面优化结果的可靠性,兼顾实际操作可行性,将最佳反应条件修正为蛋糖比1∶1.05(g/g),反应温度85 ℃,反应时间72 h,相对湿度75%,在此条件下重复实验3次,实际测得的接枝度平均值为26.34%±0.38%,达到预测值的87.98%,进一步验证了该理论模型的可行性。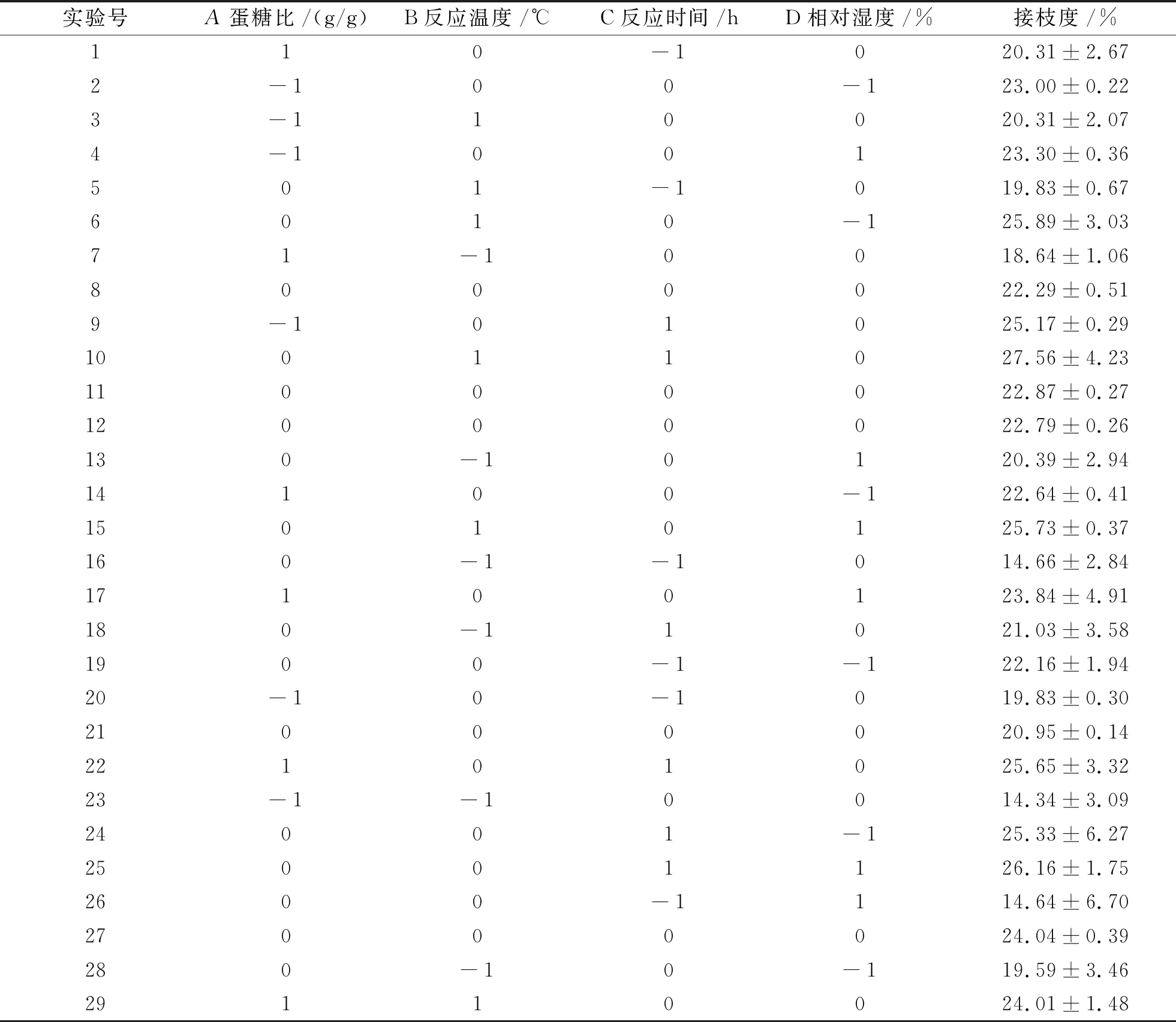
表2 Box-Behnken试验设计及结果
2.3 乳清分离蛋白及其糖基化产物的溶解度
乳清分离蛋白及其糖基化产物在pH 2.0~10.0范围内的溶解度如图6所示。由图6可以看出,蛋白质及其糖基化产物的溶解度随着pH值的变化而有不同程度的变化,在pH 2.0~10.0范围内时,乳清分离蛋白的溶解度最小,其中以pH 4.8时溶解度最小,为32.99%±2.58%;与乳清分离蛋白相比,糖基化产物的溶解度均较高,在pH 4.8附近时,其溶解度增加更为明显,并且随着糖基化反应时间延长而逐渐增大;在反应0 h、24 h、48 h和72 h时,糖基化产物的溶解度分别为50.58%±5.31%(pH 4.8)、79.76%±1.55%(pH 4.8)、87.62%±2.82%(pH 5.2)、90.10%±0.94%(pH 5.0),分别是pH 4.8时乳清分离蛋白溶解度的1.53、2.42、2.66和2.73倍。冯玉超等研究发现芸豆蛋白及其糖基化蛋白的溶解度均呈先下降后上升的趋势,在等电点附近时,糖基化蛋白的溶解度约为芸豆蛋白自身溶解度的两倍,本研究与此报道一致。乳清分离蛋白的等电点在pH 5.0附近,当溶液的pH与蛋白质的等电点接近时,蛋白质的溶解度就会显著降低,将多糖链通过糖基化反应共价接枝到蛋白质分子上,亲水性多糖侧链增加了蛋白质的亲水性,所以乳清分离蛋白与葡聚糖的糖基化产物在等电点附近的溶解度高于乳清分离蛋白。此外,乳清分离蛋白与葡聚糖分子通过糖基化反应形成共价接枝物,由于葡聚糖分子空间大且亲水性强,其空间位阻效应使蛋白质分子无法聚集,在一定程度上提高了乳清分离蛋白的溶解性。
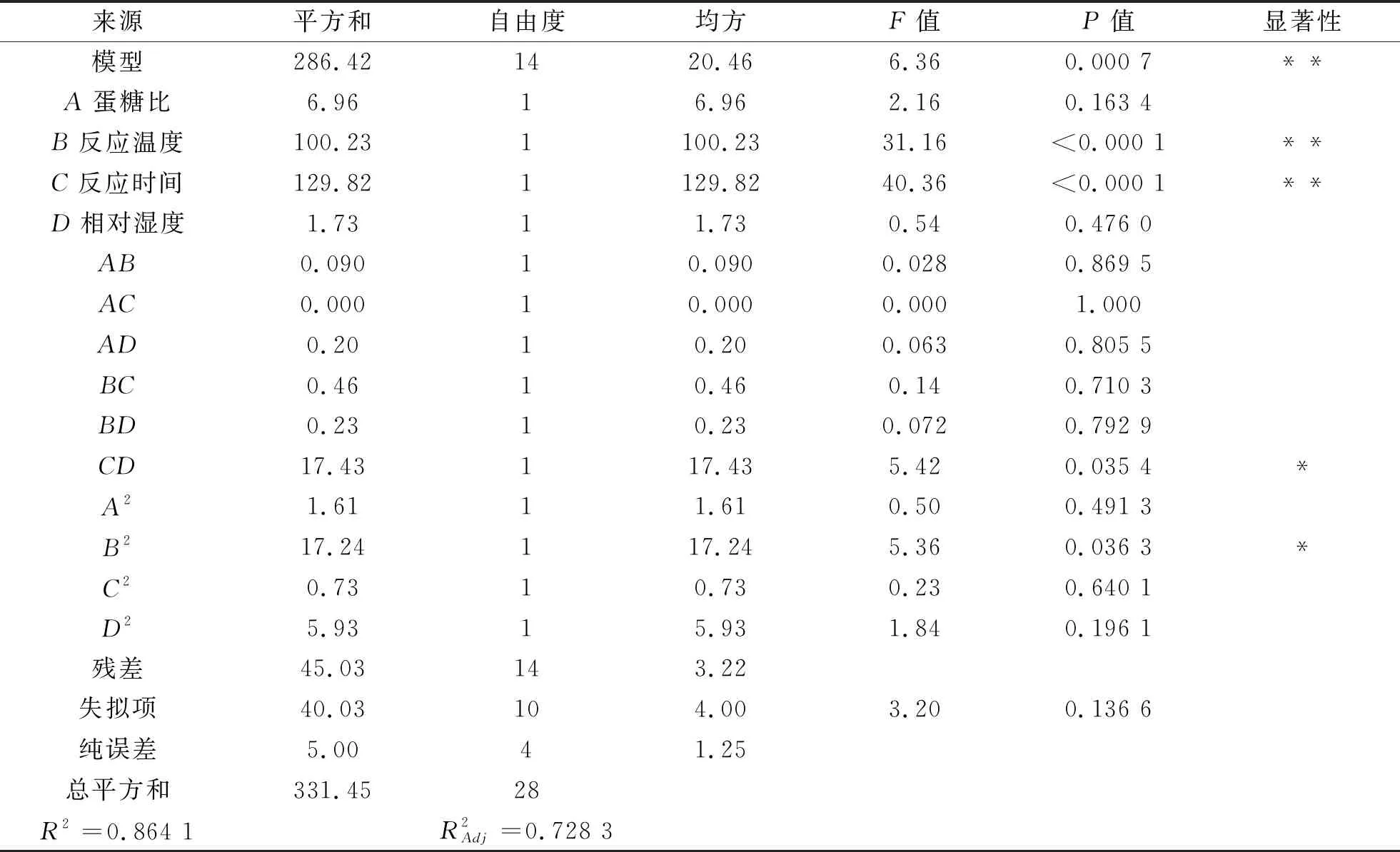
表3 方差分析表
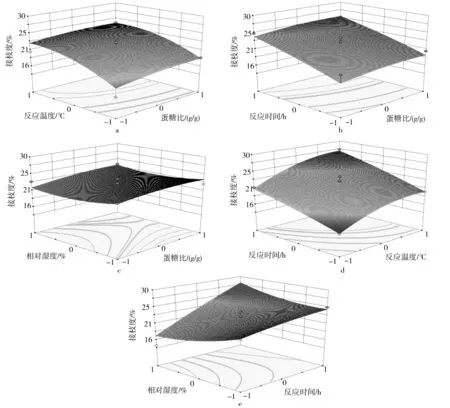
图5 因素交互作用对接枝度的影响注:各因素水平以编码值表示,接枝度(%)以实际测定结果表示。
2.4 乳清分离蛋白及其糖基化产物的稳定性
乳清分离蛋白及其糖基化产物的体系稳定性在外观上表现为溶液是否存在聚集状态,这种状态可以通过测定溶液的浊度来判断,浊度越大说明体系越不稳定,浊度越小说明体系越稳定。乳清分离蛋白及其糖基化产物25 ℃和85 ℃时在不同pH条件下的稳定性如图7所示。由图7可以看出,在pH 2.0~4.0和pH 6.0~10.0范围内,溶液浊度较低且稳定,而在pH 4.0~6.0范围内,溶液浊度因乳清分离蛋白糖基化反应时间不同而有较大差异,尤其在pH 5.0附近;与相同温度下不同糖基化产物相比,乳清分离蛋白溶液的浊度最大,其体系最不稳定;其次,反应时间越短的糖基化产物,其浊度越高,且温度越高浊度越大。由图7可知,乳清分离蛋白及其糖基化产物在较高温度下不稳定,与乳清分离蛋白相比,糖基化产物在pH 2.0~10.0范围内均表现良好的pH稳定性和热稳定性,且糖基化反应时间越长,得到的糖基化产物的pH稳定性和热稳定性均越高。
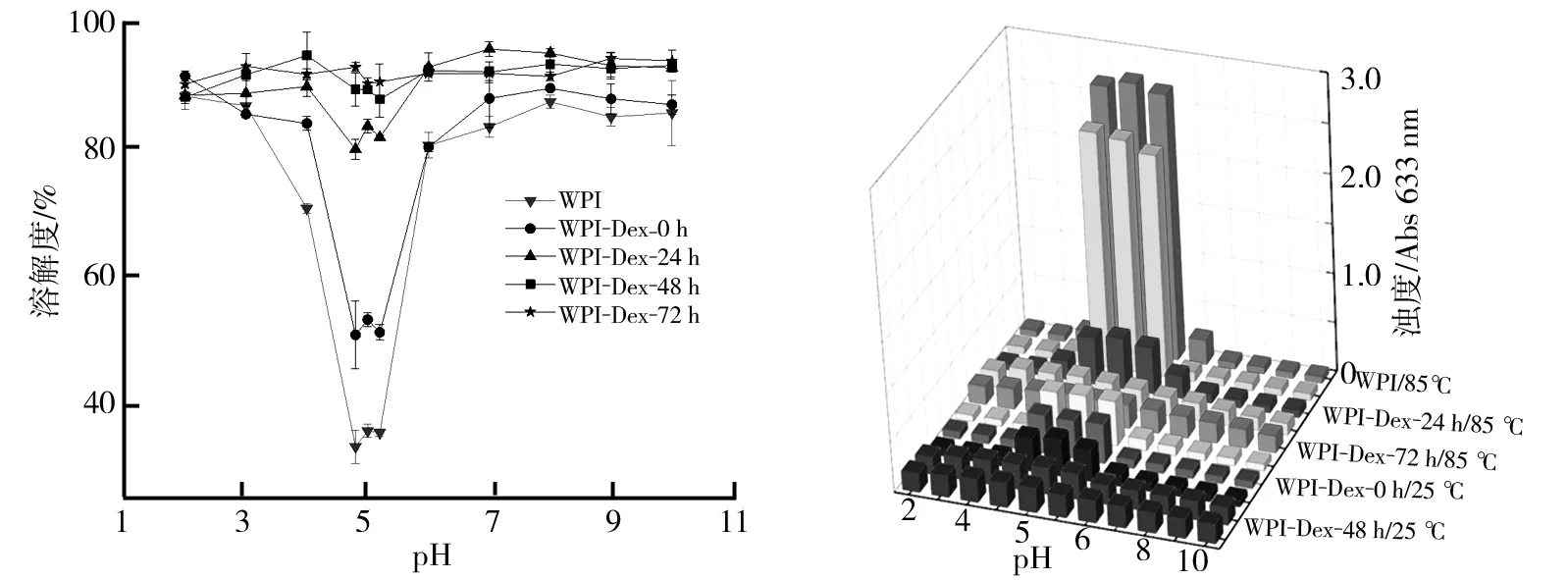
图6 乳清分离蛋白及其糖基化产物的溶解度 图7 乳清分离蛋白及其糖基化产物25 ℃和85 ℃时在不同pH条件下的稳定性图6注:WPI:乳清分离蛋白;WPI-Dex-0 h、WPI-Dex-24 h、WPI-Dex-48 h、WPI-Dex-72 h分别为乳清分离蛋白与葡聚糖糖基化反应0 h、24 h、48 h和72 h时的糖基化产物。图7注:WPI-Dex-0 h、WPI-Dex-24 h、WPI-Dex-48 h、WPI-Dex-72 h分别为乳清分离蛋白与葡聚糖糖基化反应0 h、24 h、48 h和72 h时的产物。
2.5 DPPH自由基和ABTS自由基的清除能力
乳清分离蛋白与葡聚糖在不同反应时间的糖基化产物对DPPH自由基和ABTS自由基的清除能力如图8所示。由图8可以看出,糖基化产物清除ABTS阳离子自由基能力的变化趋势与其清除DPPH自由基的变化趋势相似,这是由于ABTS阳离子自由基清除能力和DPPH自由基清除能力都反映了样品的供氢能力。由图8还可以看出,所有测试样品均具有一定的清除DPPH自由基和ABTS自由基的能力,清除率由低到高依次为WPI-Dex-0 h、WPI-Dex-24 h、WPI-Dex-48 h、WPI-Dex-72 h,由此得知DPPH自由基和ABTS自由基的清除能力与糖基化反应时间有关,且随着糖基化反应时间延长(在其他条件相同的情况下)而显著性增加(P
<0.
05);当反应时间由24 h增加至48 h时,糖基化产物对DPPH和ABTS自由基清除率的变化幅度最大,但进一步延长反应时间,自由基清除率增幅趋缓。已有大量研究表明蛋白质与糖分子反应生成的美拉德反应产物可作为氢供体与DPPH自由基形成稳定的DPPH-H分子,进而表现出良好的清除DPPH自由基的能力。但由于蛋白质分子在高温下不稳定,高温糖基化反应时间越长,蛋白质分子不稳定组分所占比例增加,作为氢供体的蛋白质分子减少,故导致DPPH自由基和ABTS自由基清除率在一定的反应时间后增加幅度减缓。2.6 还原能力
还原能力可作为抗氧化活性的重要指标。还原能力的测定是根据样品溶液中的还原剂能将铁氰化钾还原成亚铁氰化钾,进一步与三氯化铁反应生成普鲁士蓝,此时样品溶液在700 nm波长处具有最大吸收值,吸收值越大代表样品的还原能力越强。乳清分离蛋白与葡聚糖在不同反应时间的糖基化产物的还原能力如图9所示。由图9可以看出,随着糖基化反应程度的增加,糖基化产物的还原能力呈增大趋势,其中,0~48 h时的糖基化产物的还原能力增加显著(P
<0.
05),其后糖基化产物的还原能力增加已不显著(P
<0.
05)。DAGLIA等提出,糖基化产物是一种特别复杂的混合物,由许多不同分子量的化合物组成,尤其是高分子量的化合物,这些高分子量化合物是美拉德反应高级阶段的聚合产物,对抗氧化活性起着主要作用。此外,这些高级糖基化产物的羟基可能在其还原活性中发挥重要作用。另外,糖基化反应的中间产物还原酮类化合物能够作为氢供体,阻断自由基链式反应,使糖基化产物表现出较强的还原能力。研究中糖基化产物的还原能力与文献[22]报道一致,与DPPH自由基和ABTS自由基清除能力变化趋势相似,初步表明乳清分离蛋白与葡聚糖的糖基化产物具有一定的抗氧化活性。
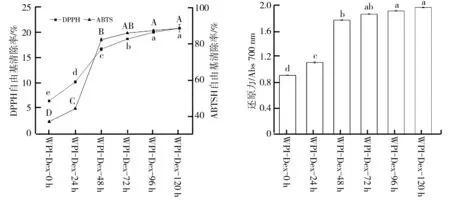
图8 乳清分离蛋白与葡聚糖糖基化产物对 图9 乳清分离蛋白与葡聚糖糖基化 DPPH和ABTS自由基的清除能力 产物的还原能力图8注:不同小写字母表示DPPH自由基清除率差异显著(P<0.05),不同大写字母表示ABTS自由基清除率差异显著(P<0.05);WPI-Dex-0 h、WPI-Dex-24 h、WPI-Dex-48 h、WPI-Dex-72 h、WPI-Dex-96 h、WPI-Dex-120 h分别为乳清分离蛋白与葡聚糖糖基化反应0 h、24 h、48 h、72 h、96 h、120 h时的产物。图9注:不同字母表示差异显著(P<0.05);WPI-Dex-0 h、WPI-Dex-24 h、WPI-Dex-48 h、WPI-Dex-72 h、WPI-Dex-96 h、WPI-Dex-120 h分别为乳清分离蛋白与葡聚糖糖基化反应0 h、24 h、48 h、72 h、96 h、120 h时的产物。
3 结论
通过单因素试验探讨了蛋糖比、反应温度、反应时间及相对湿度对乳清分离蛋白与葡聚糖糖基化反应的影响,在此基础上,利用响应面试验优化得到糖基化反应的最优工艺条件;与乳清分离蛋白相比,乳清分离蛋白糖基化产物表现出较好的溶解性、pH稳定性和热稳定性,以及较高的清除DPPH、ABTS自由基能力和还原能力;在一定的反应时间范围内,随着糖基化反应时间延长,所得到的糖基化产物的溶解度、pH稳定性和热稳定性均越高,其抗氧化活性也越强。利用食品成分如多糖、多酚及油脂对乳清分离蛋白进行改性以提高乳清分离蛋白的功能特性及抗氧化活性,提高乳清分离蛋白在食品中的应用具有非常重要的意义,但还需要进一步深入研究乳清分离蛋白糖基化产物的绿色制备技术,尤其是对热和pH稳定的糖基化蛋白的绿色制备及其对食品功能因子稳态化、控释及安全评价的研究。
