矿化丝素/聚乳酸载万古霉素复合材料的制备与改性研究*
2021-03-08任华杰甘芳巾连小洁牛宝龙张全有李志军何志敏
任华杰,甘芳巾,连小洁,黄 棣,牛宝龙,李 芬,张全有,李志军,何志敏
(1.太原理工大学 生物医学工程学院生物医学工程系 纳米生物材料与再生医学研究中心,太原 030024;2.太原理工大学 生物医学工程研究所 材料强度与结构冲击山西省重点实验室,太原 030024;3.太原理工大学 材料科学与工程学院,太原 030024;4.太原理工大学 机械与运载工程学院,太原 030024;5.北京奥精医药科技有限公司,北京 100176)
0 引 言
感染性骨缺损在临床上一直是比较棘手的问题,传统的治疗方式如手术清创等只能控制感染而不能治愈,静脉注射药物容易引起全身性的反应并且经常导致感染区域的药物浓度不足[1]。因此寻找一种药物载体在感染局部定量释放药物就显得十分重要[2-3]。
丝素蛋白是一种优异的生物材料,由于其良好的力学性能和生物相容性,以及可以通过各种方式化学改性获得了很多应用[4-5]。在其蛋白大分子链上有一些羧基约占摩尔比1.1%,因此可以通过生物矿化原理制备矿化丝素[6]。矿化丝素有更好的生物相容性,与高分子材料复合可以在一定程度控制药物的释放,使得它可以更好的应用于骨组织工程支架[7-8]。
聚乳酸作为一种可被人体吸收的生物材料获得了很大的应用,具有优异的综合性能。研究中聚乳酸的降解产物显酸性,经常导致无菌性炎症,因此对聚乳酸应用的改进也有很多研究[9-11]。通过混入碱性物质平衡PH来改善局部环境是一种常用的方法,羟基磷灰石在水中呈碱性,本研究将羟基磷灰石矿化的丝素蛋白与聚乳酸混合可后使用可以在一定程度上中和酸碱度,一定程度上减少无菌炎症的发生。同时丝素蛋白矿化表面以使钙磷盐沉积,促进成骨。
万古霉素作为一种抗生素,在临床上经常通过静脉注射的方式用于治疗严重的感染,然而静脉注射经常会导致全身性的反应并且经常导致感染部位的药物浓度不足,因此需要通过一种药物载体使万古霉素在感染局部定量释放[12-13]。
在本次研究中,我们将矿化丝素与聚乳酸复合,负载万古霉素,通过控制降温速度控制聚乳酸的结晶过程[14-15],得到一种性能在一定范围可控的骨组织工程支架,并对微观结构、力学、药物释放、降解等性能进行研究,期望该矿化丝素/聚乳酸载万古霉素骨组织工程支架在感染性骨缺损中有更好的应用。
1 实 验
1.1 矿化丝素/聚乳酸/万古霉素复合材料的制备
1.1.1 矿化丝素的制备
将蚕丝放入煮沸的0.05%的碳酸钠溶液30 min,浴比1∶20重复3次脱胶。脱胶后烘干,将烘干后的丝素蛋白用三元溶液(水:无水乙醇:无水氯化钙=8∶2∶1)溶解,浴比1∶10。溶解后用透析袋透析得到丝素蛋白溶液。选取适量的丝素蛋白溶液使丝素蛋白的质量为5 g,加入配置好的氯化钙溶液(无水氯化钙10.72 g,去离子水132.66 mL),室温下搅拌2 h后加入磷酸溶液(钙∶磷=1.66磷酸6.71 g,去离子水99.02 mL),搅拌2h。逐滴加入氢氧化钠使溶液PH保持在10,搅拌5 h待矿化完全并且PH值不变后静置24 h,然后离心,将离心后的沉淀冻干24 h后过筛得到粉末状的矿化丝素,标记为SF/HA。
1.1.2 复合材料的制备
将分子量为12万的聚乳酸溶解在1,4-二氧六环中(4g聚乳酸40ml的1,4-二氧六环),搅拌4 h待其完全溶解,然后加入4 g制备好的矿化丝素,搅拌30 min,待混合均匀后加入0.4 g万古霉素再搅拌2 h,将一部分倒入室温下的模具(室温25 ℃)然后转移到-20 ℃冰箱冷冻2 h,缓慢冷冻得到结晶态的聚乳酸,标记为SF/HA/PLA1,另一部分倒入预先在-20 ℃冰箱中冷冻24 h的模具,然后转移到-20 ℃冰箱,快速冷冻,得到非结晶态的聚乳酸,标记为SF/HA/PLA2,冷冻2 h,将冷冻好的材料冻干后得到矿化丝素/聚乳酸/载万古霉素的复合材料。
1.2 样品的性能及表征
1.2.1 抗压强度测试
采用Instron-5544压机测试材料的力学性能。将材料制成直径9 mm,高15 mm的圆柱体,在拉压机下进行抗压强度测试,压缩速度2 mm/min,最大压缩10 mm,获得该材料的应力-应变曲线。
1.2.2 表面微观形貌表征
使用扫描电子显微镜(日本JEOL公司的SM-7100F)观察材料的表面形貌。首先将材料粘附到导电胶上,然后喷金放入电镜下观察。当观察样品的表面形态时,将电压调节至5 kV。
1.2.3 孔隙率
用液体置换法测量材料的孔隙率,样品的重量以W1表示,将其浸入异丙醇中,并通过一系列的抽空-再加压循环将其压入材料的孔中。此时,将材料取出,并将其质量测量为W2。将一定量的异丙醇倒入烧杯中,读取体积V1,将浸泡在异丙醇中的材料放入烧杯中,读取体积V2,材料的孔隙率为(W2-W1)/ρ(V2-V1)×100%。
1.2.4 X射线衍射分析
测试前将样品制成粉末状,使用DX-2700射线衍射仪(昊源仪器公司)分析样品的结晶度。
1.2.5 药物释放及降解性能
将SF/PLA1与SF/PLA2各取3个重复样后称重,然后放入离心管。样品均为直径9 mm高15 mm的圆柱。加入5 mL PBS后,将其放在37 ℃的恒温振荡器中缓慢振荡,每两天更换一次PBS并收集,用紫外分光光度计测量其吸光度,由标准曲线计算出PBS中万古霉素的浓度,从而计算出万古霉素的质量,由此得到药物释放曲线。
将降解30 d的材料称重记为m1,与材料的初始重量m2对比,得到材料降解30 d的降解率降解率的计算公式为:(m2-m1)/m2×100%
2 结果与讨论
2.1 矿化丝素的制备
矿化丝素SF/HA材料的微观形貌如图1所示。其中图1(a)为三元溶液溶解的丝素蛋白制备的矿化丝素的SEM图,(c)为对该方法制备的矿化丝素的多张电镜照片统计的粒径分布,可以看出三元溶液溶解的丝素蛋白制备的矿化丝素粒径大约分布在5~20 μm,从(b)中可以看出制备的SF/HA外观形貌为白色粉末状,本身没有强度,需要与别的高分子材料复合才能更好地应用于骨组织工程。

图1 矿化丝素微观形貌
2.2 SF/HA/PLA的力学强度测试
PLA是常用的医用高分子材料,SF/HA/PLA的力学性能受PLA影响,高分子链段的堆砌结构直接影响SF/HA/PLA的力学性能,PLA的结晶过程如图2所示。其中图2(a)为熔融状态下的聚乳酸,大分子链段有很强的运动能力,彼此之间的空间很大。随着温度降低,大分子链段的运动能力减弱,彼此空间减小,整个体系能量降低,此时为无定型堆积PLA,如图(b)所示。温度再缓慢降低,整个体系能量进一步减少,大分子链段的堆砌程度更加紧密,成为一种更加紧密的无定型堆积PLA,如图(c)所示。温度进一步降低,大分子链段以结晶的方式堆砌,使整个体系处于能量最低状态,如(d)所示。温度过快降低,会使高分子以图(b)或(c)的形式堆砌,得不到充分结晶的材料。在熔融状态降温与在溶液中降温有类似的结晶过程,因此在本次研究中采用缓慢降温与快速降温两种方式分别得到了微观组成结晶状态的SF/HA/PLA1(图3a)与无定型堆砌状态的SF/HA/PLA2(图3b),这种不同的堆砌结构造成了他们力学性能的不同。
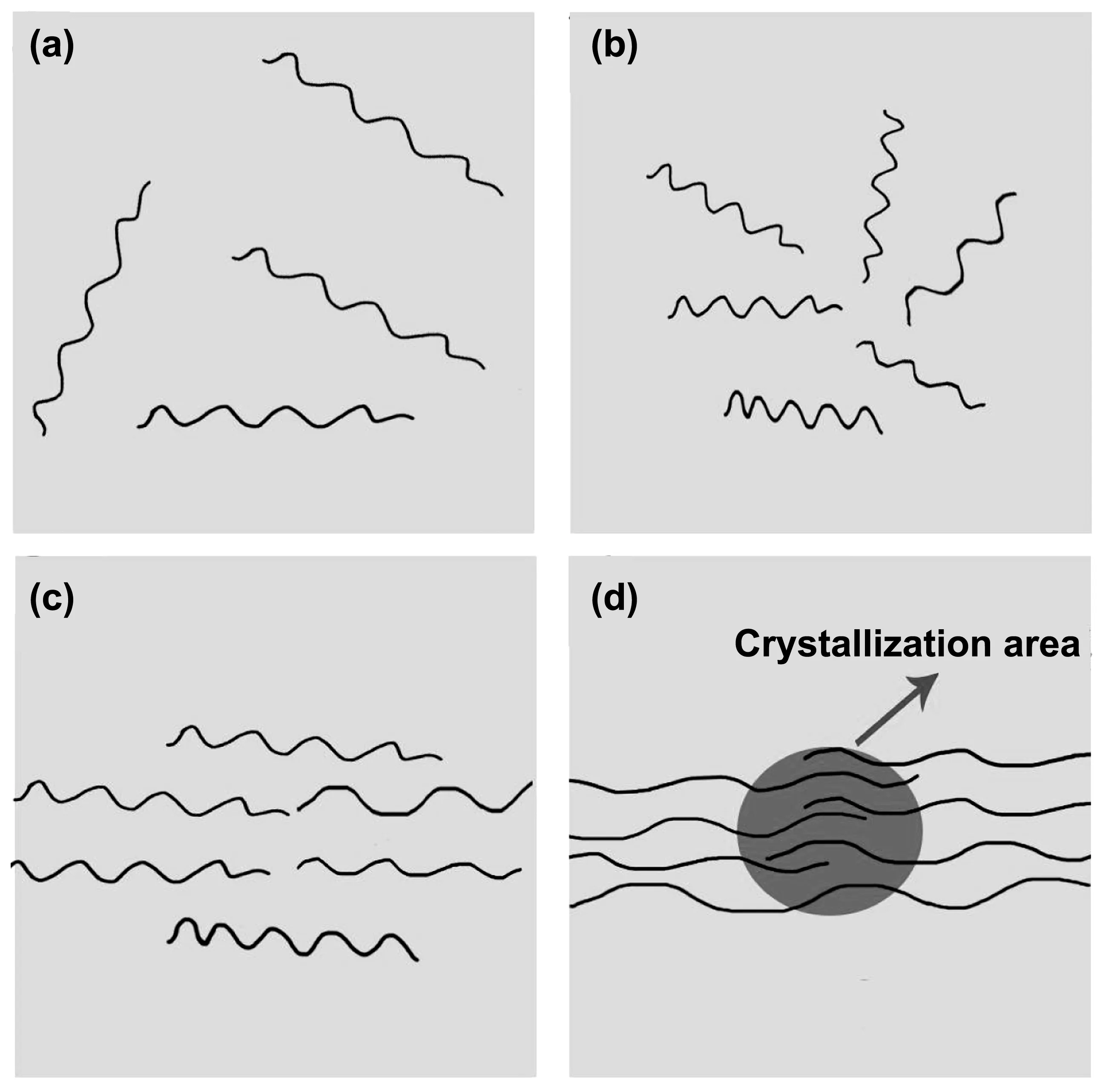
图2 聚乳酸高分子结晶示意图(a)熔融态PLA;(b)无定型堆积PLA;(c)更加紧密的无定型堆积PLA;(d)结晶态PLA
力学压缩测试是可以评估材料植入人体后的最大受力程度,从图3(d),(e)可以看出SF/HA/PLA1是脆性的,在到达最大抗压强度1MPa之后断裂,而SF/HA/PLA2是韧性的,在压缩完成后仍可以保持完整。大分子链段的堆砌结构对高分子材料的力学性能影响较大,从图3 ℃中可以看出在材料破碎之前,结晶型材料SF/HA/PLA1的弹性模量一直高于非结晶型材料SF/HA/PLA2,这与其它高分子的性能相似,压缩时应力集中于结晶区,从而有更大的弹性模量。但是非结晶型材料SF/HA/PLA2在应变0~70%内都能承受较大的应力。对其力学性能的研究有望拓宽聚乳酸基复合材料的临床应用。

图3 SF/HA/PLA的结构示意图和力学测试(a)(b)分别为SH/HA/PLA1和SF/HA/PLA2的微观结构示意图;(c)为 SH/HA/PLA1和SF/HA/PLA2的应力应变图;(d)(e)分别为 SH/HA/PLA1和SF/HA/PLA2压缩前后对比
2.3 SF/HA/PLA的微观形貌
SF/HA/PLA的微观形貌如图4所示。其中(a)是SF/HA/PLA1的微观形貌,(b)是SF/HA/PLA2的微观形貌。(a,b)都是多孔的,他们的孔隙率分别为(80.16±1.2)%和(82.36±1.69)%。孔是由溶剂1,4-二氧六环冻干之后形成的,这就说明可以通过控制溶质溶剂的比例来控制材料的孔隙率,在一定范围内改变材料的孔隙率可以使其更好地应用于骨修复。图4(a 和b)为相同放大倍数下的图像,从图中可以看出SF/HA/PLA1的孔径大小明显大于SF/HA/PLA2,而且通过多组电镜照片计算测量得出SF/HA/PLA1的孔径主要分布在60-90μm,而SF/HA/PLA2的孔径主要分布在10-20μm,如图4c,d所示。这是由于SF/HA/PLA2在冷却凝固成型时速度较快,溶剂1,4-
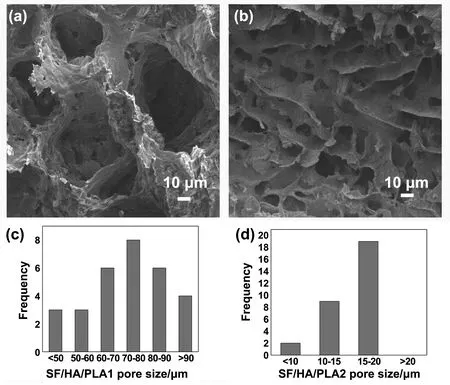
图4 SF/HA/PLA的微观形貌(a)(b)分别为SH/HA/PLA1和SF/HA/PLA2的微观形貌;(c)(d)分别为 SH/HA/PLA1和SF/HA/PLA2的孔径分布(n=30)
二氧六环结晶的晶核在较小的情况下就已凝固,而SF/HA/PLA1冷却凝固较慢,溶剂有足够的时间使晶核长大,从而造成了不同的孔径大小,这也说明我们可以通过类似的控制体系凝固速率的办法来在一定程度上控制材料的孔径大小,使其更好地应用于临床骨缺损修复。
2.4 SF/HA/PLA1和SF/HA/PLA2的结晶性
XRD图像中峰的高低可以表示材料结晶程度的高低,SF/HA/PLA1和SF/HA/PLA2的XRD图像如图5所示。
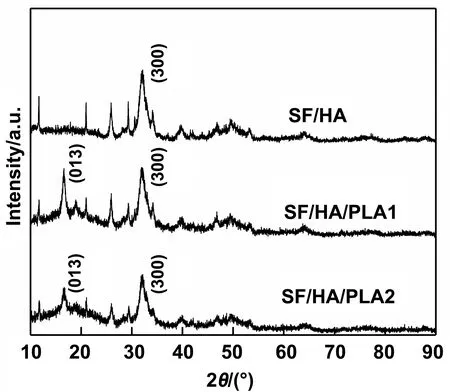
图5 SF/HA和SF/HA/PLA的XRD
从图5中可以看到在30~40°之间是羟基磷灰石的峰,通过对比可以看出在15~ 20°之间的峰属于聚乳酸,SF/HA/PLA1的峰明显高SF/HA/PLA2的峰,这就说明SF/HA/PLA1的结晶度高于SF/HA/PLA2;同时结晶度的高低也可以从力学测试中看出,一般高分子的结晶度和力学性能是有较大的关联,结晶度的增加使材料变脆变硬。当材料冷却凝固成型过程中,SF/HA/PLA1的聚乳酸有较长的时间充分结晶(溶剂结晶导致聚乳酸从溶剂中析出堆砌),SF/HA/PLA2的聚乳酸在较短时间及较快的冷却速度下倾向于形成无定型堆积。这也与聚乳酸的结晶规律一致,降温速率越慢形成的聚乳酸结晶度越高。结晶度的不同导致两种相同的材料表现出不同的性能。
2.5 药物释放及降解性能
两种不同的堆砌结构必然导致加载于其中的小分子药物释放行为不同,如图6(d)所示。结晶区的药物分子更难释放出来,而无定型堆积则较容易就将小分子药物释放出来。结晶是最致密的一种结构,药物释放行为单一,无定型堆积则可以通过控制不同的堆积密度来控制药物的释放,参考图2高分子结晶示意图。
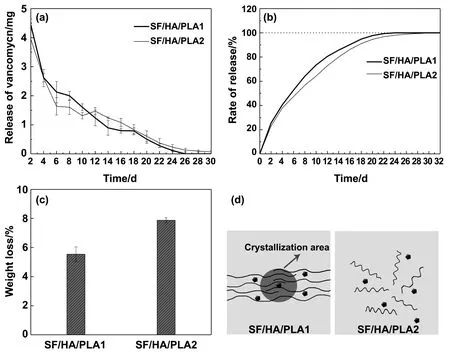
图6 SF/HA/PLA的药物释放、降解率和微观结构示意图(a)SH/HA/PLA1和SF/HA/PLA2的药物释放图;(b)SH/HA/PLA1和SF/HA/PLA2药物累计释放图;(c)SH/HA/PLA1和SF/HA/PLA2的降解图;(d)SH/HA/PLA1和SF/HA/PLA2的药物释放示意图
图6中(a)为SF/HA/PLA1与SF/HA/PLA2的药物释放图,(b)图为累计释放。在26 d的时候SF/HA/PLA1药物释放结束,SF/HA/PLA2的结束时间为30 d。从图中可以看出在12 d之前SF/HA/PLA2的药物释放量小于SF/HA/PLA1,在12 d之后高于SF/HA/PLA1。从(b)图中可以更加直观的看出SF/HA/PLA2的累计释放量一直低于SF/HA/PLA1,延长了药物的释放周期。可能因为结晶型材料中残留药物无法彻底释放出来,而且材料的孔径结构也会在一定程度影响药物释放,如图4所示,SF/HA/PLA1主要分布的孔径大于SF/HA/PLA2的孔径。
图6(c)为两种材料在PBS中一个月的降解率,其中SF/HA/PLA1的降解率在5.5%左右,SF/HA/PLA2的降解率在7.8%左右。这说明材料的降解与材料的堆积致密程度有一定关系,致密的堆积结构更难降解。
3 结 论
丝素蛋白是一种生物相容性很好的生物材料,通过化学改性可以应用在很多领域。纳米羟基磷灰石矿化的丝素蛋白在骨组织工程有一定的研究。丝素蛋白可控的降解性能可以调节与新骨的形成的速度[16];但同时也可以通过不同的制备方法控制丝素蛋白的微观尺寸来进一步控制它的降解行为。纳米羟基磷灰石在被人体吸收的同时为新骨的形成提供钙和磷,促进新骨的生长。这些优势使得矿化丝素在骨组织工程中有一定的应用价值。
矿化胶原/聚乳酸复合材料作为一种骨修复材料在临床上有很多应用,这是一种生物相容性非常好的材料,有跟人体骨相似的微观结构,在治疗骨缺损时有非常好的疗效。然而非人源性的胶原会引起免疫排斥反应,同时它的降解速度过快,经常在新骨还未形成便已完全降解,导致手术失败。我们制备的矿化丝素/聚乳酸是希望减少这一免疫排斥反应。同时由于本研究的矿化丝素/聚乳酸材料通过改变聚乳酸结晶态可以使降解速率得以调节,有望在后续研究中与新骨的形成速度匹配,得到更好的疗效。
将万古霉素加载到矿化丝素/聚乳酸复合材料上可以治疗感染性骨缺损,这种复合体系可以在感染部位30 d内持续释放药物,不仅提高了药物的利用效率同时也减少了静脉注射带来的全身性反应。这种体系是一种更加合理的药物控释方式。通过控制温度来控制聚乳酸的堆积致密程度也可以应用于其他以聚乳酸为基的药物控释体系中,如聚乳酸微球、薄膜等包裹药物的控释体系,本研究采用的控制降温速率的办法就是为了改变聚乳酸的堆积致密程度,来调节药物释放行为。在后面的研究中我们可以通过调节丝素蛋白的提取方法、聚乳酸的分子量等一系列的方法来控制万古霉素的释放行为,使万古霉素的释放更好的满足临床治疗感染的需求。
聚乳酸作为矿化丝素/聚乳酸/万古霉素复合材料的基体材料,其性能很大程度上影响复合材料的力学性能。聚乳酸结晶态是最致密的一种堆积方式,然而结晶态的高分子脆性和刚度都比较大,容易破碎,也不容易加工。非结晶态的聚乳酸韧性大,不容易破碎,也更容易加工,在压缩到90%的时候可以承受压力42.57 MPa,由于压缩强化,在压缩到某一个状态时会与人体密质骨的力学强度相匹配可拓宽聚乳酸复合材料在骨组织工程中的应用。
SF/HA/PLA的微观形貌还受多种因素影响,溶剂结晶晶体的大小决定了孔径的大小,而晶体的大小又由整个体系凝固时间决定,凝固时间越长,晶体越大,孔径也就越大,通过控制降温速度可以控制整个体系的结晶时间。这就说明我们可以通过这种方式来在一定程度控制材料的微观孔结构,来使其更好的满足细胞粘附、迁移、增值的需求。
研究通过生物矿化原理制备了矿化丝素并于聚乳酸复合负载万古霉素。通过降温速率的改变控制聚乳酸的结晶过程,得到微观孔结构、药物释放行为、力学性能及降解速率不同的两种材料,拓宽了矿化丝素/聚乳酸复合材料在骨科临床上的应用。
