基于CuAl-LDH载体制备高分散Cu/ZnO/Al2O3催化剂及其催化性能
2021-03-08张华成孔令奇李忠郑华艳
张华成,孔令奇,李忠,郑华艳
(太原理工大学煤科学与技术教育部和山西省重点实验室,山西太原030024)
甲醇是绿色环保的能源载体,在化工和能源工业中具有重要的地位[1]。工业合成甲醇主要采用Cu/ZnO/Al2O3催化剂,在工业生产中该类催化剂通常采用共沉淀法来制备。然而,传统共沉淀制备的催化剂前体物相组成复杂,焙烧后形成的催化剂表面结构不均一,Cu/ZnO分布不均,Cu-ZnO之间的相互作用较弱,且反应过程中铜物种易团聚长大,影响催化剂催化性能的提升。许多研究者从催化剂的合成方法、助剂、载体结构等方面对催化剂进行调变,并研究它们对催化剂稳定性和活性的影响。Zhao 等[2-3]采用水解沉淀法制备出了具有层状硅酸盐物种的CuZnO-SiO2催化剂用于乙酸乙酯加氢制乙醇的反应中,提高了催化剂中Cu物种的分散度,增强了金属-载体之间的相互作用力,在反应过程中表现出优异的催化性能。虽然铜基催化剂在结构多样性、产品选择性和催化稳定性方面取得了重要进展,但如何解决铜基催化剂在催化反应过程中的失活问题仍面临着巨大的挑战。
利用水滑石层板的限域效应制备活性位高度分散的催化材料,备受研究学者关注[4-5]。水滑石主体板层的限域效应主要体现在“表面网结构”和“表面阱结构”,其中“表面网结构”可为活性组分提供锚定位点,提高活性组分的分散度,“表面阱结构”可提高催化活性组分的稳定性。无机纳米颗粒的团聚长大主要是由粒子间的斥力(静电斥力)和引力(范德华力)所决定的,水滑石颗粒表面的Zeta电位升高有助于增加静电斥力,可以有效地抑制表面活性金属原子的迁移聚集[6]。Long 等[5]利用带正电荷纳米片之间的静电引力将导电石墨烯插入NiFe-LDHs水滑石层间,作为电催化剂用于析氧反应。FeNi-GO的层状结构能够增加催化剂中活性位点数量,而且氧化石墨层通过增加水滑石的层间距可进一步提高催化剂表面活性位点暴露的数量,缩短了纳米尺度的离子运输距离,促进了电子的传递,表现出良好的催化性能。Cao 等[7]通过共沉淀法原位生长在改性的碳纳米管表面制备了CuCo-LDH 催化剂,还原后得到高分散Cu-Co/CNTs 双金属纳米催化剂,由于碳纳米管良好的导热性,能够有效地抑制烯烃和CO2的产生,催化剂表现出较高的活性和C2+醇选择性。Fang等[4]采用共沉淀法制备MgAl-LDH 负载CuO-ZnO-ZrO2催化剂用于CO2加氢合成甲醇反应中,CZZ-LDO 催化剂比表面积提高至152.3m2/g,铜分散度达到66.0%,远高于无载体的CZZ 催化剂,MgAl-LDH 的加入能够增强Cu、Zn之间的相互作用,抑制反应过程中Cu物种的团聚长大,表现出较好的催化活性和稳定性。可见,类水滑石及其衍生复合金属氧化物作为催化剂载体有利于增强金属-载体强相互作用(strong metalsupport interaction, SMSI),提高活性组分的分散性,增加催化剂的热稳定性,从而提升其催化效率[4,8]。
本文基于CuAl-LDH的二维表面限域效应,首先通过沉积沉淀法合成层状的CuAl-LDH载体,然后经过活化将Cu2+、Zn2+沉积在水滑石表面,经热处理后得到水滑石负载的CuZnAl-LDO催化剂,并通过电感耦合等离子体发射光谱(ICP)、X射线衍射(XRD)、H2程序升温还原(H2-TPR)、N2O 化学吸附、N2吸脱附、透射电镜(TEM)和X射线光电子能谱(XPS)氧化还原滴定对催化剂及其前体结构性质进行表征,并结合活性评价结果,探究了CuZnAl-LDO复合催化剂中高分散的Cu、ZnO物种和金属-载体相互作用与催化性能之间的构效关系。
1 实验部分
1.1 试剂和气体
硝 酸 铜[Cu(NO3)2·3H2O, AR 级], 硝 酸 锌[Zn(NO3)2·6H2O,AR 级],硝 酸 铝[Al(NO3)3·9H2O,AR 级],NaOH 和无水Na2CO3(AR 级),天津市科密欧化学试剂有限公司;合成气(99.99%),大连大特气体有限公司);氮气(99.99%),氢气(99.99%),太原钢铁公司;氦气(99.999%),北京氦普北分气体有限公司。
1.2 样品的制备
1.2.1 CuAl-LDH载体的制备
CuAl-LDH 载体采用共沉淀法制备[9],称取18.12g Cu(NO3)2·3H2O和9.38g Al(NO3)3·9H2O溶于去离子水中配制成100mL溶液,以NaOH和Na2CO3的混 合 溶 液(NaOH=1.5mol/L,C[Na2CO3]=2C[Al3+])作为沉淀剂先将上述两种溶液在室温搅拌下并流滴入装有100mL 去离子水的烧杯中,通过控制流速保持pH=10±0.1。沉淀完成后,继续搅拌在室温下老化12h,然后洗涤抽滤5次,以除去Na+离子,滤饼在80℃烘干、研磨。
1.2.2 CuxZn1-x/CuAl-LDO复合催化剂的制备
将3g CuAl-LDH 载体和100mL 去离子水加入烧杯中,超声30min,转移至恒温水浴中加热至65℃活化30min,将一定量Cu/Zn 比的Cu(NO3)2·3H2O 和Zn(NO3)2·6H2O 溶液在室温搅拌下并流滴入装有30mL 去离子水的烧杯中,通过控制流速保持pH=7.0±0.1,沉淀完成后,继续搅拌老化2h,洗涤抽滤5 次,得到的滤饼放入100℃烘箱干燥12h。所得催化剂前体在马弗炉中330℃下焙烧4h 得到催化剂。降至室温后,压片造粒(40~60目)。通过ICP分析得到催化剂中Cu∶Zn∶Al比例[x∶y∶(1-x-y)],前体命名为CuxZnyAl(1-x-y)-LDH,催化剂命名CuxZnyAl(1-x-y)-LDO。为了对比,采用常规共沉淀法制备了Cu0.6Zn0.3Al0.1-CP催化剂[10]。
1.3 样品的表征
采用日本岛津公司ICPS-7500型等离子体发射光谱仪分析催化剂中Cu、Zn和Al的元素含量,称取一定量的催化剂溶解在稀酸中,将溶解液定容至100mL容量瓶中备用,可根据标样浓度进一步稀释到需要的浓度区间。
采用日本理学Rigaku Smartlab 型X射线衍射仪分析前体以及催化剂物相组成。Cu Kα射线,管电压和管电流分别为40kV 和30mA。扫描范围为5°~80°,扫描速率为8°/min;根据Scherrer公式计算催化剂的平均晶粒尺寸[11]。
N2物理吸附分析采用意大利SORPTMATIC1990型自动吸附仪分析催化剂的比表面积。称取0.1g样品,先在250℃真空下预处理4h,随后进行N2吸附/脱附实验,利用Brunauer-Emmett-Teller 方程计算出样品的比表面积。
X 射线光电子能谱分析采用美国VG Scientific公司ESCALAB 220iXL型光电子能谱仪。激发源为Al KαX 射线(hν=1486.6eV),功率300W,基础真空3×10-4Pa,电子结合能用污染碳的C1s 峰(284.6eV)作为内标校正。
透射电子显微镜分析采用日本电子公司JEM-2100F型场发射透射电子显微镜,加速电压200kV。将样品研磨至200目以上,取少量粉末通过超声处理分散于乙醇中,取上清液滴加在铜网炭支持膜上,待乙醇挥发干,将铜网炭膜置于样品杆上,通过TEM真空系统去除水分,检测样品。
H2的程序升温还原表征采用美国Micromeritics公司的Autochem Ⅱ2920 型化学吸附仪进行分析。取20mg样品,放入反应管中,在50mL/min的He气流量下以10℃/min 的升温速率升温至250℃,恒温吹扫30min,然后降温至60℃,切换为50mL/min的10%H2/Ar混合气。稳定之后,升温到600℃,期间H2的消耗量可通过热导检测器(TCD)检测得到。
N2O-H2氧化还原滴定也在AutoChem Ⅱ2920仪器上进行。将40mg样品装于U形石英反应管中,首先在N2气氛下升温至250℃,恒温吹扫30min,然后降温至50℃时,将气体切换为10%H2/Ar,升温还原至700℃,使催化剂中的Cu物种全部还原为Cu0,然后降温至60℃,接着通入N2O 气体将催化剂表面的Cu0氧化为Cu2O,最后再在10%H2/Ar 气氛下升温还原至500℃,将Cu2O 全部还原为Cu0。表面Cu 物种的比表面积(m2/gCu)及分散度计算公式见式(1)。
SCu=2X×NA/(1.4×1019a), D=2X×MCu/a (1)
式中,X 为第二次还原H2的消耗量,mol/g;a为铜的负载量,%;NA为阿伏伽德罗常数,6.02×1023/mol;1.4×1019为1m2Cu 原子的数量;MCu为Cu的相对原子质量,63.46g/mol。
1.4 催化剂活性评价
催化剂活性评价在连续双通道高压固定床微反应装置上进行。将40~60 目的催化剂与石英砂按1∶1 混合均匀后置于内径为5mm 石英管反应器的中部恒温区。首先,通入H2和N2的混合气[V(H2)∶V(N2)=1∶4],总流量为50mL/min,以2℃/min升温至250℃,常压还原4h。然后自然降温至50℃,将还原气体切换为合成气[V(H2)∶V(CO)∶V(CO2)∶V(Ar)=17.3∶6.3∶2.1∶0.3],气体总流量为26mL/min,其中Ar 气是内标物。装置压力升至3MPa,温度以2℃/min 升到250℃,达到稳态后,采用GC-950气相色谱在线取样分析。用氢火焰离子化检测器(FID)检测甲醇、乙醇等有机物,用TCD检测H2、CO、CO2等,采用内标法定量分析各组分的含量。
CO 和CO2的转化率Xco、Xco2和甲醇时空收率STY计算公式[12]分别见式(2)、式(3)和式(4)。


式中,COfeed、CO2feed和Arfeed为催化反应前在色谱中相对应的各气体的峰面积;COreaction、CO2reaction和Arreaction为反应过程中各气体在色谱中对应的峰面积;nCO和nCO2分别为CO和CO2的摩尔流率,mol/h;QCO和QCO2分别为进气中CO和CO2的摩尔分数,%;P和T分别为质量流量控制器的校准压力和校准温度,Pa和K;φ为进气的总流速,mol/h;STYMeOH为甲醇的时空收率,g/(g·h);mcat为反应管填装催化剂的质量,g;MMeOH为甲醇的相对分子质量,32.04g/mol。
2 结果与讨论
2.1 XRD表征
图1为前体和催化剂的XRD 谱图。由图1(a)可知,所有CuxZnyAl(1-x-y)-LDH 和CuAl-LDH 样品都在11.8°和23.7°出现了类水滑石的特征衍射峰,分别对应类水滑石样品的003 和006 晶面[9],说明制备的样品是具有较好晶型的水滑石结构。同时,Cu0.6Zn0.3Al0.1-LDH 和Cu0.5Zn0.4Al0.1-LDH 前 体 在2θ为13.0° 、 24.8° 和30.8° 处 出 现 了 绿 铜 锌 矿(Cu, Zn)5(CO3)2(OH)6的特征衍射峰,说明采用共沉淀法制备过程中在水滑石载体表面主要生成的是绿铜锌矿物相,而共沉淀法制备的Cu0.6Zn0.3Al0.1-CP前体同时出现了锌孔雀石(Cu,Zn)2(CO3)(OH)2和绿铜锌矿(Cu,Zn)5(CO3)2(OH)6特征峰。共沉淀法制备的(Cu,Zn)2(CO3)(OH)2中Zn最大质量分数为27%[13],当Zn 质量分数为30%时,前体中含有锌孔雀石和少量绿铜锌矿物相。而水滑石制备的前体中,由于CuAl-LDH 载体中提前引入了Cu 物种,后期负载的Cu/Zn 投料比均小于1,因此生成的前体中只生成了绿铜锌矿物相。与CuAl-LDH前体衍射峰强度相比,Cu2+/Zn2+加入后水滑石结晶度均出现不同程度的降低。由于Cu2+具有Jahn-Teller效应,当样品中Cu2+含量较多时,合成的层状结构中八面体结构被破坏,从而导致了其他含铜相的分离,使得体系稳定性下降[14]。由图1(a)还可以发现,与CuAl-LDH相比,负载后CuxZnyAl(1-x-y)-LDH 的003 晶面衍射峰对应的2θ角并未发生变化,说明绿铜锌矿物相没有进入水滑石的层间,主要落位于水滑石载体表面。

图1 不同催化剂焙烧前后的XRD谱图
由图1(b)可以发现,CuAl-LDO 催化剂只在2θ=35°附近出现馒头峰,说明CuAl-LDH前体在焙烧过程中失去水和碳酸根,铜铝氧化物变成高分散或无定形状态。水滑石经过焙烧后,其层间阴离子脱除,水滑石结构会发生坍塌,层状结构消失,但由于水滑石的“拓扑效应”[4],焙烧后催化剂的片层形貌并未发生变化,铜铝仍保持原子水平上的高分散度。CuxZnyAl(1-x-y)-LDO 和Cu0.6Zn0.3Al0.1-CP 催化剂的XRD谱图均出现了CuO和ZnO的特征衍射峰,基于2θ=35.5°和2θ=38.7°处的特征衍射峰通过Scherrer 公式计算出CuO 的平均晶粒尺寸,发现水滑石负载后的CuxZn1-x-LDO催化剂中的CuO晶粒尺寸明显降低,在4~6nm 之间。其中Cu0.6Zn0.3Al0.1-LDO 催化剂CuO的晶粒尺寸为4.8nm,远小于共沉淀制备Cu0.6Zn0.3Al0.1-CP 催化剂的11.3nm,说明将Cu/Zn沉淀到水滑石结构中,可以有效地减小焙烧后催化剂中CuO组分的晶粒尺寸。
2.2 催化剂织构性质

图2 催化剂的吸脱附曲线和孔径分布
图2 为催化剂的低温N2吸/脱附图和孔径分布图。由图可见,所有催化剂的N2吸/脱附曲线均为Ⅳ型等温曲线,表明该催化剂的孔结构以介孔为主。相比于CuAl-LDO 催化剂,CuxZnyAl(1-x-y)-LDO催化剂在高压区具有更高的吸附量。CuAl-LDO 催化剂主要形成的是孔径在3~8nm 范围的介孔,这主要是由前体在焙烧过程中水滑石层间阴离子、H2O 和CO2脱除形成的CuAl-LDO 片上孔,其孔径范围较窄;CuxZnyAl(1-x-y)-LDO 催化剂不仅形成3~8nm 的介孔,还形成了孔径在8~15nm 范围的介孔,这主要是分散在其表面的(CuxZn1-x)5(CO3)2(OH)6前体在焙烧过程中生成的CuO、ZnO颗粒堆积在层板间及表面形成的孔,孔径分布范围较宽[15-16]。
不同催化剂的比表面积、孔径分布以及Cu有效比表面积和分散度结果如表1 所示。与CuAl-LDO 相比,CuxZnyAl(1-x-y)-LDO 催化剂具有较大的孔体积和比表面积,说明水滑石载体负载(CuxZn1-x)5(CO3)2(OH)6前体焙烧后,CuO 和ZnO 小颗粒分散在其表面,提高了催化剂的比表面积和孔体积。其中,Cu0.6Zn0.3Al0.1-LDO 催化剂的比表面积最大,达到67.4m2/g。一般认为,Cu/ZnO/Al2O3催化剂中较高的比表面积和丰富的孔道结构有利于反应物和产物分子的吸附与扩散,进而提高其催化效率[17]。
由表1 还可以发现,CuAl-LDO 水滑石载体中Cu有效比表面积达到63.2m2/g,这是由于水滑石前体中Cu和Al处于原子级均匀排布分散。由XRD结果可以发现,由于水滑石的“拓扑效应”,焙烧后CuAl-LDO中的Cu依然保持高度分散状态,提高了Cu的有效比表面积。经过焙烧的Cu0.6Zn0.3Al0.1-LDO催化剂中Cu 的有效比表面积达到了45.1m2/g,是Cu0.6Zn0.3Al0.1-CP 催化剂的4.1 倍,对比不同Cu/Zn比的CuxZnyAl(1-x-y)-LDO催化剂可以发现,催化剂的Cu 分散度呈现出先增加后降低的变化趋势,Cu0.6Zn0.3Al0.1-LDO 催化剂中Cu 的分散度达到24.4%,高于Cu0.6Zn0.3Al0.1-CP 催化剂,说明采用CuAl-LDH 水滑石物相作为载体可以有效地提高催化剂中Cu 分散度和有效比表面积,进而提高其催化合成气合成甲醇性能[18]。
2.3 H2-TPR表征
采用H2-TPR 对催化剂的氧化还原能力以及催化剂中可还原物种的含量进行分析,结果如图3所示。可以看出,CuAl-LDO 催化剂中CuO的氢气还原峰在260.6℃附近,Al2O3和ZnO在350℃测试范围内不会被氢气还原[19],因此其对应分散在水滑石板层中Al2O3表面且与其发生强相互作用的CuO 的还原峰[20]。Cu0.6Zn0.3Al0.1-CP催化剂在188.9℃附近有一个CuO 的还原峰,表明绿铜锌矿和锌孔雀石焙烧后生成高分散且与ZnO发生相互作用的CuO,与文献报道的CuO 还原峰温度类似[21-22]。采用铜铝水滑石载体制备的CuxZnyAl(1-x-y)-LDO 催化剂在150~200℃(峰Ⅰ)和220~280℃(峰Ⅱ)之间出现两个氢还原峰,可见峰Ⅰ还原峰对应与ZnO发生相互作用高分散CuO 的还原,而峰Ⅱ对应与Al2O3发生相互作用高分散CuO的还原。

表1 催化剂反应前后的织构性质

图3 不同催化剂的H2-TPR谱图
研究表明[23],具有较小尺寸或较高分散度的金属复合物更容易在较低温度下还原。与Cu0.6Zn0.3Al0.1-CP催化剂相比,Cu0.6Zn0.3Al0.1-LDO催化剂中CuO的中心还原温度降低了10℃,说明水滑石载体负载的催化剂中Cu 物种分散性更好且颗粒更小,还原温度更低,同N2O-H2氧化还原滴定和XRD 分析结果一致。由图3 中还可以发现,随着Cu 含量减小,催化剂的中心还原温度呈现出先降低后增加的趋势,Cu0.6Zn0.3Al0.1-LDO 催化剂具有最低的CuO 还原温度,表明在水滑石载体上引入适量比例的铜锌,可以增强Cu-ZnO之间的协同作用,提高CuO的可还原性,有利于提高其催化性能[24-25]。进一步增加锌含量,CuO还原温度反而有所升高,可能是由于过量的ZnO 相覆盖在CuO 表面,起到物理阻隔作用,不利于Cu 物种与H2接触,使CuO 还原温度升高[26]。
2.4 XPS表征
为了探究催化剂表面组成和Cu 物种的化学价态,对催化剂进行XPS表征,结果如图4所示,催化剂表面的Cu、Zn 含量以及相应的结合能数据见表2。可以发现催化剂的Cu2p3/2和Cu2p1/2能级信号相似,且在941~962.5eV 处出现了明显的卫星伴峰,说明催化剂表面铜物种均以CuO 的形式存在[27],在1020~1025eV 处出现的Zn2p3/2峰归属于催化剂表面的Zn2+,说明焙烧后催化剂表面铜锌主要以CuO和ZnO物相存在,与XRD结果一致。由表2可以看出,随着Cu/Zn 比的降低,催化剂中Cu2p3/2结合能呈现先减小后增大的变化趋势,这是由于Cu/Zn 比降低使得催化剂中Cu 物种的分散性增加,CuO的颗粒减小,增大Cu-ZnO的界面,使得Cu2+、Zn2+周围的电子环境发生改变,因而其结合能降低[28]。

图4 催化剂Cu2p和Zn2p的XPS谱图
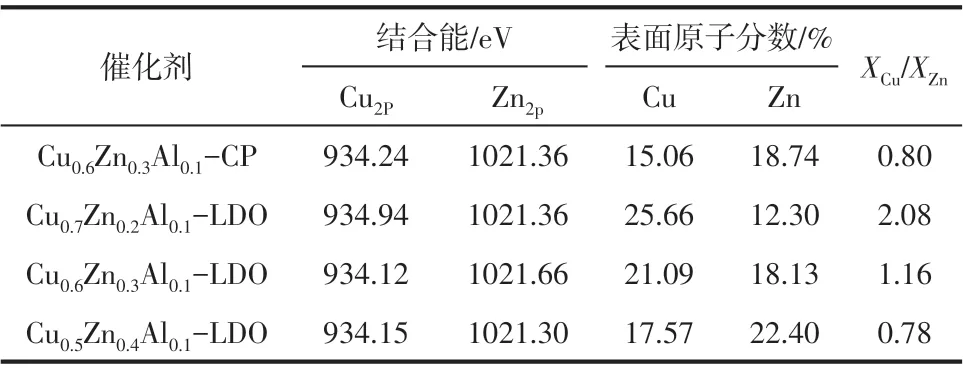
表2 催化剂的XPS分析结果
对比表2 中催化剂表面Cu/Zn 比和ICP 测试得到的体相Cu/Zn 比可知,催化剂表面的XCu/XZn较体相的均明显要低。其中,水滑石载体负载制备的Cu0.6Zn0.3Al0.1-LDO催化剂XCu/XZn由体相中的2.0降至表面的1.2,下降了40%,而共沉淀法制备的Cu0.6Zn0.3Al0.1-CP催化剂中XCu/XZn组成由体相中的2.0降至表面的0.80,下降了60%,后者表面铜锌含量变化更为显著。由于共沉淀制备的催化剂前体主要为锌孔雀石和部分绿铜锌矿物相,焙烧过程中Zn物种容易富集在催化剂表面[29],使其表面XCu/XZn较体相的低;而水滑石为载体制备的催化剂,(CuxZn1-x)5(CO3)2(OH)6前体均匀分布在水滑石表面,由于“拓扑效应”使得焙烧过程中生成的CuO/ZnO颗粒限制在水滑石表面,阻止Cu/Zn物种迁移和聚集,因此Cu0.6Zn0.3Al0.1-LDO 催化剂表面的XCu/XZn相对共沉淀制备的要高一些。

图5 前体和催化剂的TEM图(插图为高分辨率下)
2.5 TEM表征
图5 为前体和催化剂的TEM 图。可以看出,采用共沉淀法制备的Cu0.6Zn0.3Al0.1-CP 前体中[图5(a)]主要包含棒状和不规则片状两种物质,结合XRD 表征结果和文献[30]可知,棒状物质为锌孔雀石,不规则片状物质为绿铜锌矿,且出现明显的片层堆叠,焙烧后催化剂[图5(b)]颗粒存在团聚现象,分散性较差;而Cu0.6Zn0.3Al0.1-LDH 前体中[图5(c)]主要为较小片状物质,其高分辨晶格条纹图[图5(c)内图]中晶面间距d=0.368nm,归属于绿铜锌矿610 晶面,说明前体中绿铜锌矿均匀地分布在层状水滑石载体表面上,焙烧后的催化剂[图5(d)]仍保持水滑石片状基本形貌,生成的CuO/ZnO 颗粒较均匀地分布在载体表面上,催化剂铜锌组分分散性较好,CuO 颗粒尺寸较小。对比图5(d)~(f)可以发现,当Cu/(Cu+Zn+Al)达到0.7时,焙烧后催化剂颗粒出现团聚长大,使得载体片层状结构遭到破坏,结合N2O-H2氧化还原滴定和XRD 结果可知,催化剂中Cu 物种的分散度和有效比表面积均有所降低,铜锌之间的协同作用减弱。
2.6 反应后催化剂的XRD表征
图6 为反应后催化剂的XRD 谱图。可以发现,催化剂在2θ 为43.4°、50.5°和74.3°处均出现了Cu的特征衍射峰,说明反应后催化剂中铜物种主要以Cu0形式存在。基于2θ=43.4°处衍射峰的半峰宽通过Scherrer 公式计算出Cu 晶粒尺寸,见表1。对比Cu0.6Zn0.3Al0.1-LDO 和Cu0.6Zn0.3Al0.1-CP 催 化 剂 反 应 前后铜物种晶粒尺寸可知,反应前Cu0.6Zn0.3Al0.1-LDO催化剂中CuO的晶粒尺寸是Cu0.6Zn0.3Al0.1-CP催化剂的42%,反应后Cu0.6Zn0.3Al0.1-LDO催化剂中Cu的晶粒尺寸是Cu0.6Zn0.3Al0.1-CP催化剂的54%,说明以水滑石为载体制备的催化剂反应前后铜物种均保持较小的晶粒,表明水滑石结构可以抑制反应过程中铜物种的团聚长大,提高催化剂的稳定性。

图6 反应后催化剂的XRD谱图
2.7 活性评价结果
催化剂性能测试是在250℃,3MPa,V(CO)∶V(CO2)∶V(Ar)=72∶24∶4的条件下,在固定床反应器中完成的,评价时间为50h,并对催化性能最好的Cu0.6Zn0.3Al0.1-LDO 催化剂进行了120h 稳定性测试。为了方便比较,对CH3OH 的时空收率结果进行归一化处理,由于有机产物中CH3OH 含量高于99.9%,故未列出有机产物选择性。催化剂的甲醇时空收率见图7。

图7 催化剂活性评价结果
可以发现,催化剂的甲醇收率从大到小排序依次是:Cu0.6Zn0.3Al0.1-LDO>Cu0.5Zn0.4Al0.1-LDO>Cu0.7Zn0.2Al0.1-LDO>Cu0.6Zn0.3Al0.1-CP>CuAl-LDO。 CuAl-LDO 催 化剂的初始活性最低,失活速率最大,说明催化剂中没有锌对铜的作用,其催化性能较差。Cu0.6Zn0.3Al0.1-LDO催化剂的初始活性为883mg/(g·h),反应120h 后失活率仅为2.8%,而共沉淀制备的Cu0.6Zn0.3Al0.1-CP催化剂虽然初始活性相近,但其反应50h失活率就超过了15%,水滑石载体制备催化剂较共沉淀制备催化剂失活速率降低了81%。结合表征结果可知,以铜铝水滑石为载体制备的催化剂,(CuxZn1-x)5(CO3)2(OH)6前体分布在水滑石表面上,由于“拓扑效应”使得焙烧过程中生成的CuO/ZnO颗粒分散在水滑石载体表面上,提高了催化剂的比表面积和孔体积,表现出良好的催化性能;同时片层结构抑制了反应过程中Cu 物种的团聚长大,提高了催化剂的稳定性。
3 结论
本文通过沉积沉淀的方式,成功将不同比例的Cu、Zn 物种引入到水滑石中,制备出一系列CuZnAl-LDO催化剂,用于CO/CO2加氢合成甲醇反应中。由于水滑石的“拓扑效应”,焙烧后层板羟基和水脱除后形成的粗糙表面,不仅能够提高活性组分的分散度,同时对负载在其上的Cu 活性物种起到限域作用,限制Cu 的迁移和聚集。与共沉淀制备的Cu0.6Zn0.3Al0.1-CP 催化剂相比,Cu0.6Zn0.3Al0.1-LDO 催化剂中Cu、Zn 之间具有较强的相互作用,促进催化剂中铜物种的还原,表现出优异的催化性能,甲醇的时空收率最高为883mg/(g·h),反应120h失活率仅为2.8%。
